Valve in Valve TAVI:人工弁の中に留置するTAVIについて(一般の方 向け)
人工弁には機械弁と生体弁がありますが、機械弁は耐久性に優れているが、持続的な抗凝固療法が必要であるというデメリットがあります。一方で生体の組織から作られた生体弁は抗凝固療法の必要がない一方で、 耐久性の問題があります。開胸手術(SAVR)で留置された生体弁は術後およそ10-15年が経過すると形態的な劣化が生じ、人工弁に「狭窄」(弁が硬くなり開きにくくなる)や「逆流)」(弁が閉まらず血液が逆流してしまう)が認められるようになり、「生体弁機能不全 (SVD)」に陥ります(図1)[1]。

図1. Dvir, et al. Standardized Definition of Structural Valve Degenerationより引用
[1]
生体弁機能不全が起こりますと心臓から全身への血流の供給が低下する心不全の状態になる可能性があります。術後は定期的に心エコー検査を行い、機能不全になってきた場合には再治療が必要となります。機能不全に陥った人工弁に対してはこれまで再開胸・人工心肺使用による再手術(再AVR)が唯一の方法でありましたが、2018年7月から機能不全に陥った外科生体弁へのTAVI治療が保険適応になりました。弁膜症治療のガイドラインでは、「手術リスクの高い症例で、生体弁機能不全対するカテーテル治療」は推奨クラスIIa(エビデンス・見解から有用・有効である可能性が高い)と記載されています(図2)[2]。

図2. 2020年改訂版弁膜症治療のガイドライン[2]
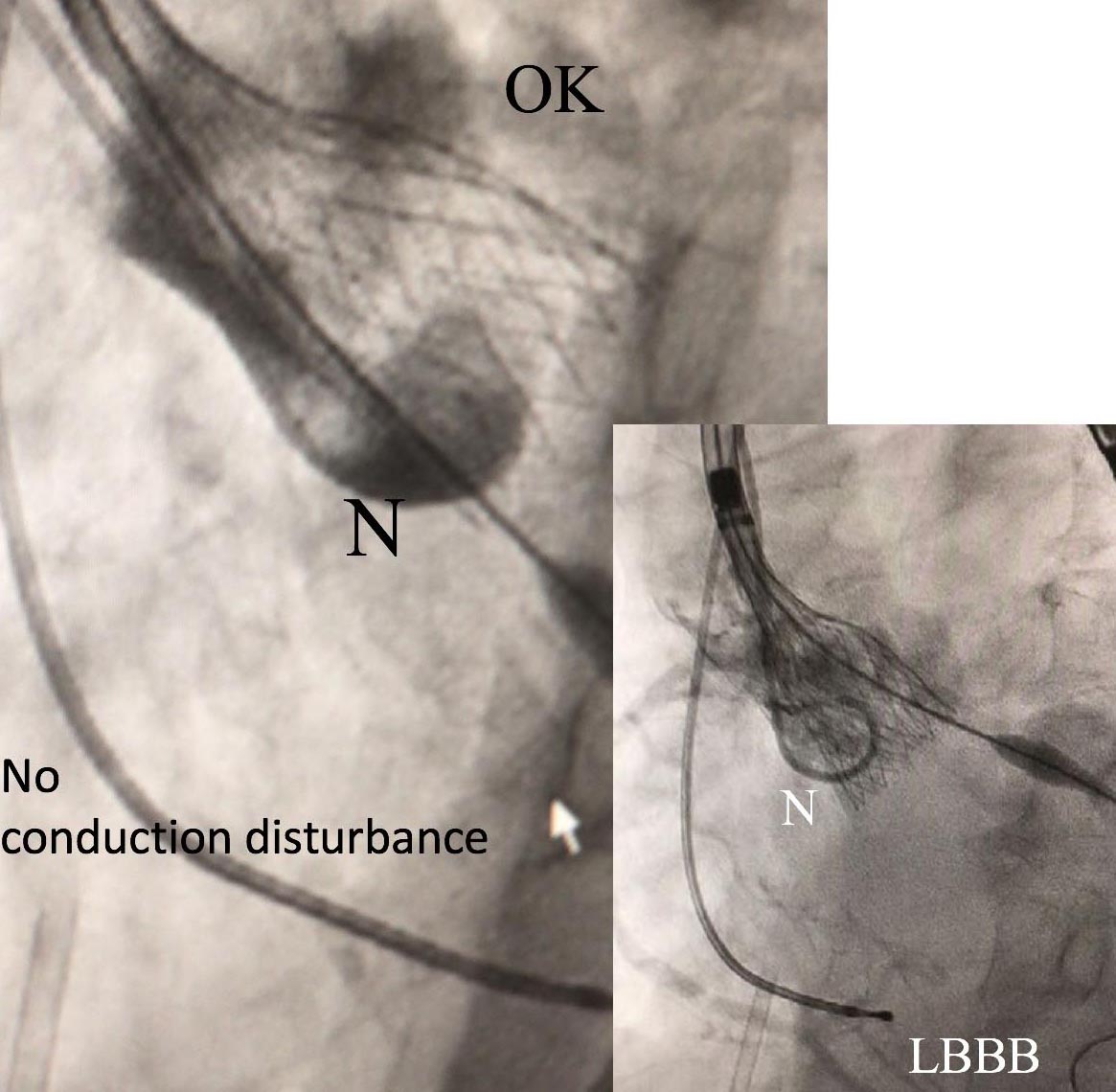
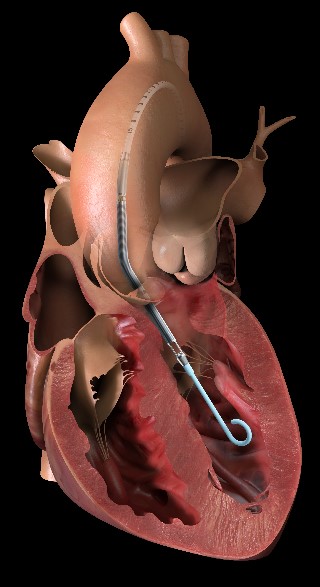
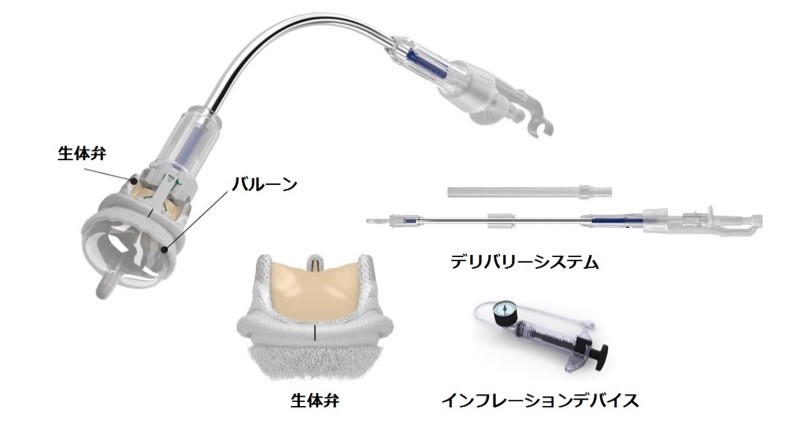
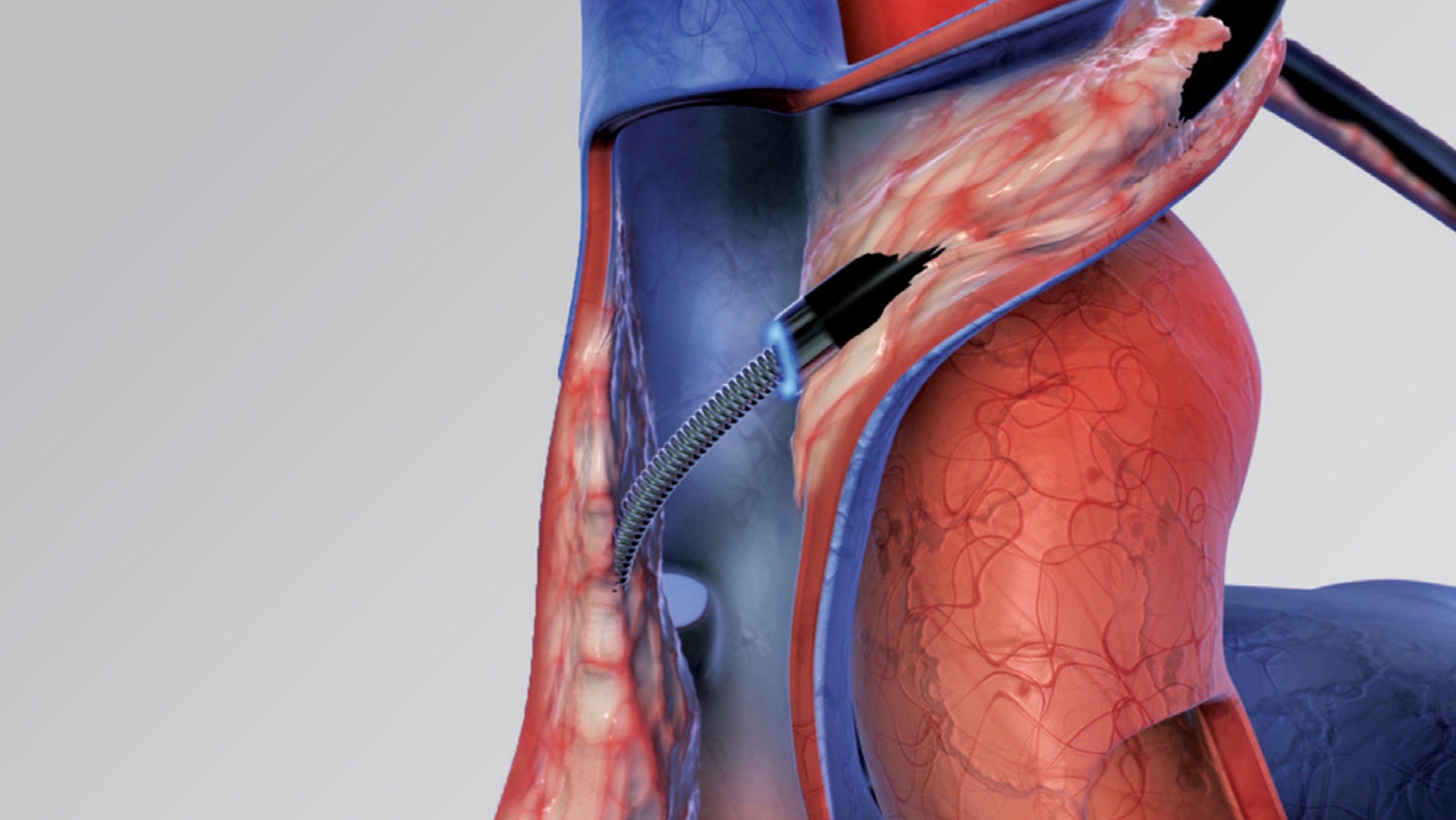
この生体弁機能不全に対する特殊なTAVIは「TAV in SAV」と呼ばれており、2021年現在使用できるデバイスは自己拡張型Evolut Rおよび、バルーン拡張型Sapienが認められております。

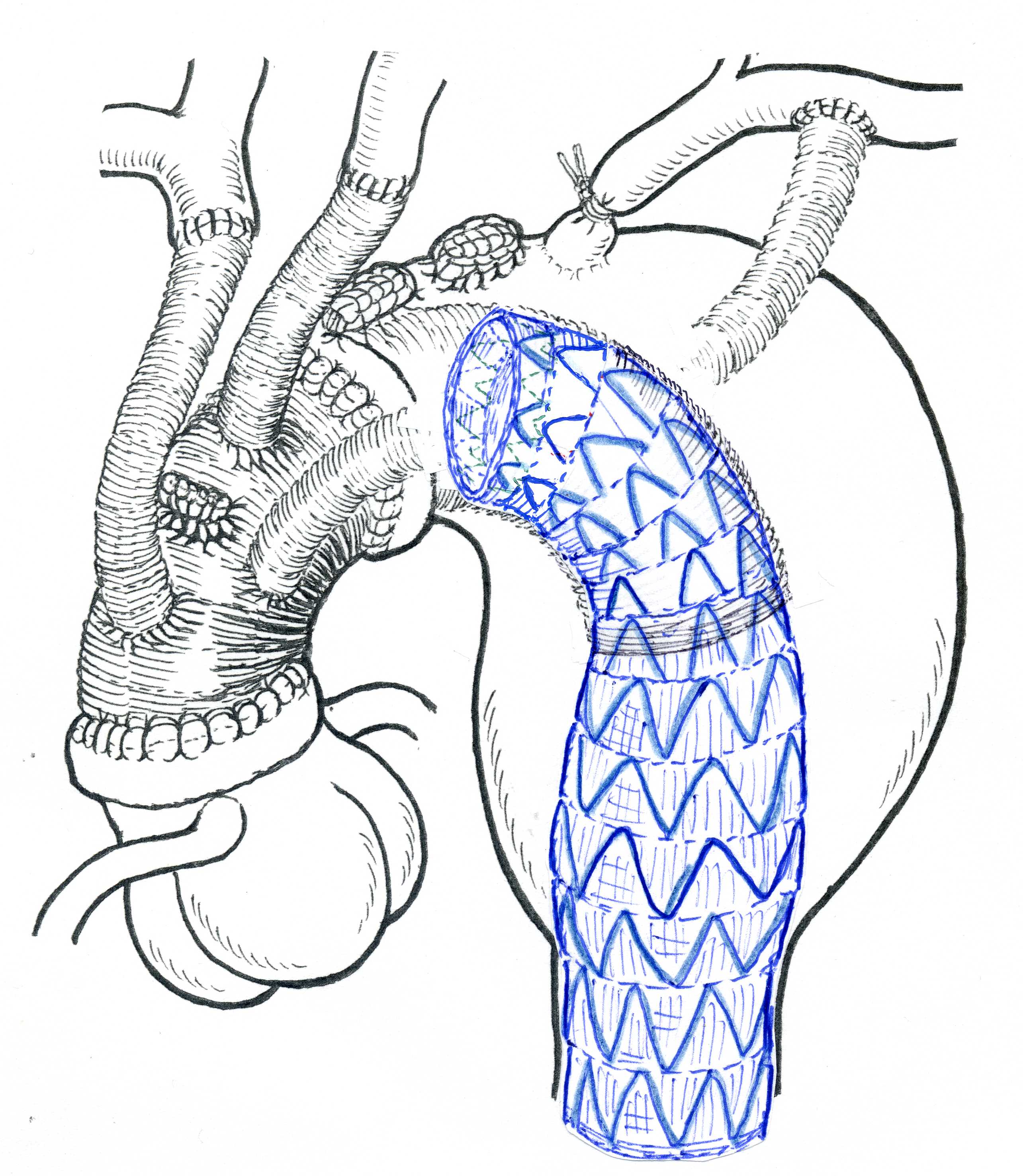
図3. Webb and Dvir. Aortic Valve-in-Valve Implantationより引用 [3]

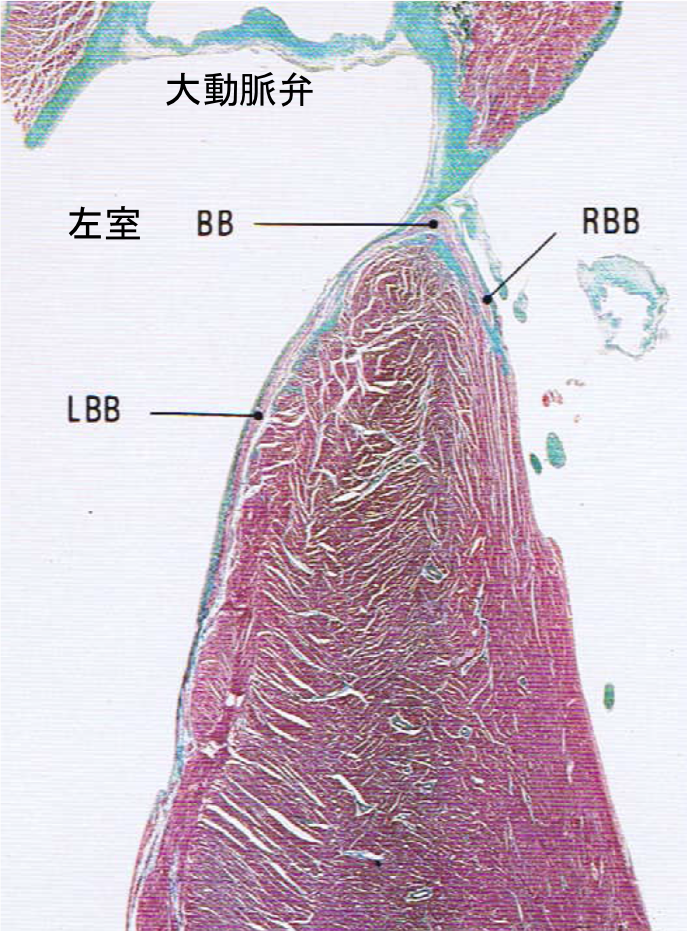
人工弁には大きく分けて、生体弁と機械弁があります。TAV in SAVの対象となる弁は生体弁で、機械弁は対象となりません。生体弁にはStented,
Stented (Externally Mounted), Stentlessの3種類があります(図3)[3]。外巻き弁に対してTAVIでvalve-in-valveを行う場合は その構造上、冠動口塞のリスクは内巻き弁より高いと考えられており、Sapienに関しては外巻の生体弁は対象外とされております。
さらに現時点では劣化したTAVI弁に対するTAVI(TAV-in-TAV)は現状のところ保険適用となっておらず、あくまでSAVRで置換された外科生体弁がその対象となります。
成績:
valve-in-valveにおいてはその低侵襲という特性上、外科手術ハイリスク症例に対しても優れた術後成績が報告されており[4]、生体弁機能不全に対する治療として、十分なオプションとなり得ると考えられます。再AVRとvalve-in-valveの成績が同等であるという報告もありますが[5]、 一方でvalve-in-valveを支持する報告も認められます[6]。Ahmedらの2021年の報告によると、valve-in-valve群の方が再AVR群と比べてベースのリスクが高かったにも関わらず30日死亡は低かったとされております[7]。一方で再AVR群の方が弁周囲の逆流や、患者人工弁ミスマッチ(PPM)、植え込んだ弁のパフォーマンスに関しては優れていたとも報告されております[7]。
Valve-in-valveに関する注意点はいくつか報告されております。小さな外科生体弁が入っている症例や、もともとPPMのある症例にvalve-in-valveを行うと予後が悪いという報告[3]があり注意が必要であると考えられます。
valve-in-valveの有効弁口面積が外科弁のフレームに制限されてしまうという問題点を解決するため、最近の外科生体弁にはフレームが拡張する機能をもつものが市場に出ており、さらにvalve
fractureというstent frameを割って広げるというテクニックも紹介されております[8]。
再AVRかvalve-in-valveかの選択は現時点では難しい選択となり、ハートチームで個々の症例ごとに詳細な評価を行い決定することが重要であると考えられます。さらに今後の大動脈弁治療においては、TAV
in SAVの可能性を常に念頭に置き、初回AVR時における弁の選択(サイズや種類)がこれまで以上に重要になってくると考えています。
文責 藤井太郎
参考文献:
① Dvir D, Bourguignon T, Otto CM, et al Standardized definition of structural
valve degeneration for surgical and transcatheter bioprosthetic aortic
valves. Circulation. 2018;137:388–399.
② 日本循環器学会/ 日本胸部外科学会/ 日本血管外科学会/ 日本心臓血管外科学会合同ガイドライン. 2020年改訂版弁膜症治療のガイドライン.
https://www.j-circ.or.jp/cms/wpcontent/uploads/2020/05/JCS2020_Izumi_Eishi_0420.pdf
(2021年6月閲覧)
③ Webb JG and Dvir D. Transcatheter aortic valve replacement for bioprosthetic
aortic valve failure: the valve-in-valve procedure. Circulation. 2013;127:2542-50.
④ Webb JG, Murdoch DJ, Alu MC, Cheung A, Crowley A, Dvir D, et al. 3-year
outcomes after valve-in-valve transcatheter aortic valve replacement for
degenerated bioprostheses: the PARTNER 2 registry. J Am Coll Cardiol. (2019).
73:2647–55.
⑤ Sedeek AF, Greason KL, Sandhu GS, et al. Transcatheter Valve-in-Valve
Vs Surgical Replacement of Failing Stented Aortic Biological Valves. Ann
Thorac Surg 2019; 108: 424-430.
⑥ Pierre D, et al. Transcatheter Valve-in-Valve Aortic Valve Replacement
as an Alternative to Surgical Re-Replacement. J Am Coll Cardiol. 2020 Aug
4;76(5):489-499.
⑦ Ahmed A, Levy KH. Valve‐in‐valve transcatheter aortic valve replacement
versus redo surgical aortic valve replacement: a systematic review and
meta‐analysis. J Card Surg. 2021;36:2486‐2495.
⑧ Chhatriwalla AK, Allen KB, Saxon JT, Cohen DJ, Aggarwal S, Hart AJ, Baron
SJ, Dvir D and Borkon AM. Bioprosthetic Valve Fracture Improves theHemodynamic
Results of Valve-in-Valve Transcatheter Aortic Valve Replacement. Circulation
Cardiovascular interventions. 2017;10.
文責 藤井太郎