心臓移植は、薬物療法(ACE阻害薬・β遮断薬など)・非薬物療法(手術治療・心臓再同期療法など)の治療にもかかわらず、重症の末期心不全状態の方が対象となります。心臓移植は、心臓移植を受ける患者様(レシピエント)に対し、脳死状態の臓器提供者(ドナー)から提供された心臓を移植する手術です。
日本では特定の実施施設でのみ心臓移植は行われており、2021年4月時点で日本には計11施設の心臓移植実施施設があります。当院は、2016年12月に東海北陸地区で唯一の心臓移植実施施設として認められ、以後心臓移植手術を行っております。
心臓移植の手技に関しては、下記のリンク
https://plaza.umin.ac.jp/~jscvs/surgery/5_3_syujutu_sinzou_sinzouisyoku/
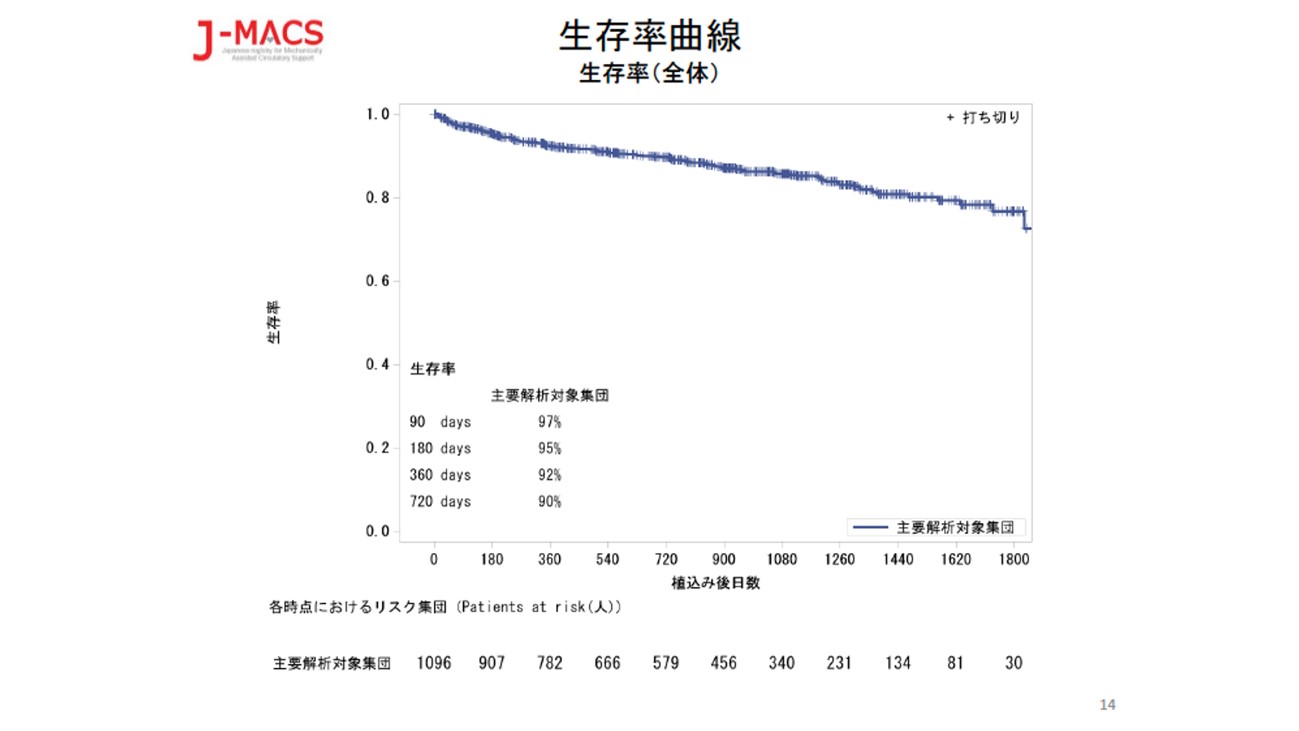
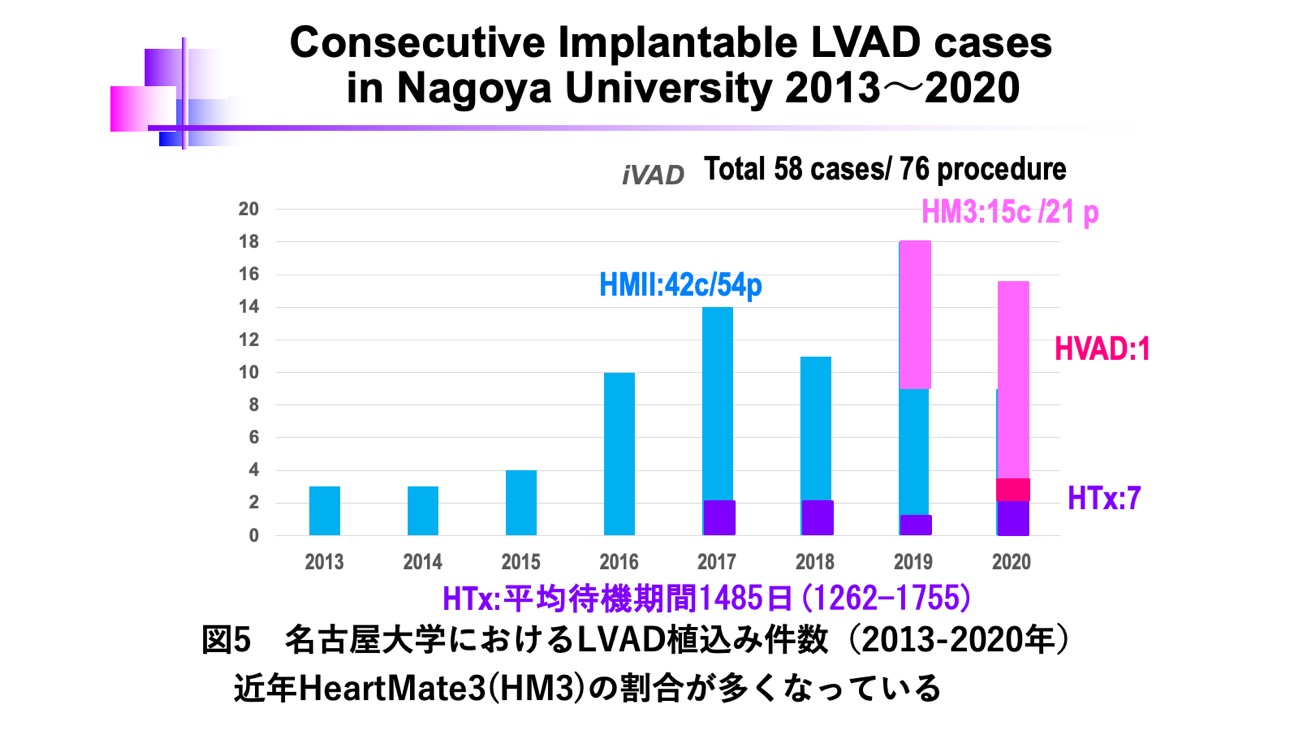
現在日本では、心臓移植を希望される患者様(レシピエント)に対し、ドナーの方が少ないために、心臓移植を受けるために5年以上待機が必要になることが多いです。その間、心不全の症状を改善し、ご自宅からの就労・就学を実現するために、植込み型補助人工心臓を装着していただくことが通常の治療の流れになっています。
植込み型補助人工心臓を装着したうえで、適合するドナーが見つかった際に、心臓移植手術を受けていただいております。心臓移植後は、植込み型補助人工心臓の管理は必要なくなりますが、移植したドナーの心臓を患者様(レシピエント)の免疫細胞が攻撃してしまう拒絶反応を予防するために、免疫抑制薬の服用が必要です。また、拒絶反応の有無を確認するために、定期的にカテーテルで心筋生検の検査を受けていただく必要があります。
当院では心臓移植・植込型左室補助人工心臓を行うための最新の設備を整え、心臓外科・循環器内科・集中治療医をはじめとした医師や移植コーディネーター・看護師・薬剤師・理学療法士・管理栄養士などのコメディカルスタッフによるチーム医療によって高い医療レベルを維持するだけでなく、患者さん本人や家族と寄り添うことを大切に治療にあってっています。
心臓移植手術を受けるためには、心不全が重症であるだけでなく、癌や重度の肝疾患・腎疾患など他の病気が無いかを確認する精査を受けていただく必要があります。また、ご本人様・ご家族に、心臓移植は植込み型補助人工心臓について、十分に理解いただいた上で治療の体制を整えていただく必要があります。植え込み型補助人工心臓また心臓移植は、通常の内服治療や手術治療とは異なり、患者様ご自身でしっかりと自己管理を行うことがカギとなる治療となります。そのために、心臓移植または植込み型補助人工心臓について、病気が進行する前にあらかじめ十分に知っておき、検討しておく必要があります。治療に関するちょっとした疑問でも問題ございませんので、いつでもお気軽に当院にご相談ください。(文責 近藤徹)