1.閉塞性肥大型心筋症とは
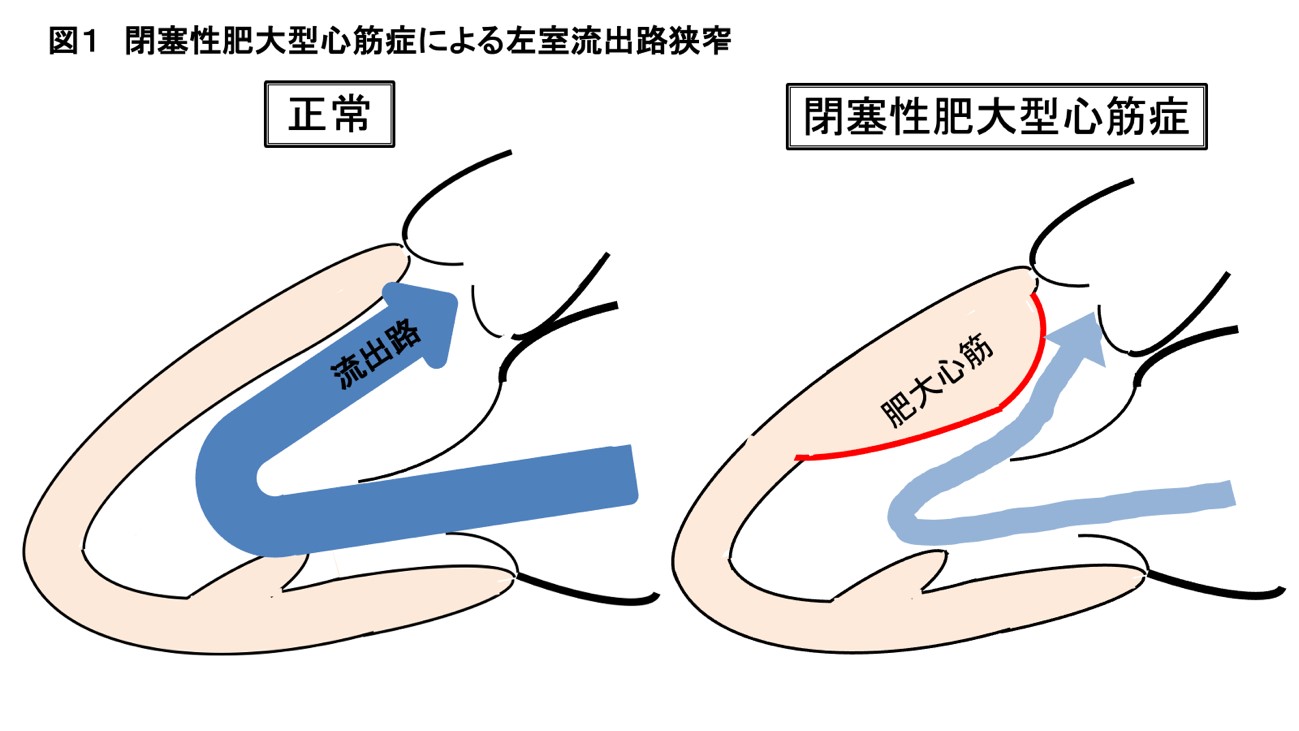
肥大型心筋症は心臓の筋肉が不適切に肥大する疾患であり、その中でも特に左室流出路(心臓からの血流の出口部)に狭窄が存在するもの(図1)を閉塞性肥大型心筋症と言います。閉塞性肥大型心筋症の症状には、胸痛・呼吸困難・動悸といった胸部症状と立ちくらみや失神といった脳症状があります。
2.治療法
治療法は薬物療法と非薬物治療に大別でき、薬物治療のみで改善されない場合に非薬物治療を検討します。薬物治療は姑息的治療であり、症状を改善する場合もありますが、根本治療とはなりません。
非薬物療法には外科的中隔切除術、経皮的中隔心筋焼灼(PTSMA;カテーテル治療) があります。これら非薬物療法は左室流出路狭窄の原因となっている肥大心筋を縮小させることのできる治療です。外科的中隔切除術は合併する心臓の構造異常を同時に治療でき、治療経験が豊富な施設では,90%以上の症例で左室流出路閉塞が解除され,再発はほとんどみられないとされ1)、外科手術を受けることができる全身状態であれば外科的な中隔心筋切除術が第一選択となります。一方で、PTSMAは,肥大心筋の栄養血管である冠動脈からエタノールを注入し,肥大心筋を菲薄化させる治療です。PTSMAが再度必要となる割合は
5-15%と言われていますが1),低侵襲であるというメリットが挙げられます。
中隔心筋切除術か,PTSMA どちらを行うかの選択は,年齢や病態を総合的に加味し、肥大型心筋症の治療に精通した循環器内科医,心臓外科医, 他の多職種からなるチームにより議論し、ご本人やご家族と相談の上決定します。
3. 外科的中隔心筋切除術、当院での手術の特徴
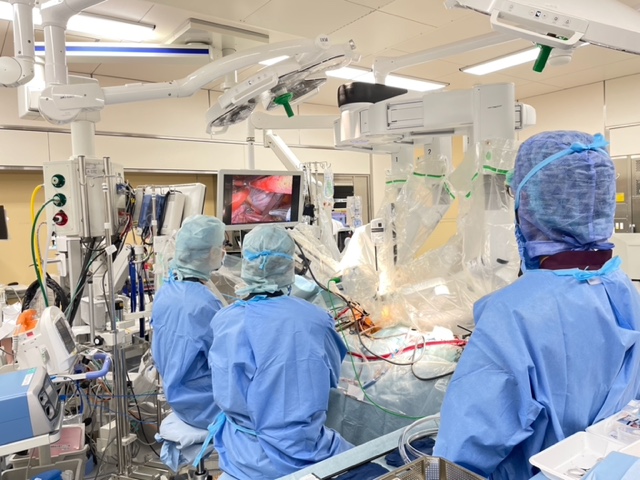
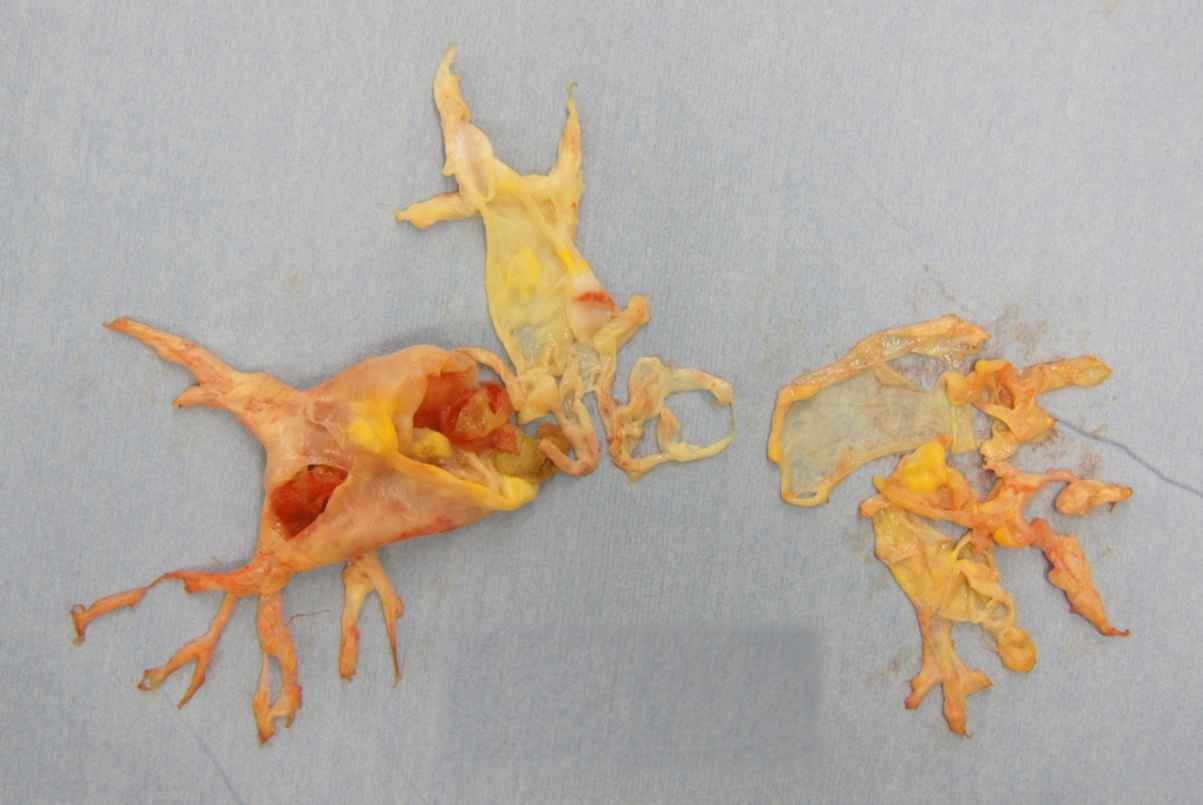
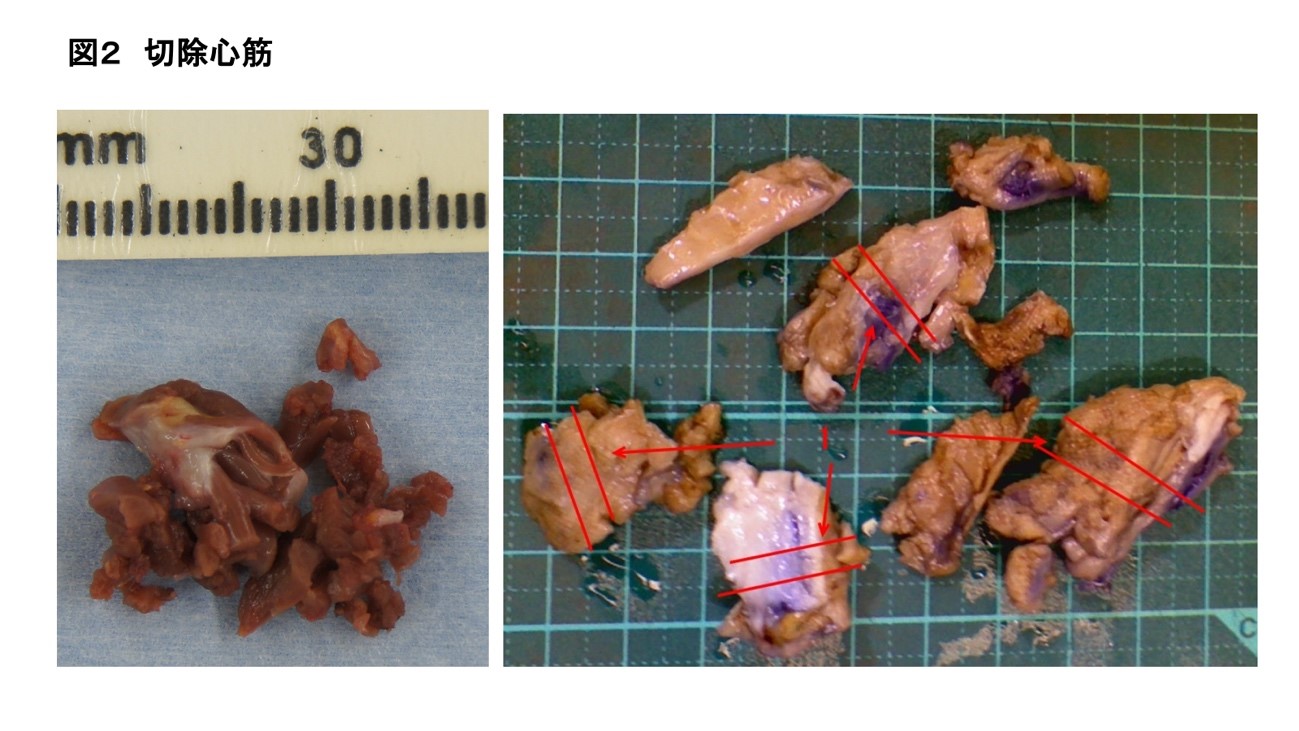
外科的治療は開胸下で肥大心筋を直接切除することで(図2)左室内閉塞を解除する方法で、確実な効果が期待できる治療です。
切除する心筋の近くを刺激電導路(心臓を収縮させる電気刺激の通り道)が走行しているので、完全房室ブロックといった不整脈が出現し術後ペースメーカー治療が必要となる場合があり、高度な技術と経験を要する治療法です。そのため、ガイドライン上も10例以上の治療経験のある術者により施行することを推奨しています。
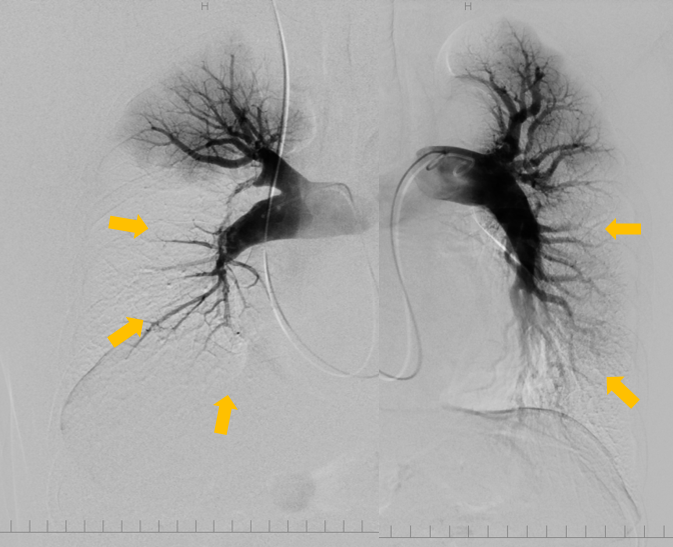
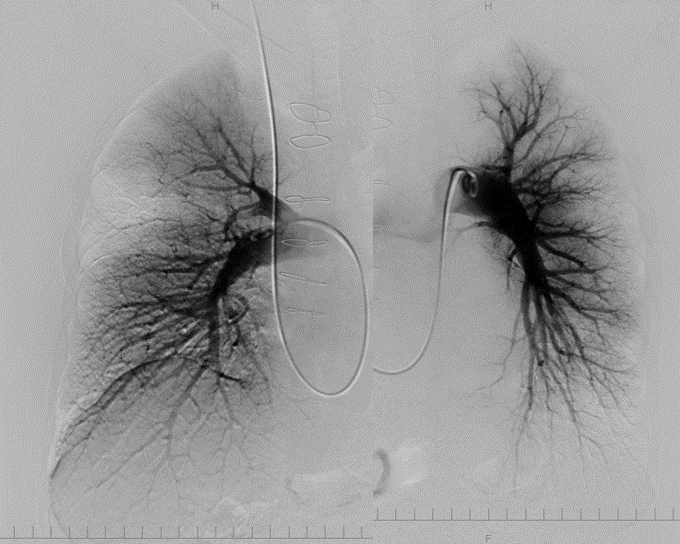
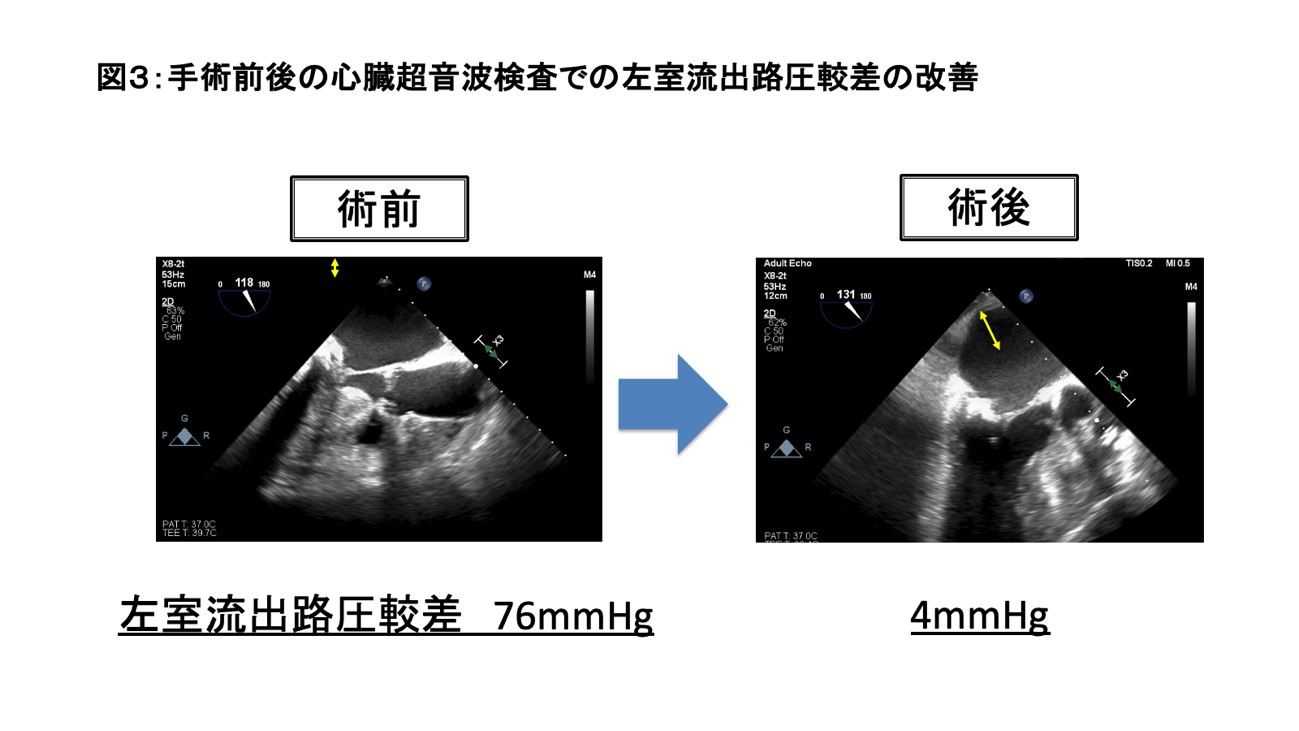
当院では2000年か50例以上の経験があり、流出路狭窄の指標である左室流出路圧較差の改善を認めています(図3)。
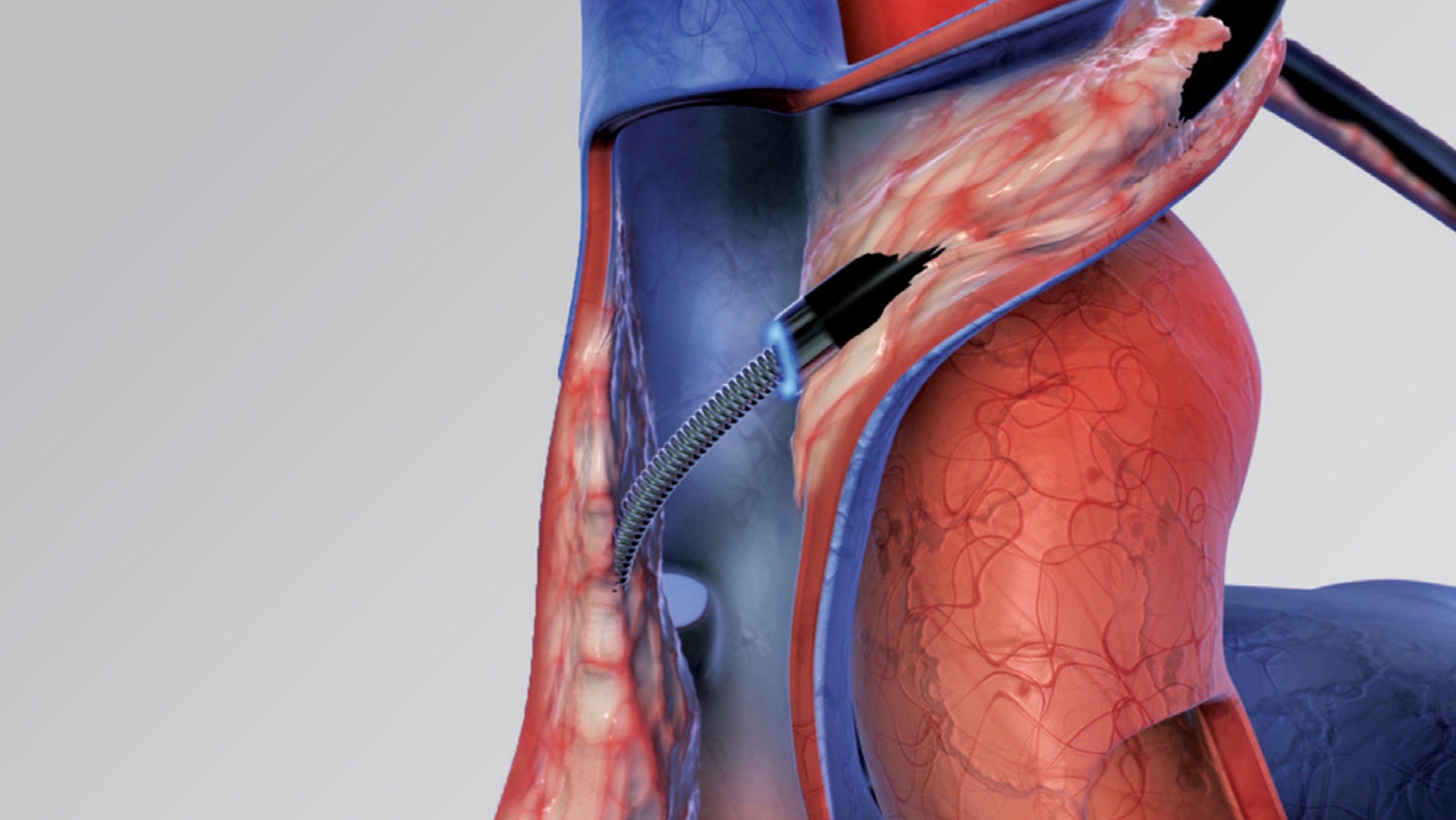
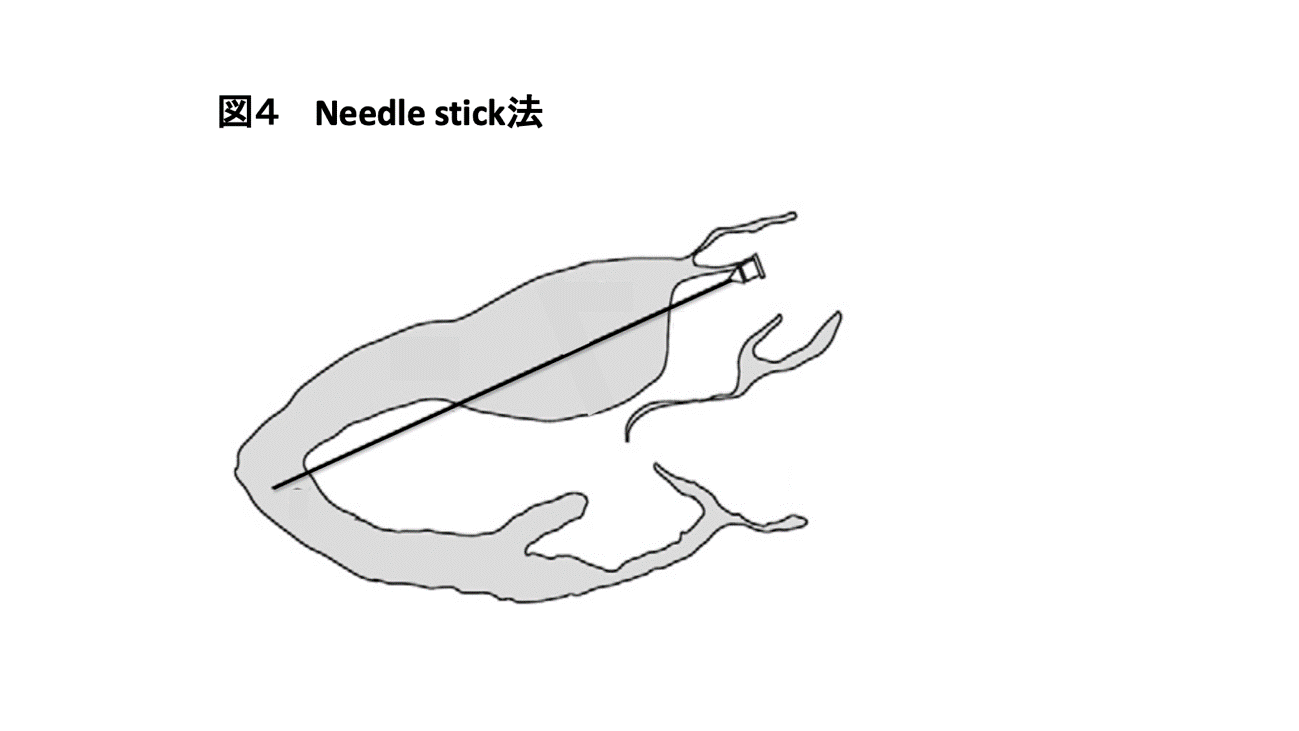
当院では安全で適切な手術を目指す為、術中エコーを使用したNeedle stick法による心筋切除法(図4)を考案し施行しています。
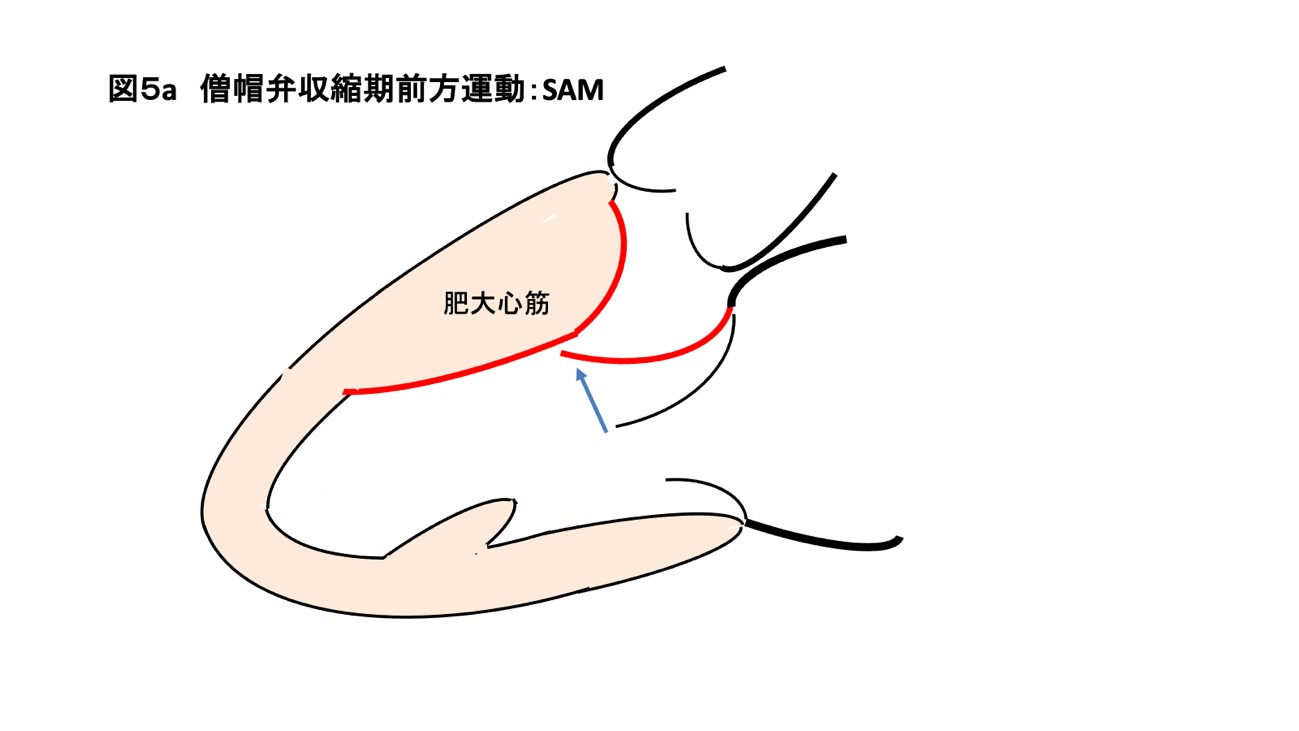
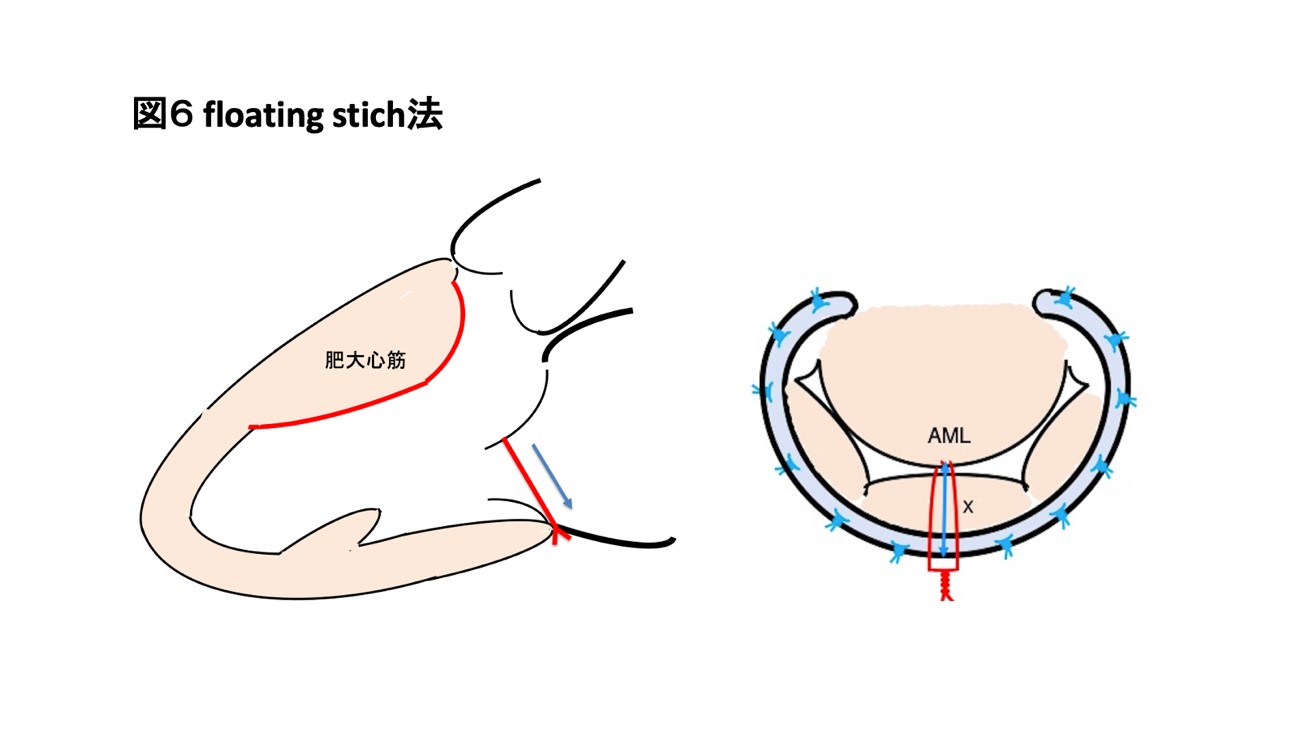
また、閉塞性肥大型心筋症ではその多くで左室流出路狭窄に伴って、流出路に隣り合う僧帽弁が引き込まれ(僧帽弁収縮期前方運動:SAM 図5)僧帽弁逆流症を呈する為、当院では僧帽弁前尖に糸をかけ積極的にSAMを防止するfloating
stich法(図6)を施行することで良好な術後成績を収めています。
(参考文献)
1)日本循環器学会 心筋症診療ガイドライン (2018年改訂版)
2)Masato Mutsuga, MD, PhD, Yuji Narita, MD, PhD, and Akihiko Usui, MD,
PhD
A Floating Stitch on the Anterior Mitral Leaflet Can Eliminate Systolic
Anterior Motion in Hypertrophic Obstructive Cardiomyopathy. Semin Thoracic
Surg 32:266–268
3)Akihiko Usui, MD, Yoshimori Araki, MD, Hideki Oshima, MD, and Yuichi
Ueda, MD
A Needle Stick Technique for Septal Myectomy for Hypertrophic Obstructive
Cardiomyopathy. Ann Thorac Surg 2013;95:726–8
文責 碓氷礼奈