縫合結紮が少ない 外科的大動脈弁置換術 sutureless AVR
経カテーテル大動脈弁置換術(TAVI)用生体弁の技術とこれまで使用されてきた生体弁技術の融合により誕生したINTUITY Elite(エドワーズライフサイエンス株式会社)の施設認定を受けており、解剖学的に条件を満たしている患者様に対してはより低侵襲に大動脈弁置換が施行できるようになりました。

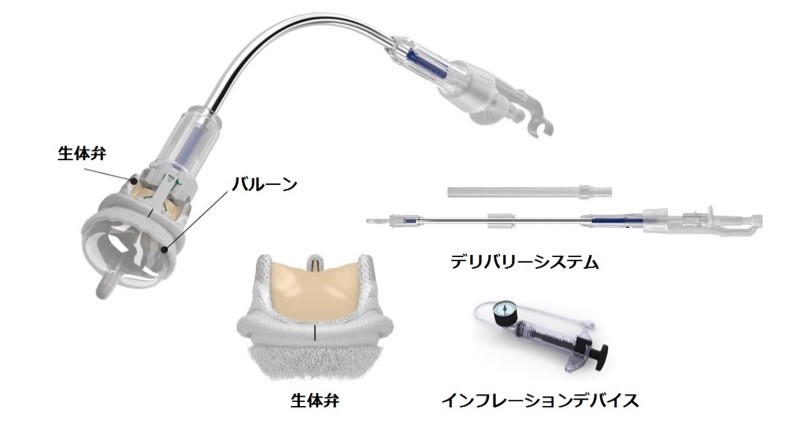
提供:エドワーズライフサイエンス(株)
2024年に医師免許を取得され、名古屋大学心臓外科教室の関連施設で2026年春より心臓血管外科を主体とした外科後期研修の開始を考慮されている先生方への アナウンスです
心臓血管外科の分野は、進歩が目まぐるしく、取り組むべき手術の内容、数も増える一方です。 その結果、名古屋大学心臓外科教室の関連病院では診療を担う医師の数は、慢性的に不足しています。 若手医師の参画を歓迎します。心臓血管外科は責任も伴いますが、やりがいも非常に大きい分野です。人生は一度きりです。せっかく医師免許をとって何かを成し遂げたい 大きなことに取り組みたい という先生;興味があられる方は、教室内関連病院での修練、勤務をご検討ください
後期研修の開始には、例年11月初旬の2週間の間に 日本専門医機構のサイト https://jmsb.or.jp/senkoi/
にて専攻医登録の応募手続きを行っていただく必要があります。
名古屋大学心臓外科の関連施設で、2026年春以降
心臓血管外科を主体とする外科後期研修 (一般外科研修に引き続き心臓血管外科専門研修)の開始を希望される方は、応募期間内に同サイトより応募を行なわれる必要がございます。
プロクラム選択は、各病院が有する外科後期研修プログラムも選択可能ですが、各病院で合わなかった場合などの対応を考え、基本的に名古屋大学附属病院外科専門研修プログラムを選択されたうえで、所轄病院で研修されることを推奨します。
研修開始病院が未確定の方は名古屋大学附属病院外科専門研修プログラムを選択されてください。<なお、名古屋大学附属病院外科専門研修プログラムへの応募は名古屋大学附属病院で後期研修を開始しなくてはいけないという意味ではありません。また直ちに入局を強制するものでもありません。>
<名古屋市や 愛知県近隣で、心臓血管外科の後期研修を希望されているものの、研修先がまだ決まっていない という方 は 早めに希望意志をお知らせください 直ちに入局をしなくてはいけない というようなこともありません ただ、調整には多少時間がかかりますので早めにご連絡頂けるとありがたいです 問い合わせ=決定ではありませんから気軽にお問合せください 教室の修練方針のパワーポイントをお送りすることも可能です
なおプログラムに応募される場合採用に際しての面談が必要になります >
<後期研修に限りませんが、地域枠や奨学金の就労地域制限があられる先生(他県込み)、女性で育児との両立が必要な先生、他グループで修練途上であった といった 先生などにも 対応実績があります 各人の状況に応じて柔軟に対応いたしますので まずは気軽にお問合せください 出身地、出身大学は問いません>
どの病院で外科後期研修を開始されるかに関わらず、教室の方針として名古屋大学心臓外科の関連施設で研修をされる方は全員、後期研修期間3年の中のどこかで6ヶ月間は名古屋大学附属病院にて診療従事していただく方針とさせて頂いております。
心臓血管外科の後期研修は 外科学会の定義における いわゆる2年連動型;後期研修期間として定められた3年間の内の2年間を心臓血管外科領域とする形が制度上の基本型となります。
出身大学は問いません。努力とやる気次第で有意義な研修 外科医としての成長が可能です。
問い合わせはこちらまで https://form.run/@heartteamnagoya-1635673339
参考のための情報ですが、
2024年のスケジュール情報は以下の通りでした。
(10月中旬の現時点では2025年用の手続きページ(2026年後期研修開始用)はまだオープンしていません)
■専攻医1次募集応募期間2024年11月 1日(金) 正午~2024年11月15日(金)
正午まで
採用調整期間2024年11月18日(月) 正午~2024年11月26日(火) 正午まで
採用結果通知2024年11月29日(金) 正午
募集実施確認期間2024年11月26日(火) 正午~2024年11月29日(金) 正午まで

https://www.instagram.com/nucts2024/?hl=en
名古屋大学心臓外科教室のインスタグラムアカウントを開設しました。
我々の活動をひろく知っていただくため、教室の仕事、日常などを発信していきたいと思います。
興味のある方は、是非フォローお願いします
Cardiac surgery represents the final line of defense in protecting the
heart. In our department, we specialize in addressing valvular heart disease,
ischemic heart disease, aortic disease, and congenital heart disease. Our
expertise spans from minimally invasive procedures (MICS or catheter-based
treatments) to highly intricate surgeries for complex cardiovascular conditions.
We excel in minimally invasive cardiac surgery (MICS), incorporating robotic
techniques when applicable. Additionally, our services include transcatheter
aortic valve replacement (TAVI, TAVR, or mitraclip) and aortic stent graft
surgery. Conversely, we actively pursue complex surgeries for intricate
heart diseases where minimally invasive approaches prove insufficient.
With each treatment modality carrying its own set of advantages and disadvantages,
we ensure transparent, understandable explanations and tailor the optimal
treatment plan for each patient.
Furthermore, as the largest general hospital in the Nagoya Area, we offer
comprehensive care for patients with comorbidities alongside their cardiac
or aortic conditions. The majority of our department's staff surgeons are
proficient in English, with some having received training overseas.
As a general rule, when foreign patients without Japanese public medical
insurance wish to receiv medical services from our hospital, we ask that
they contact us through the organizations listed below,in order to proceed
with diagnostic and treatment processes in a safe manner, and to facilitate
the smooth completion of various administrative processes such as immigration
procedures.
1) Emergency Assistance Japan (Co) (EAJ)
2) Wellinks co.ltd
Our hospital has business partnerships with EAJ and Wellinks co.ltd, and
their acceptance of patients is coordinated by our Center for Community
Liaison and Patient Consultations. Please choose one and consult with them.
Please note that patients are responsible for any brokerage fees incurred.
https://www.med.nagoya-u.ac.jp/hospital_en/guide/outpatient/overseas/
先天性心疾患の手術ができるようになったのは今から約70年前ですが、治療成績は飛躍的に向上してきました。国内で、すでに成人になった先天性心疾患の人は50万人以上いると言われています。
しかし長い年月が経ってから、以前受けた手術の影響や、元々の病気の悪化で、何らかの症状や問題が出てくることがあります。何らかの症状が出て悪くなる前の段階の適切なタイミングで適切な治療を受けることが、長く元気でいられるためには重要です。
当院では、特に成人先天性心疾患(ACHD:Adult congenital heart disease)の方の診断、治療、手術に取り組んでいます
以下の 成人先天性心疾患(ACHD)の外来を行っております
心臓外科
六鹿 雅登 月曜日
櫻井一 水曜日
循環器内科
森本 竜太 木曜日
古澤 健司 月曜日
田中 哲人 金曜日
原則的にはかかりつけ医さまからの紹介状を頂いた上、病診連携を通じて受診されてください
小児・先天性心疾患 心臓外科フェローシッププログラム
小児・先天性心疾患の心臓外科は、高度な技術と専門性が求められる分野ですが,志望する若手医師の減少が危惧されているところです。名古屋大学医学部心臓外科教室およびその関連病院では,年間約500件の先天性心疾患手術を行っています.豊富な手術経験を所属医局に関係なく次世代の若手医師と共有し,日本の将来を担う若手の小児・先天性分野の心臓外科医を育成しつつ,地域の医療にも貢献できるようにこのプログラムを創設することといたしました。
具体的には,ともに年間200件以上の手術件数を有するあいち小児保健総合医療センターと,地域医療機能推進機構中京病院の2施設を中心に1年間ずつローテートする研修となります.両施設を経験することで,軽症例から最重症例まで,新生児から成人例まで,手術の執刀,術後管理,あるいは小児VAD管理まで経験していただけるプログラムになります.また,希望があれば、名古屋大学附属病院において,MICS手術,成人VAD手術,心臓移植手術に参加していただくことも可能です.
募集人数:年間1,2名程度
募集時期:随時
研修期間:2年
研修開始時期:原則,4月,10月
対象:原則,後期研修(3年間の外科専門医研修)修了者
待遇:あいち小児保健医療総合センター スタッフまたはフェロー
地域医療機能推進機構中京病院 スタッフまたは専攻医
このフェローシップの応募に、名古屋大学心臓外科への入局は必須ではありません。
このフェローシップは小児・先天性心疾患 心臓外科の研修を意図したものですが、一般成人心臓外科の経験が不足していると考えておられる先生の場合は、成人心臓外科のローテートを追加することも可能です。
問い合わせはこちらまで
https://form.run/@heartteamnagoya-1635673339
日本専門医機構の定める 次度開始の 外科系修練医応募登録(後期研修医 の修練開始登録)は例年11月初旬に始まります アナウンスに注目されてください
===
名古屋大学心臓外科教室では20を越える関連病院において年間2500例以上の開心術を含む多数の心臓大血管手術を行っています。
心臓血管外科の分野は、進歩が目まぐるしく、取り組むべき手術の内容、数も増える一方です。 その結果、各関連病院では診療を担う医師の数は、慢性的に不足しています。
教室は若手医師の参画を歓迎します。
出身大学は問いません。心臓血管外科は責任も伴いますが、やりがいも非常に大きい分野です。
興味があられる方は、教室内関連病院での修練、勤務をご検討ください。
関連病院において、下記のような修練目的の勤務については概ね3-4年までは入局は必須ではありません。 (関連病院において、上級スタッフポジションで長期働くことを所望される方は入局及び 修練責任者資格の取得が前提です)
1) 後期研修で進路に迷っておられる方 後期研修で心臓血管外科専門プログラムを考えている方; 我々のプログラムをご検討ください
関連病院において、1年目(卒後3年目)に集中的に一般外科研修を行い(外科専門医取得可能な例数も確保)、2年目(卒後4年目)以降、心臓血管外科専門研修を行う 卒後5-6年目で外科専門医を取得 卒後6年目以降に心臓血管外科専門医を取得する こういったプログラムです。
これを可能とする十分な症例数を教室はグループとして有しています。
2) 後期研修を修了後にさらなる修練機会を希望されている先生;心臓血管外科専門医取得や、取得後のさらなる技術鍛錬 キャリアアップを所望される方 そこそこ経験を積んでおられる先生でもOKです 修練希望の先生 勤務希望の先生 話だけ聞いてみたいという方 お気軽にお問い合わせください; 是非我々のグループで共に働き、経験をつんでください
小児心臓手術フェローシップについてはこのHP内に別途案内があります VAD 重症心不全治療や TAVI SHD治療などに特化した 半年から1-2年程度のフェローシップ的修練も可能です(心臓血管外科専門医 取得後が原則)
問い合わせはこちらまで
https://form.run/@heartteamnagoya-1635673339