- トップ
- 製薬企業の方へ
- 医薬品の新規採用申請について
製薬企業の方へ
医薬品の新規採用申請について
0申請から薬事委員会審議までの流れ
Ⅰ.資料提出
診療科からの申請の締切日は、薬事委員会開催月の前月第2金曜日となります。
診療科から申請書が提出された後、締切日(原則、薬事委員会開催月の前月第2金曜日)までに、資料等を薬品情報室までに必ずご提出下さい(厳守)。
薬事委員会に必要な資料・書類について
Ⅱ.ヒアリング
申請締切日の翌週に、薬事担当副部長とのヒアリングを行います。
日程は、薬品情報室から連絡いたします。
Ⅲ.薬事委員会審議(申請)
申請診療科(部)の薬事委員の先生に、申請された医薬品についてご説明いただきます。
薬事委員不在の科(部)につきましては、申請者の先生よりご説明いただきます。
(医薬品の概要、採用を必要とする理由、削除候補医薬品等)
1.院内への採用申請の場合
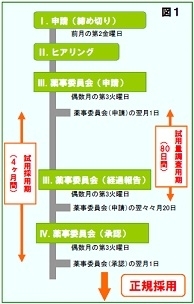
- 試用採用(図1)
薬事委員会(申請)の翌月1日から4ヶ月間が試用採用期間となり、オーダーが可能となります。臨床試用成績調査期間は、薬事委員会(申請)の翌月1日から翌々々月20日までの80日間となります。その間の臨床成績および使用量等の実績に基づき、次々回薬事委員会(承認)にて正式に採用を決定します。 - 切替採用
切替削除医薬品の院内在庫がなくなり次第、切替採用となり、オーダーが可能となります。その際は、院内に案内を配布します。
試用期間はありません。
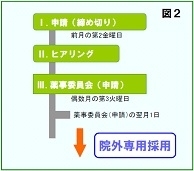
2.院外専用の採用申請の場合(図2)
薬事委員会(申請)の翌月1日より、院外専用採用となり、オーダーが可能となります。
Ⅳ.薬事委員会審議(承認)※試用採用医薬品のみ
申請診療科(部)の薬事委員の先生に、『臨床使用成績報告書』に基づき、申請医薬品についてご説明いただきます。
薬事委員不在の科(部)につきましては、申請者の先生よりご説明いただきます。(使用量、効果、有害事象等)
審議の結果、「採用」となった場合、薬事委員会(承認)の翌月1日より正式採用となります。
薬事委員会に必要な資料・書類について
以下の一覧の資料および書類をご用意いただき、締切日までに薬品情報室までご提出下さい。
締切日は厳守でお願い致します。
内容を随時更新しています。申請の際に、その都度確認して下さい。
書類(ダウンロード)(2024年12月16日更新) |
|
| 様式 | 部数 |
|---|---|
| 1.発売(販売)証明書(資料A) | 規格毎に1部 |
| 2.申請医薬品ヒアリング資料(資料B) | 薬品毎に1部 |
| 3.注射薬のフィルター通過性資料(資料C) | 薬品毎に1部 |
| 4.提出資料確認表 | 薬品毎に1部 |
薬事委員会申請書類作成の手引き
※必ずご覧下さい。
ヒアリング資料(2019年2月27日更新)次の1~8を一部ずつA4サイズの封筒に入れ、表紙に販売名を表記してください。 |
|
| 資料 | 部数 |
|---|---|
| 1.申請医薬品ヒアリング資料(資料B) | 1部 |
| 2.添付文書 | 1部 |
| 3.インタビューフォーム | 1部 |
| 4.製品情報概要 | 1部 |
| 5.使用上の注意の解説 | 1部 |
| 6.医薬品リスク管理計画 | 1部 |
| 7.適正使用ガイド | 1部 |
| 8.患者説明資材 | 1部 |
薬品情報室 保管用(2021年9月17日更新)次の1~4をクリアファイルに入れ、名刺を1枚貼付してください。 |
||
| 資料 | 部数 | 備考 |
|---|---|---|
| 1.発売(販売)証明書(資料A) | 1部 | |
| 2.注射薬のフィルター通過性資料(資料C) | 1部 | 申請薬品が注射薬の場合のみ |
| 3.配合変化表 | 1部 | |
| 4.その他(薬剤特性を示す資料) | 1部 | |
薬事委員配布用資料 (2024年8月29日更新) |
|
| 資料 | 部数 |
|---|---|
| 1.製品の薄いパンフレット (4ページ程度のなるべ薄いもの) 薄いパンフレットがない場合は、添付文書をご用意下さい |
1部 |
| 2.製品のパンフレット(電子媒体でお願いします) ない場合は、添付文書を電子媒体でお願いします |
|