計画研究A02『脳タンパク質老化の分子基盤』
<研究代表者>
A02-1 高島 明彦(学習院大学理学部生命科学科・教授)、A02-2 長谷川 成人(東京都医学総合研究所・分野長)、A02-3 小野寺 理(新潟大学・教授)
動物モデル、iPSを含む細胞モデル、ヒト剖検脳を用いて、脳タンパク質(タウ、α?シヌクレイン、TDP-43、FUS)老化の開始と病原性獲得メカニズム解明、脳タンパク質老化の細胞間伝播・感染性獲得メカニズム解明、脳タンパク質老化による細胞毒性とその抑制メカニズム解明および病態マーカー開発を行う。
A02-1高島グループ
| 研究課題 | 『タウのタンパク質老化と毒性機序』 |
|---|---|
| 研究代表者 | 高島 明彦(学習院大学理学部生命科学科・教授) |
| 研究分担者 | 久永 真市(首都大学東京・教授) 宮坂 知宏(同志社大学・准教授) 池川 雅哉(同志社大学・教授) 石垣 診祐(名古屋大学・特任助教) |
| 連携研究者 | 住岡 暁夫(学習院大学理学部生命科学科・助教) 御園生 裕明(同志社大学大学院・教授) 田口 明子(国立長寿医療研究センター・部長) |
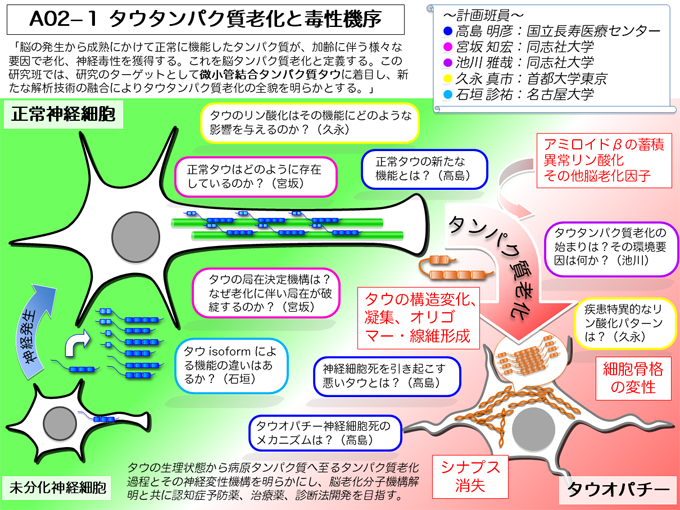
老年性認知症の多くで神経原線維変化と呼ばれる神経細胞内封入体が観察される。神経原線維変化は微小管結合タンパク質であるタウタンパク質から構成されている。タウタンパク質の凝集病理が生じている脳部位において、シナプス消失や神経脱落などによる神経機能低下が起こり、認知症は引き起こされる。
微小管結合タンパク質には古典的MAPsとして知られるタウ類似の数種類のタンパク質が存在するが、何故タウタンパク質だけが認知症に関与しているのかその理由は明らかではない。タウタンパク質の新たな生理機能としてシナプス長期抑圧が近年報告された。このようなタウタンパク質に特異的な機能が老齢期認知症発症に関与すると考えられるが、タウタンパク質の生理機能についての研究は未だ不十分である。タウタンパク質の生理機能を解明し、加齢に伴うタウタンパク質のリン酸化をはじめとする生化学的変化から神経細胞死に至る分子過程を明らかにする。これによって認知症治療の分子標的見いだすことが出来る。
タウタンパク質は正常な神経細胞では選択的スプライシングにより3リピート型タウ、4リピート型タウといった複数のアイソフォームが存在し、主に軸索に存在する。樹状突起棘におけるシナプス可塑性への関与、細胞外への分泌が報告されている。神経変性時にはタウタンパク質は過剰にリン酸化され、細胞体/樹状突起に分布し、タウ同士が結合し重合体を形成しながらシナプス消失や神経脱落を引き起こす。タウの過剰リン酸化とタウ凝集体形成機構、神経細胞死を引き起こす病原タウの決定、タウタンパク質の細胞内局在機構を解明する。さらにアルツハイマー病で蓄積する老人斑は明確なタウ病変の誘導因子と考えられる。βアミロイドがタウタンパク質の老化を引き起こす分子過程を明らかにし、タウタンパク質老化と神経変性機構を解明する。
A02-2 長谷川グループ
| 研究課題名 | 『タンパク質の老化基盤と病原性タンパク質の伝播機構』 |
|---|---|
| 研究代表者 | 長谷川 成人(東京都医学総合研究所・分野長) |
| 連携研究者 | 北本 哲之(東北大学・教授) |
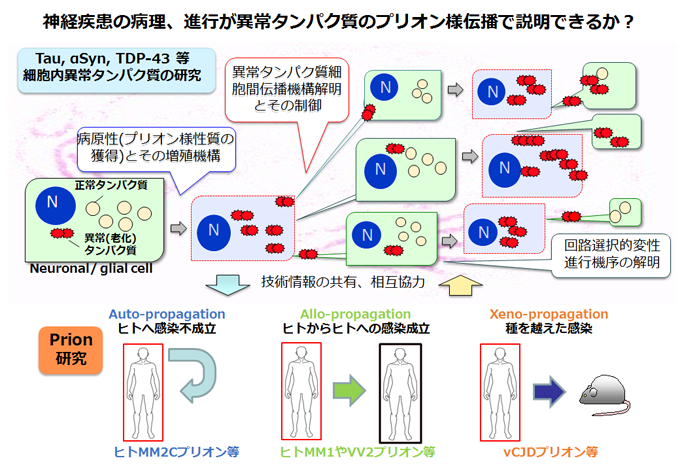
タンパク質老化によって生じた異常分子がプリオン様の性質(病原性)を獲得し、正常分子を異常構造に変換、増殖することにより、病変が広がって病気が進行するという考えが注目されている。
本研究領域では、タウ、αシヌクレイン、TDP-43、プリオンなど、疾患を定義づけるような異常タンパク質の増殖、細胞侵略機構を明らかにし、異常タンパク質の伝播を制御する方法を導きだすことを目的とする。
より具体的には、以下のような検討を行う。
- 患者脳の神経病理、生化学解析を行い、タンパク質構造異常の共通点、相違点を解明する。
- 合成タンパク質、患者脳異常タンパク質をシード(種)として添加、接種する試験管、細胞、動物モデルを構築し、増殖、伝播の機序を明らかにする。
- プリオン病における異常プリオンの侵入、感染の分子機構、神経細胞の変性、発症機構について、様々な変異型を発現する遺伝子改変マウスを用いて解析する。
- 異常構造への変換を抑制する低分子化合物、正常分子を安定化する化合物、異常分子の分解を促進する薬剤、伝播を抑える薬剤や抗体等を探索、評価する。
- プリオン病における異常プリオンの検出法として開発された異常タンパク質増幅法(PMCA法)をタウ、α-シヌクレイン、TDP-43などに応用し、高感度検出系を構築し、髄液などの生体試料から客観的に病気の診断ができるような早期診断法の確立を目指す。
本研究領域で得られた技術、マウスモデルは、A01領域の特異プローブの検証、評価や、A03領域のiPS細胞、マーモセットモデルへの応用が期待される。
A02-3小野寺グループ
| 研究課題名 | 『核酸代謝の乱れからみた蛋白質の老化基盤とその排除機構』 |
|---|---|
| 研究代表者 | 小野寺 理(新潟大学・教授) |
| 連携研究者 | 柿田 明美(新潟大学・教授) |
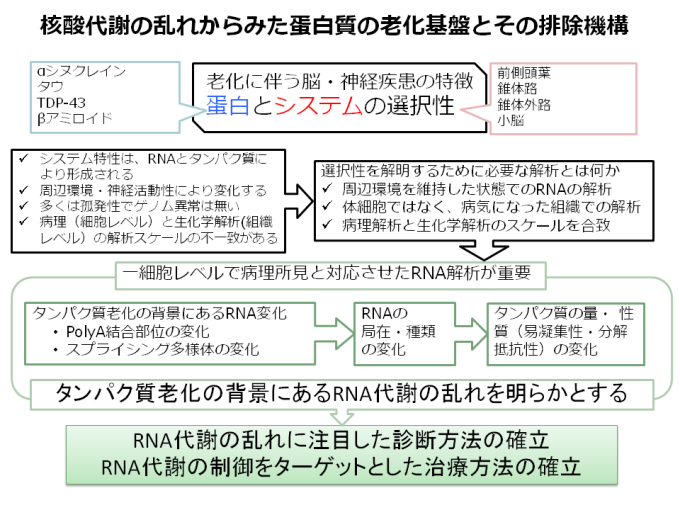
多くの孤発性神経疾患は老化によって引き起こされる。
しかし、この老化という現象が、細胞の維持システムにどのような不具合をもたらすのか、その本体は未だに明らかでない。
明らかなことは、神経変性疾患は無秩序ではなく、ある秩序をもって進行するということである。
神経変性疾患では、システムと、蓄積する蛋白の選択性に、その秩序がある。
老化という、普遍的な現象を背景とした、この、システム選択性に、これらの疾患を解明する手がかりがある。
神経組織は、変化する環境に高度に適応しつつ、ある状態を維持するというロバストネスを必要とする。
このロバストネスは、DNAからタンパク質の修飾までの種々の階層にて形成される。これらの階層の中で、最も多様性に富むのが、RNAのレベルである。
現在まで、老化は主として、DNA障害や、タンパク質の除去機構障害の観点から論じられ、この冗長性をもち、かつシステム特性の本体を担うであろうRNAの観点からの解析は少ない。
我々は、変性疾患のきっかけはRNA代謝の乱れにより引き起こされるとする仮説を立て、本領域では、この観点から神経変性疾患に対してアプローチを行う。
この目的のためには、神経細胞腫毎のRNA代謝を明らかとする必要がある。
今まで一細胞レベルでの解析は病理解析により進められてきたが、免疫染色法などで明らかにできる多様性には必然的に限界がある。
一方、近年の分子生物学的解析方法の革新によって、一細胞レベルでのRNA解析が可能となりつつある。
本研究では、組織所見と対比させて、一細胞レベルでのRNA挙動を明らかとして、老化とそれに基づく神経変性疾患の背景にあるRNA代謝の乱れを明らかとすることを目的とする。