研究について
再生医療グループ
脂肪由来幹細胞による腎疾患治療法開発
これまで間葉系幹細胞は脂肪・軟骨・骨への分化能に注目が集まってきましたが、最近間葉系幹細胞が免疫調整能を有することが分かってきました。我々は、これまで脂肪由来間葉系幹細胞に注目してきましたが、その理由として臨床的優位性として採取が比較的容易であり、増殖能に優れるという点があります。細胞治療において、間葉系幹細胞を培養する際に添加する血清は微生物・プリオンなどの感染のリスクとなり得るため、細胞増殖能を損なう事なく、血清使用量を可能な限り下げる必要があります。脂肪由来間葉系幹細胞はその優れた増殖能により5%以下(低血清培養脂肪由来幹細胞:LASC)においても20%血清で培養した骨髄由来間葉系幹細胞(高血清培養骨髄由来幹細胞:BM-MSC)と同等の増殖を示します。また、血清濃度を下げて培養することにより、LASCは再生を促進する因子、免疫調整する因子を多く産生するようになります(Iwashima S et al. Stem Cells Dev 2009)。
急速進行性腎炎は現在も予後不良の腎炎であり、未だにステロイド・シクロフォスファミドといった免疫抑制剤しか有効な治療法がないのが現状であり、これら免疫抑制剤においてしばしば感染や細胞毒性といった副作用を経験します。我々は、LASCを急速進行性腎炎ラットモデルに投与し、腎障害が大幅に改善することを報告しています(Furuhashi K et al. J Am Soc Nephrol 2013)。この他にも、急性腎障害、腹膜炎、創傷治癒に対しても、同様な治療効果を証明しています。この動物実験での成果をもとに、LASC治療の臨床応用に向けて、細胞調整や安全性検討を含めた基礎研究も現在進行中です。
LASC投与によるラット抗GBM抗体型腎炎治療効果
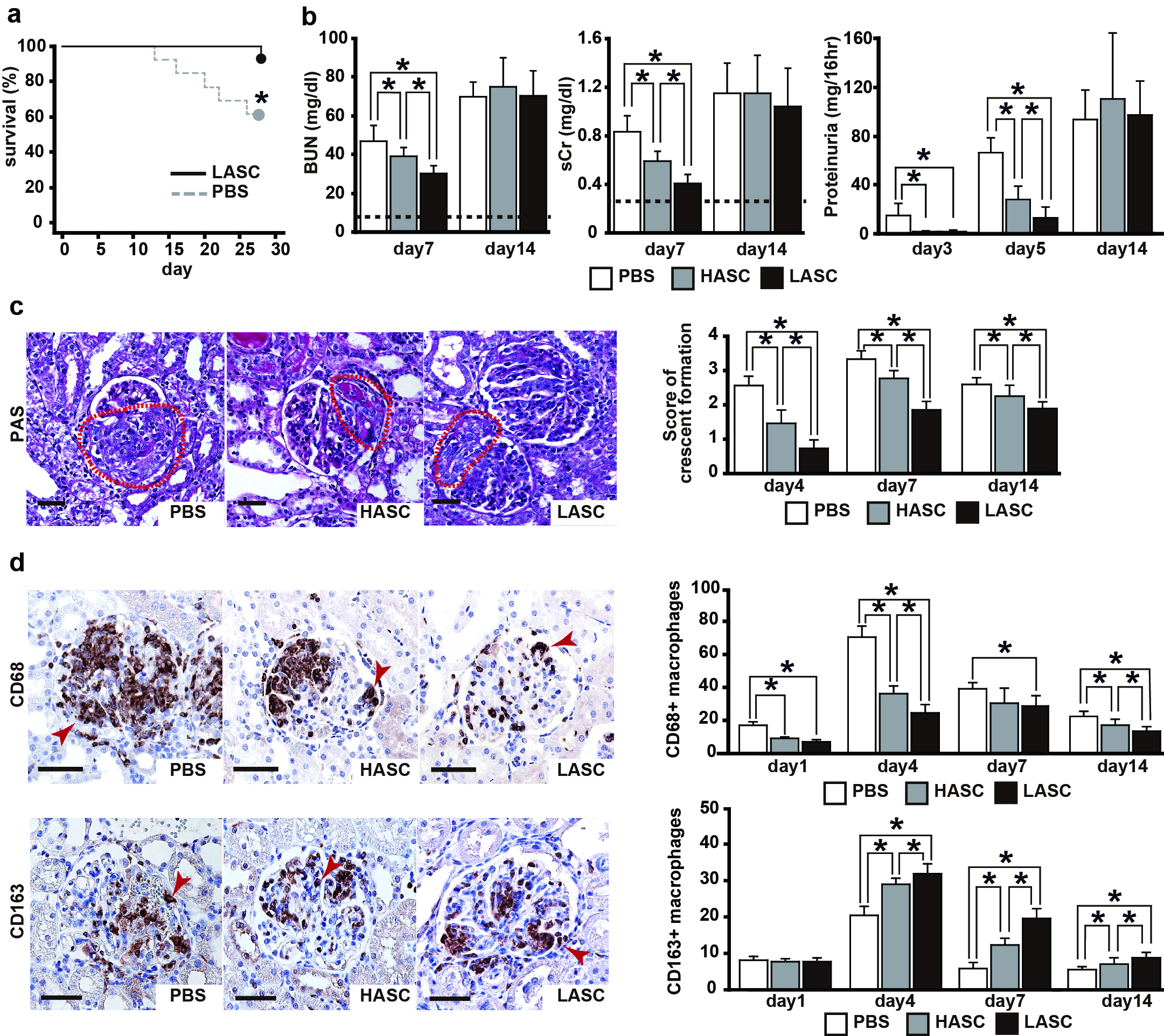
LASC投与によるラット抗GBM抗体型腎炎治療効果
- 低血清培養脂肪由来間葉系幹細胞(LASC)は抗糸球体基底膜抗体型腎炎モデルラットの生存率を改善させる。
- LASCは通常培養脂肪由来間葉系幹細胞(HASC)よりさらに強い腎保護効果を示した。
- LASCはHASCよりさらに強い半月体形成抑制効果(赤枠内)を示した。
- LASCはHASCより有意に糸球体へのCD68陽性浸潤マクロファージ(上段矢印)を減少させ、さらにCD163陽性免疫調整性マクロファージ(下段矢印)を増加させた。
LASCは通常培養脂肪由来間葉系幹細胞(HASC)より強い腎保護効果を示し、腎炎重症度の指標である半月体形成、浸潤マクロファージの抑制効果を示した。あらに、LASCはCD163陽性免疫調整性マクロファージをHASCより有意に増加させた。
抗糸球体基底膜抗体型腎炎へのLASCの作用機序
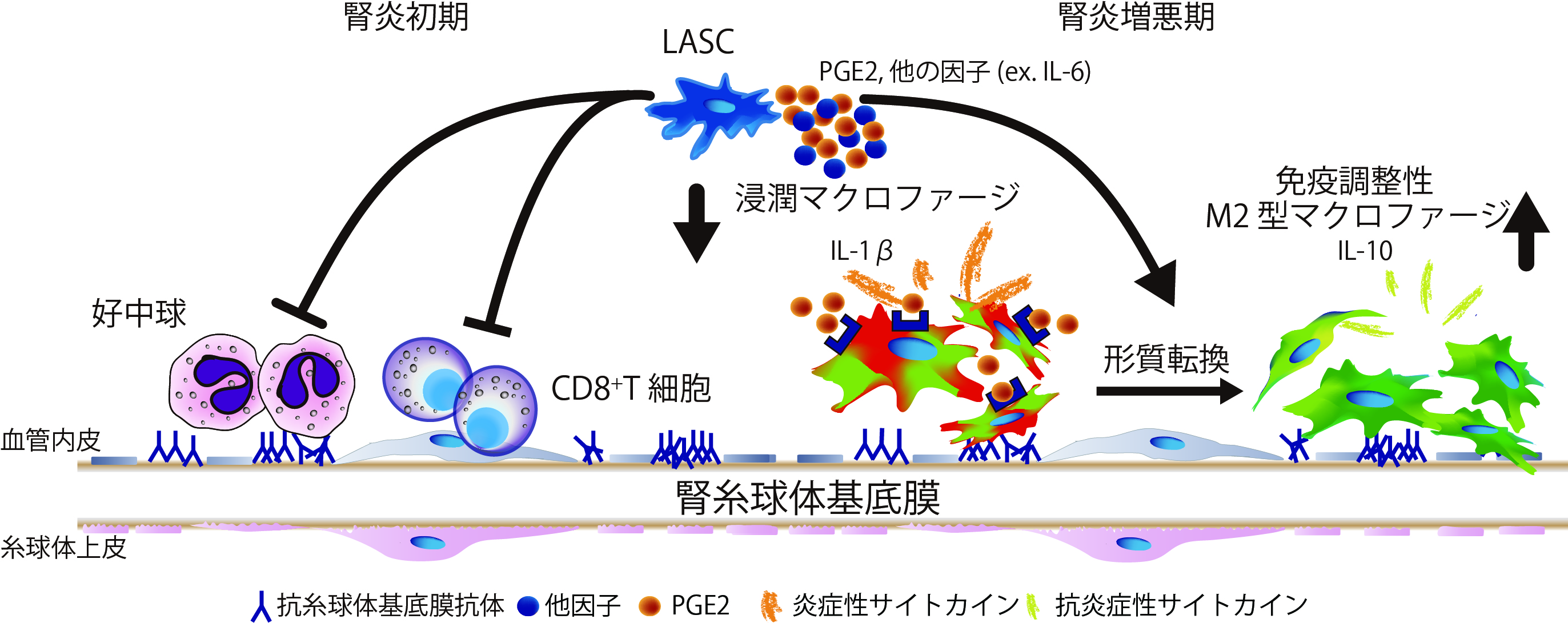
抗糸球体基底膜抗体型腎炎へのLASCの作用機序
投与されたLASCはPGE2、IL-6依存的に、免疫抑制物質IL-10を産生する免疫調整性マクロファージを腎炎症部位で誘導し、急速進行性腎炎に対し骨髄由来間葉系幹細胞・HASCに比べ優れた治療効果を果たす(Furuhashi K et al. J Am Soc Nephrol 2013)。
免疫学的機序を介した腎疾患発症・進展メカニズム解明
i)腎疾患における免疫調整性M2マクロファージの役割
マクロファージは、異物を貪食し処理する生体の掃除屋ですが、過度に活性化すると組織炎症が生じることが知られています。しかしながら、昨今マクロファージには従来の炎症性マクロファージ(M1マクロファージ)に加え、組織修復の過程で炎症の収束などの機能を発揮する新たな細胞群(M2マクロファージ)の存在が明らかとなってきました。当研究室では患者腎生検組織を、M2マクロファージ特異的マーカーであるCD163陽性細胞を染色することで、M2マクロファージ集積の腎疾患による相違を解析しました。その結果、急速進行性糸球体腎炎を生じるANCA関連腎炎や全身性ループスエリテマトーデスに合併する活動型糸球体腎炎(class IVループス腎炎)糸球体において、CD163陽性M2マクロファージが優位に集積することを明らかにしました(Endo N et al. Nephrol Dial Transplant 2016)。
代表的腎疾患およびループス腎炎患者糸球体におけるCD163発現
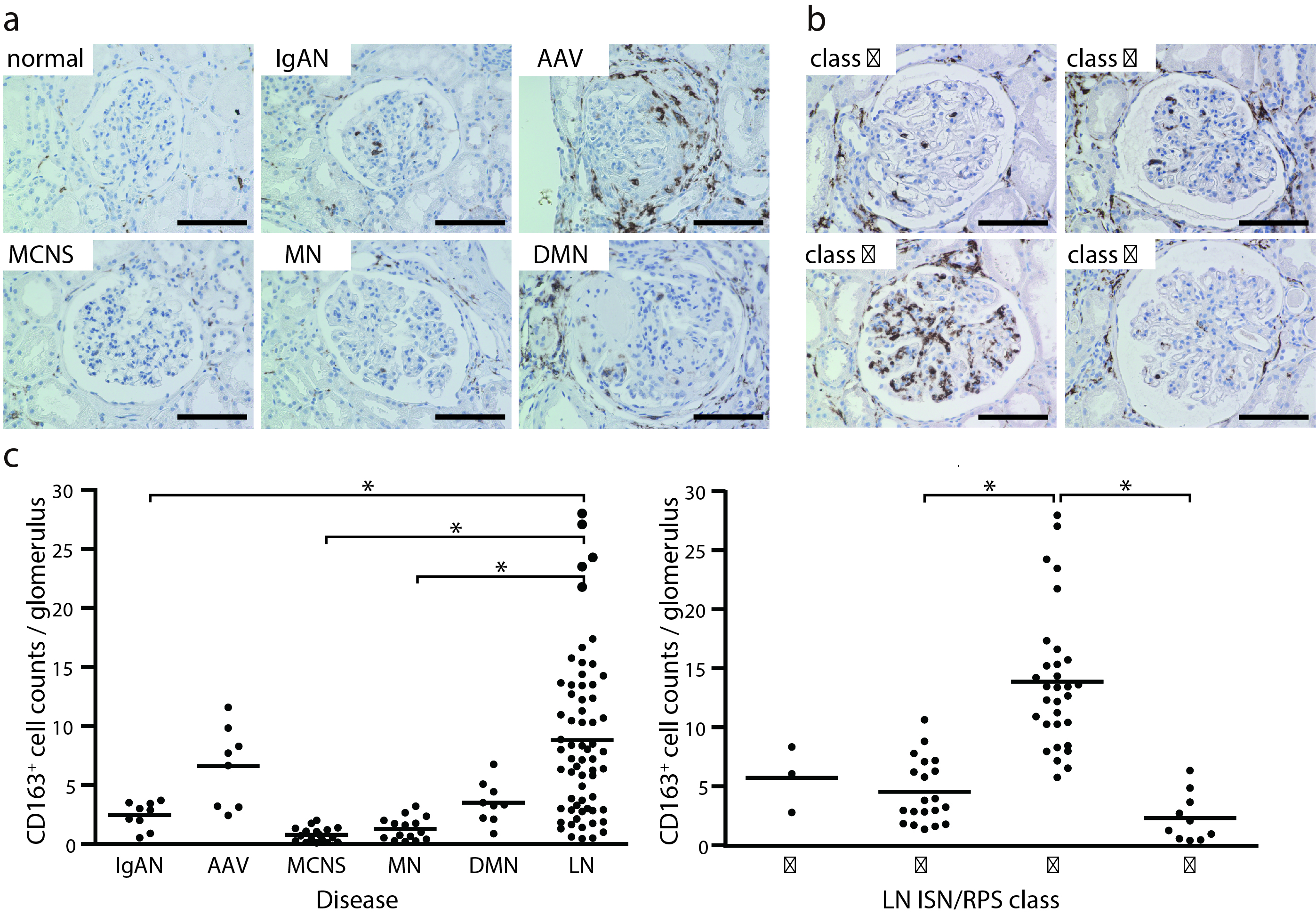
代表的腎疾患およびループス腎炎患者糸球体におけるCD163発現
各種腎疾患糸球体(a)、ループス糸球体腎炎(b)のCD163染色像(茶色がCD163陽性細胞)。
各種腎疾患(左)とループス腎炎(右)単糸球体あたりのCD163陽性細胞数。
IgAN:IgA腎症 AAV:ANCA関連腎炎 MCNS:微小変化型ネフローゼ MN:膜性腎症 DMN:糖尿病性腎症 LN:ループス腎炎(Endo N et al. Nephrol Dial Transplant 2016)
また我々は、マウス骨髄細胞あるいはiPS細胞から、人為的にCD206陽性M2マクロファージを誘導することに成功しました。さらに、得られたM2マクロファージを、透析に至る可能性の高い半月体形成性糸球体腎炎のマウスモデルに対し経静脈的に投与し、尿蛋白減少や腎組織障害の軽減など、優れた腎障害減少効果を明らかにしました(Du Q et al. Am J Pathol 2016)。このことはM2マクロファージ投与が将来的に糸球体腎炎のみならず、他の炎症性疾患への治療法になりえることを示唆しています。
CD206+ M2マクロファージ投与によるマウス抗GBM抗体型腎炎の治療効果
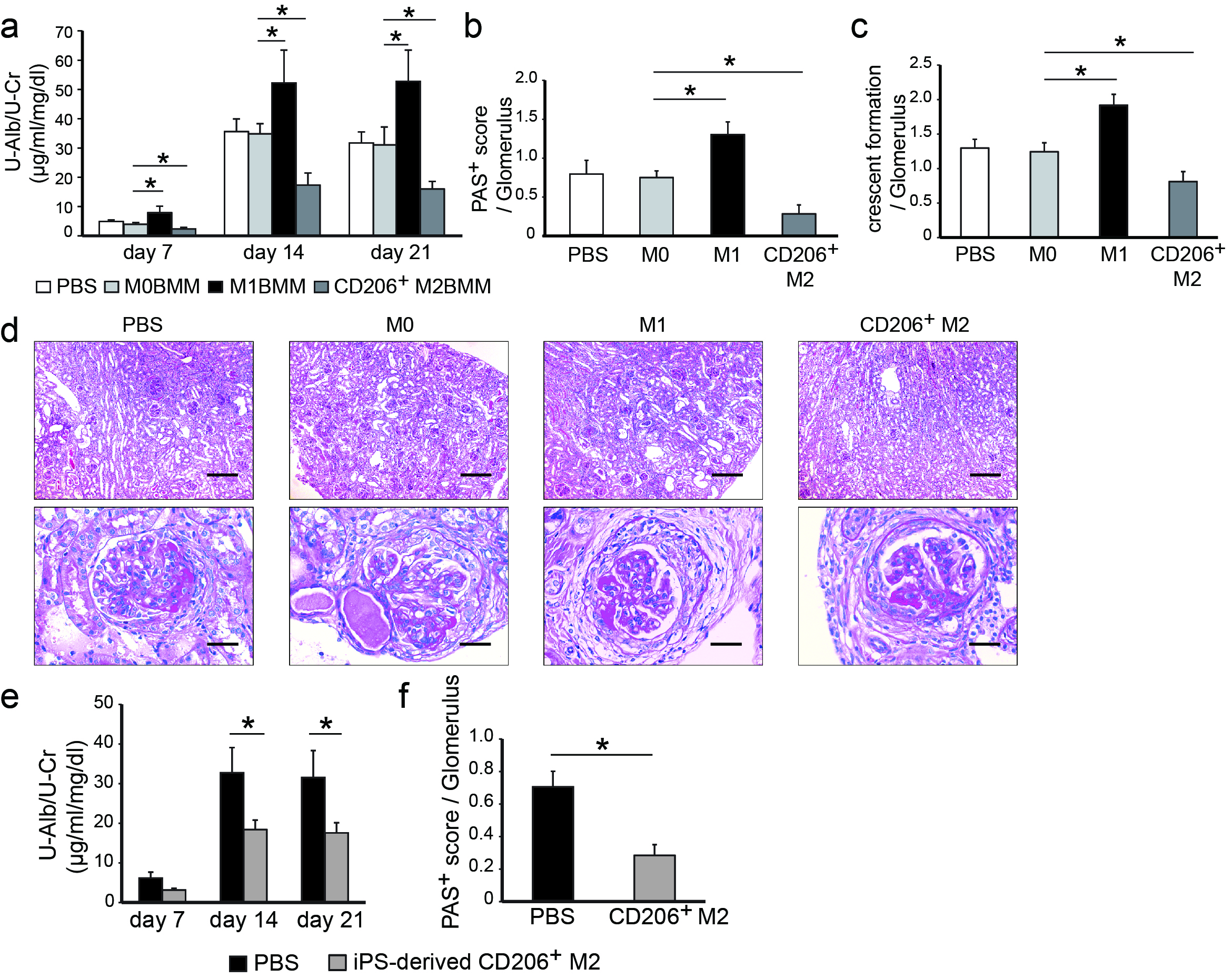
CD206+ M2マクロファージ投与によるマウス抗GBM抗体型腎炎の治療効果
骨髄由来CD206+ M2マクロファージ投与はマウス半月体形成糸球体腎炎を改善する(a-d)。a:尿蛋白 b:PAS陽性糸球体沈着物 c:糸球体半月体形成 d:腎組織切片PAS染色像
iPS細胞由来CD206+ M2マクロファージも骨髄由来細胞同様の腎障害改善効果は発揮する(e、f)。e:尿蛋白 f:PAS陽性糸球体沈着物(Du Q et al. Am J Pathol 2016)
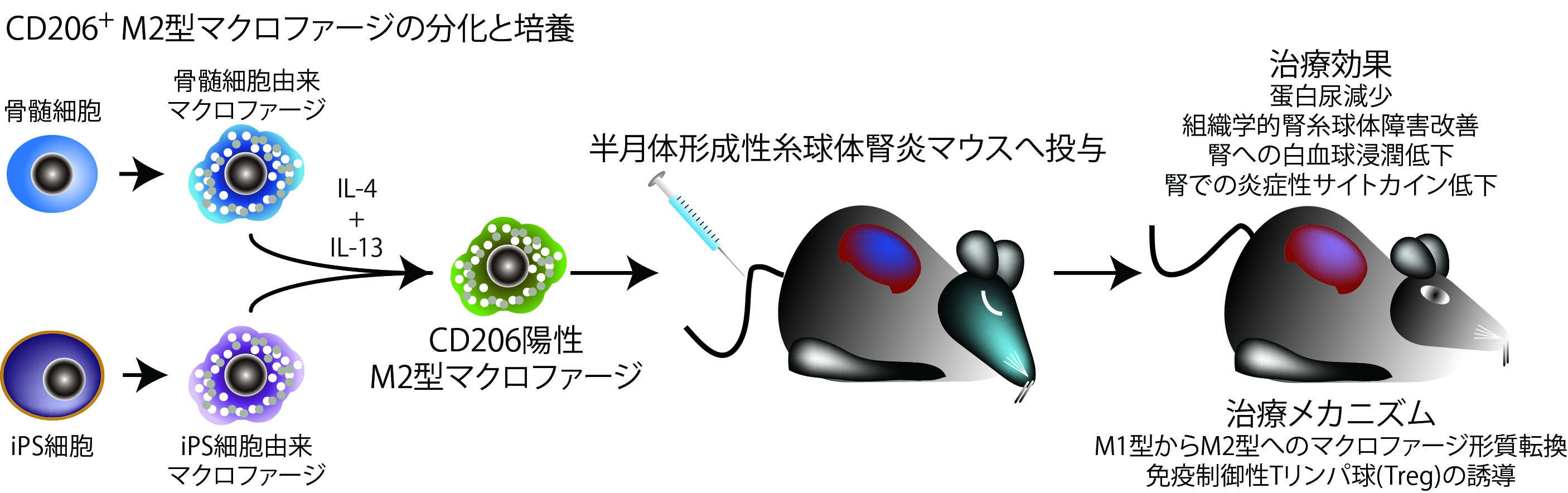
骨髄細胞あるいはiPS細胞由来CD206+M2型マクロファージ投与による半月体形成性腎炎治療
骨髄細胞あるいはiPS細胞由来CD206+M2型マクロファージ投与による半月体形成性腎炎治療
ii)白血球発現タンパクを用いた新規腎疾患バイオマーカー開発
腎疾患の診断・疾患活動性評価・治療方針決定には、血清クレアチニンや検尿などのスクリーニング検査に加え腎生検が必須です。しかしながら腎生検は、患者への身体的負担が大きく、繰り返し行うことができない検査法です。故に現在、腎疾患の診断・治療効果判定・予後予測に有用なバイオマーカーが望まれています。本研究室では「糸球体腎炎のバイオマーカー開発」を目標とし、候補分子を同定しました。マクロファージに発現するCD163は、ヘモグロビン-ハプトグロビン複合体に対するスカベンジャー受容体ですが、LPSや酸化ストレスなど外的刺激による細胞活性化によりタンパク分解を受け、その細胞外ドメイン(sCD163)が放出されます。我々は2009〜2012年にN-KDRに登録されたヒトLN患者72人において、尿中sCD163上昇と、腎糸球体でのCD163陽性細胞数、組織学的疾患活動性との有意な相関を報告しました(Endo N et al. Nephrol Dial Transplant 2016)。この研究成果は尿中sCD163がループス腎炎のバイオマーカーとして有用であることを示唆します。今後はより大規模な患者集団で検証することでCD163の臨床的意義を高めるとともに、この他の候補分子についても現在検討を行なっています。
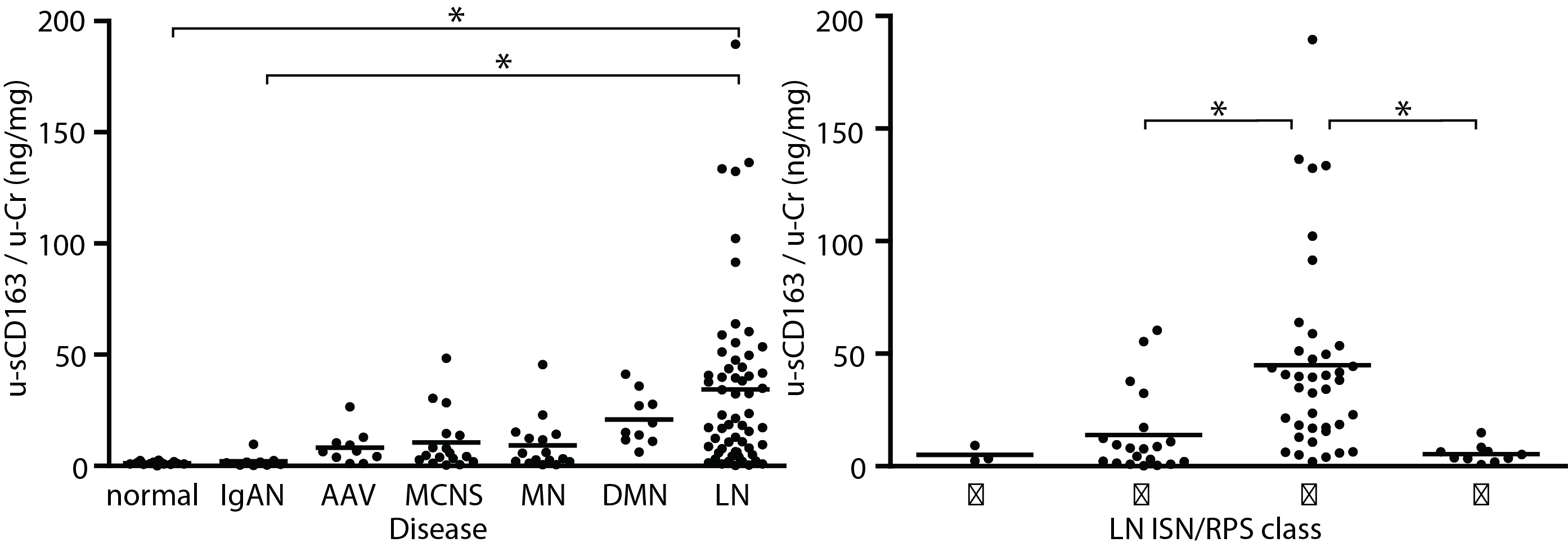
腎疾患患者における尿中sCD163
腎疾患患者における尿中sCD163
左. 各種腎疾患患者の尿中sCD163比較
右. ループス腎炎組織分類毎の比較
2009〜2012年N-KDR録患者の尿中sCD163をELISA法で測定し、尿中Crで標準化した。
normal:正常 IgAN:IgA腎症 AAV:ANCA関連腎炎 MCNS:微小変化型ネフローゼ MN:膜性腎症 DMN:糖尿病性腎症 LN:ループス腎炎 ✽:p<0.05(Endo N et al. Nephrol Dial Transplant 2016)
間葉系幹細胞に着目した腎間質線維化の機序解明と新規治療法の開発
臓器線維化は創傷治癒における一つの転帰であり、あらゆる臓器の慢性疾患や老化による機能不全状態において普遍的に認められる組織変化です。腎臓ではステージの進行した慢性腎臓病における腎線維化がそれに当たります。線維化とは「平滑筋アクチン(α-SMA)陽性筋線維芽細胞の増生とそれに伴う細胞外基質の沈着」と説明されますが、実は筋線維芽細胞の本態や起源は未確定で諸説あり、尿細管上皮細胞・末梢血前駆細胞・骨髄幹細胞・血管内皮細胞・周皮細胞など複数の報告があります。細胞系譜解析によって実験的確証が示されているものの一つとしては間葉系幹細胞(MSC:Mesenchymal stem/stromal cell)があります。MSCの最大の特徴は炎症部位集積性や腫瘍集積性を有し、さらに炎症鎮静化作用を発揮するという点です。しかしながら、炎症や腫瘍に集積したMSCは「諸刃の剣」であり、集積したMSCが時間経過とともにα-SMA陽性筋線維芽細胞に分化し線維化をもたらすことが問題となります。
我々の研究室も長らく腎線維化の研究に携わってきました。中でもWntシグナルとの関係性に着目し、Wntシグナルが腎繊維化に大きな役割を果たす事を報告してきており(Saito S et al. Fibrogenesis Tissue Repair, 2015)、更に腎間質の繊維化の原因となる筋線維芽細胞の起源を探索していました。
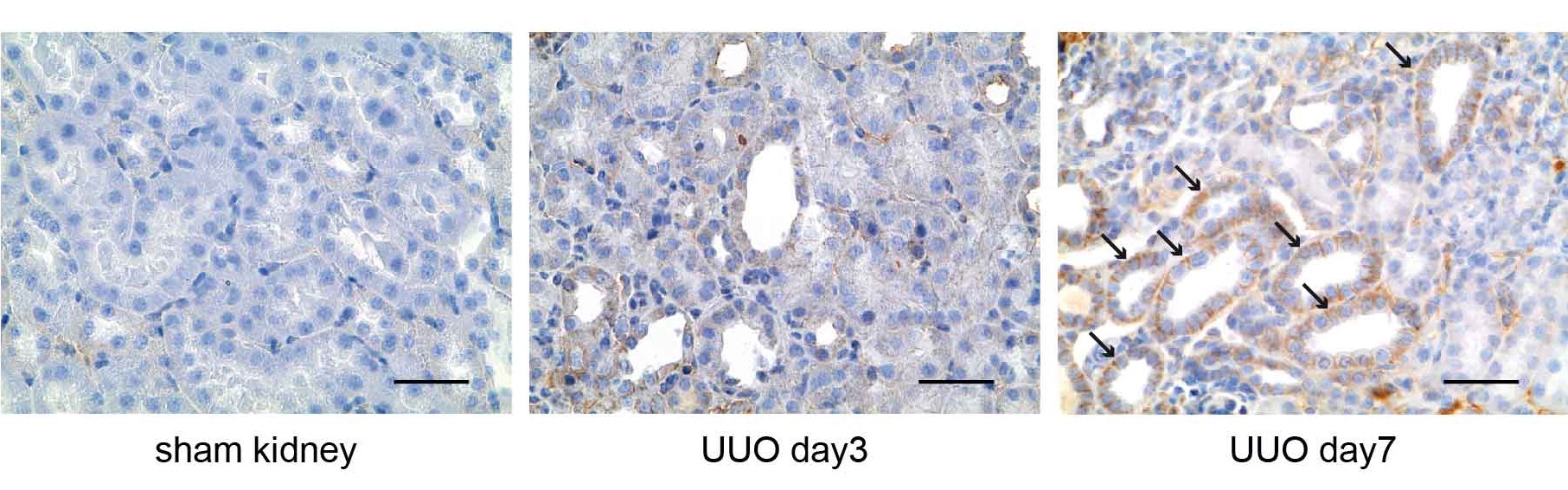
腎臓間質の繊維化に伴い、Wntシグナルは増強する(免疫染色)
腎臓間質の繊維化に伴い、Wntシグナルは増強する(免疫染色)
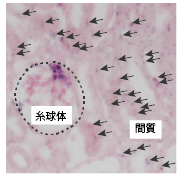
Meflinは腎臓間質の細胞に発現する
(in situ hyblidization)
Meflinは腎臓間質の細胞に発現する
(in situ hyblidization)
そんな中、私達は最近、MSCに特異的なマーカー分子としてMeflin(メフリン)を同定しました(特願2015-153712、Maeda K, et al. Sci Rep, 2016)。MeflinはこれまでのMSCマーカーと異なり、造血幹細胞、血球、上皮細胞、内皮細胞、平滑筋細胞、神経細胞、癌細胞には発現しません。そしてMeflinはin situ hybridizationにて腎間質および糸球体血管極の細胞に発現することを見出しています。
私たちはこの「Meflin陽性MSC」が炎症部位に集積し組織修復に寄与する一方で、病態の経過とともにMeflin陰性・α-SMA陽性筋線維芽細胞へ分化し腎間質の線維化に関与しているのではないかと考え、実験を進めています。

(in situ hyblidization)
 ホーム
ホーム 患者さんへ
患者さんへ 臨床研修のご案内
臨床研修のご案内 ご紹介・専門外来
ご紹介・専門外来 医局案内
医局案内 NNFP
NNFP 研究について
研究について お問い合わせ先
お問い合わせ先 ブログ
ブログ
