患者さんへ
脂肪由来幹細胞を用いた再生医療
再生医療とは
再生医療とは、組織や臓器の欠損や機能不全に対し、幹細胞を使って機能を回復する医療です。幹細胞とは、多能性幹細胞と体性幹細胞に分類することができ、前者の代表はiPS細胞、後者の代表は間葉系幹細胞(MSC)です。
再生医療ときくと、iPS細胞から作製した臓器を移植するという方法が思い浮かぶかと思います。しかし、その実現にはまだ時間がかかりそうです。現在既に実用化された再生医療としては、幹細胞を直接体内に投与する細胞治療が挙げられます。実際に、間葉系幹細胞を使って臓器の再生を促進する臨床治療はすでに始まっています。
再生医療について、iPS細胞と間葉系幹細胞とは何か、その違いを説明します。
★ 名古屋大学医学部腎臓内科では、難治性のIgA腎症に脂肪由来間葉系幹細胞を投与する臨床試験を実施中です。その他の疾患については現在実施していません。
iPS細胞
1.iPS細胞は日本で生まれた幹細胞
再生医療の有名なものとして、iPS細胞を用いたものがあります。iPS細胞は、2012年に京都大学の山中伸弥教授がノーベル賞を受賞したことで、注目が高まりました。

2.iPS細胞は「多分化能」をもつ
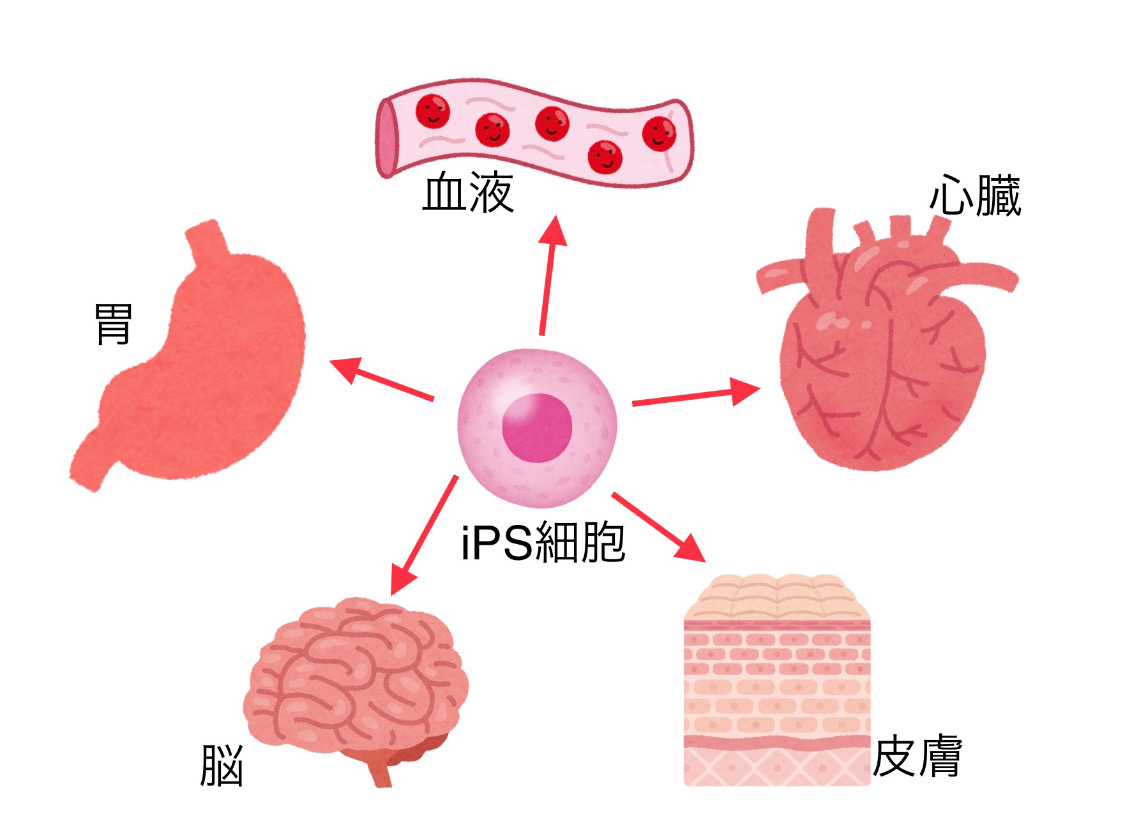
幹細胞の中には、どの細胞になるか既に運命づけられた幹細胞(前駆細胞)とあらゆる細胞になることができるiPS細胞とがあります。
具体的には、血液の前駆細胞なら血液を構成する細胞に、神経の前駆細胞なら神経を構成する細胞にといったようにある系統の細胞にのみなることができる細胞が前駆細胞です。一方、iPS細胞はヒトの体を構成する心臓、脳、皮膚といったあらゆる細胞になることができます。これが、iPS細胞が多分化能を有する幹細胞といわれる所以です。
3.iPS細胞は何がすごいのか
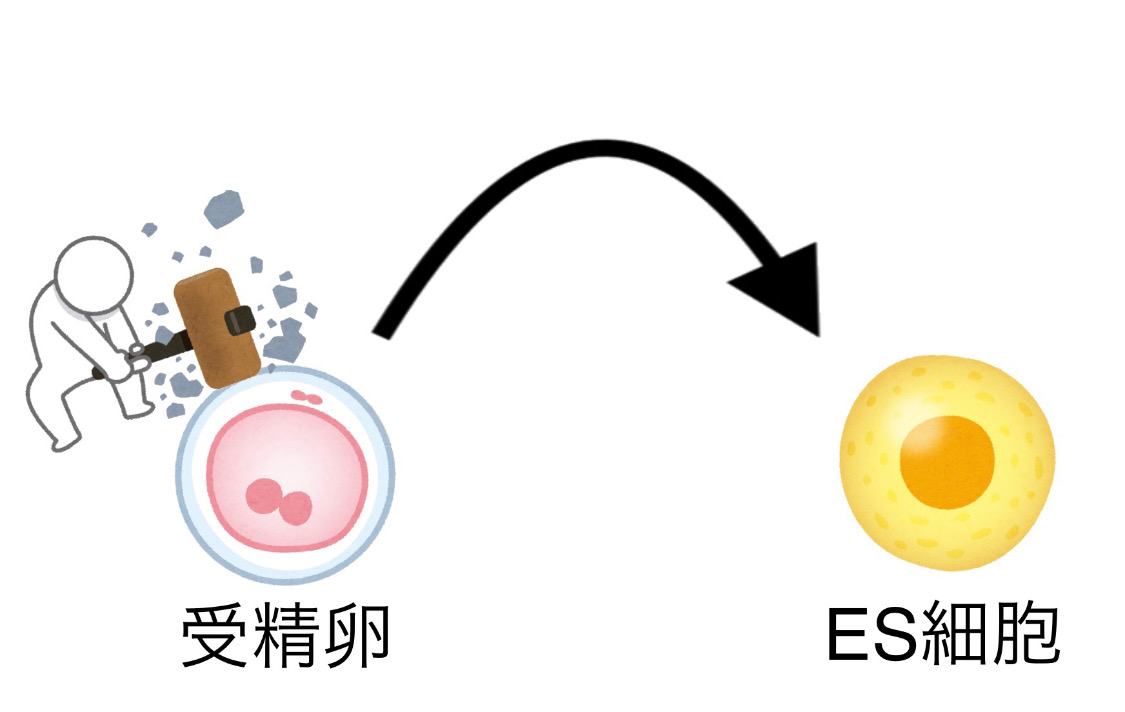
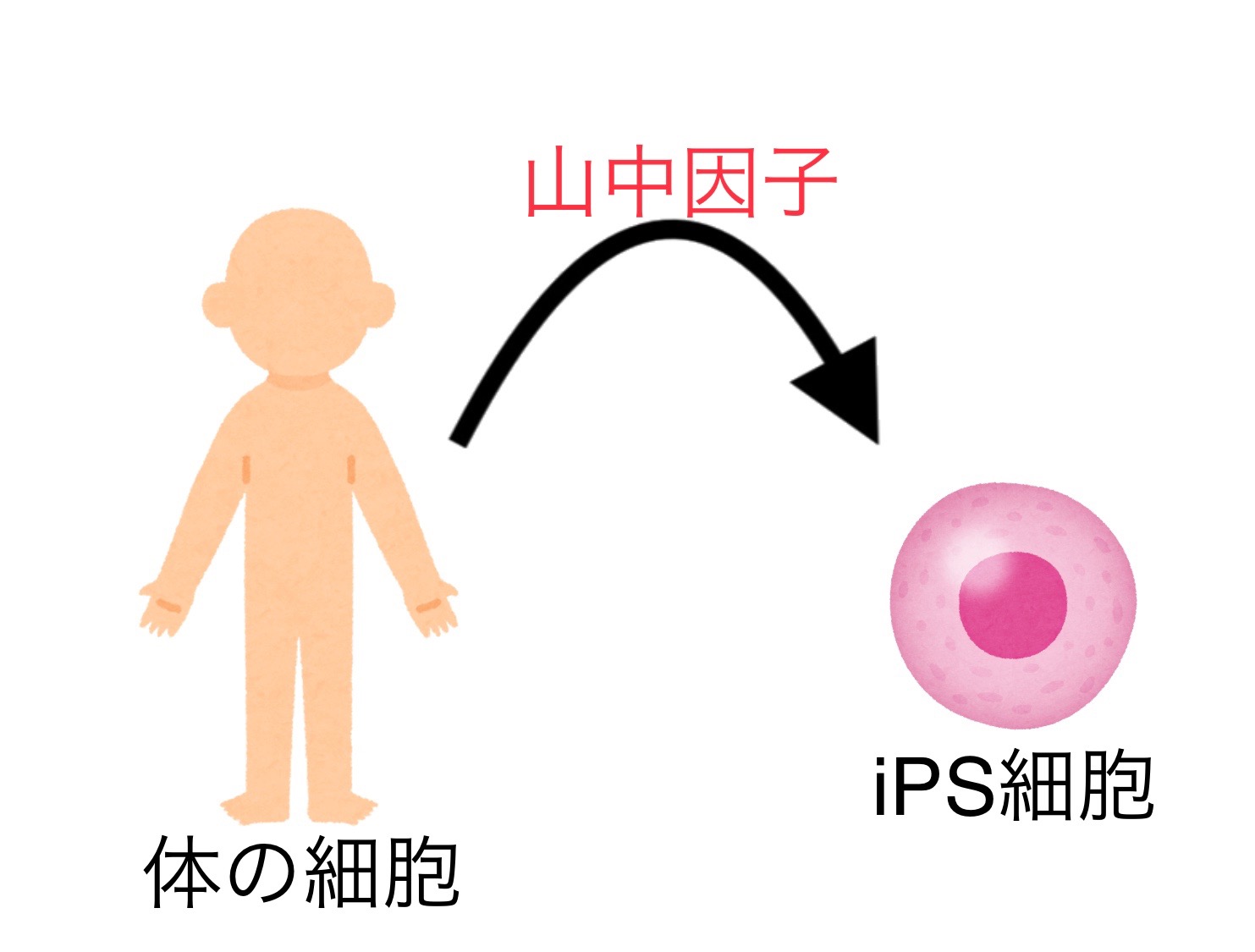
iPS細胞が画期的だったのは、自分の皮膚や血液、歯茎、歯などから作製することができることです。
iPS細胞が発見される以前において多能性幹細胞としては、ES細胞という細胞が知られていました。しかし、この細胞は赤ちゃんになるための受精卵を壊して作製する必要があったため、倫理的な問題がありました。
iPS細胞は、体の細胞に山中4因子と呼ばれる4つの遺伝子を導入して作製するため、ES細胞のような倫理的な問題が発生しません。これにより、再生医療の可能性が大きく広がることとなりました。
4.iPS細胞の問題点

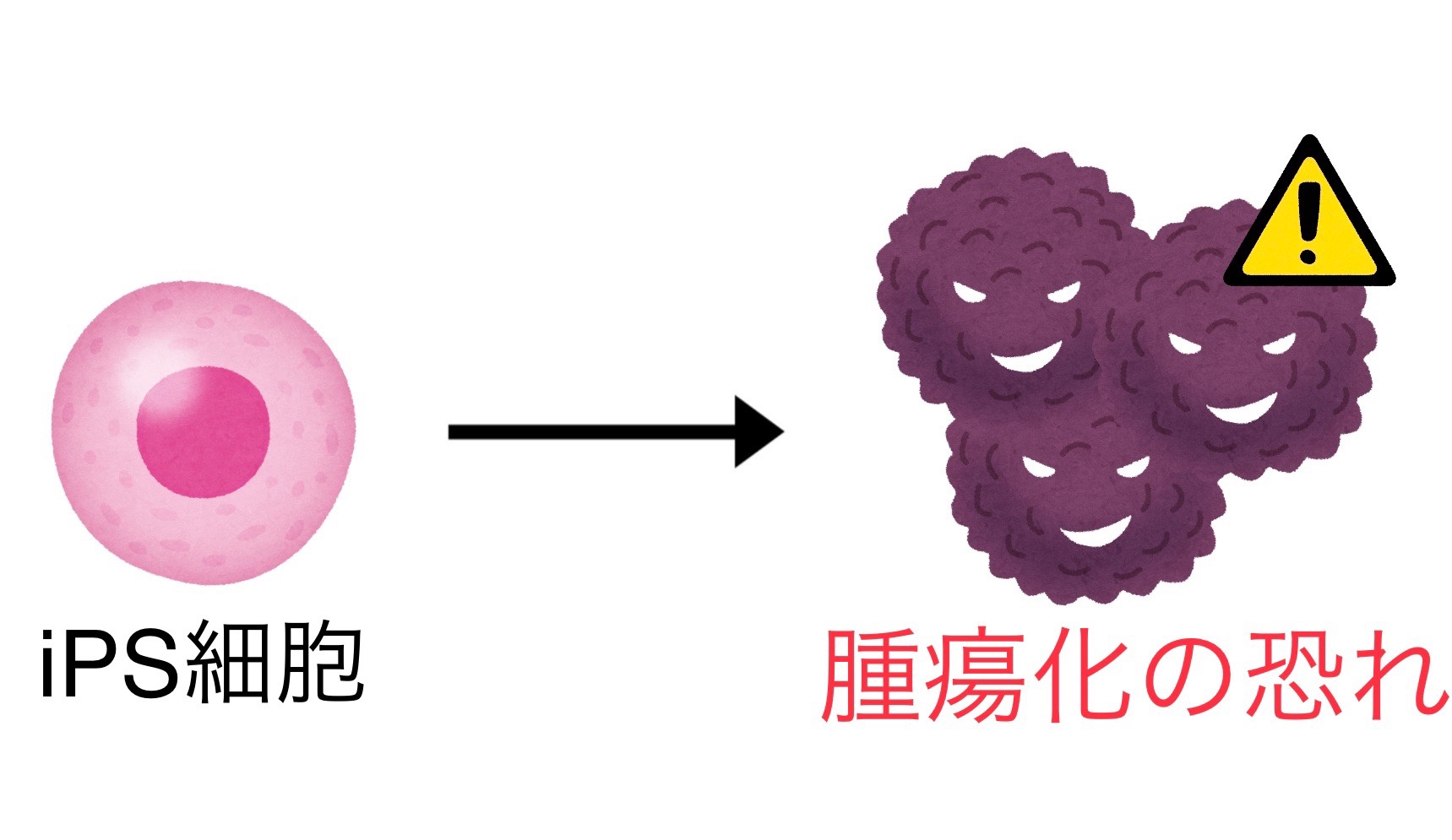
多能性幹細胞を倫理的問題無しに簡単に作り出すことができるというiPS細胞ですが、iPS細胞にもリスクが存在します。iPS細胞から作製した臓器に分化していないiPS細胞が含まれていると、その未分化なiPS細胞が腫瘍化してしまうのです。治療のために移植した臓器のiPS細胞によって腫瘍ができてしまっては、治療による恩恵が少なくなってしまいます。また、作製のために1年以上かかることと、莫大な費用が必要であることも現在の問題です。
間葉系幹細胞(MSC)
1.間葉系幹細胞とは体の中にある幹細胞のひとつ
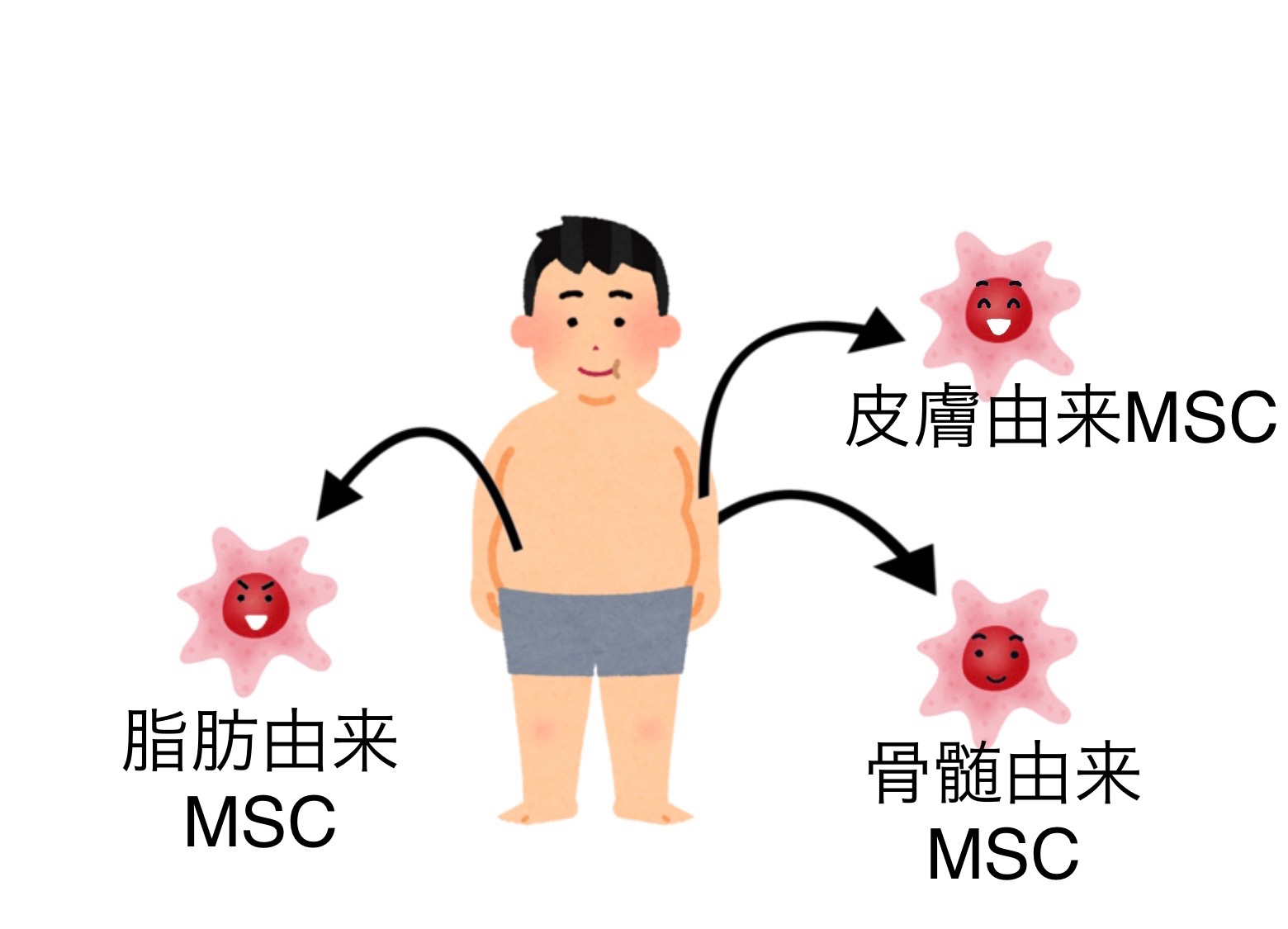
間葉系幹細胞とは、ヒトが持つ幹細胞のひとつでMSCとも呼ばれています。
MSCは、骨髄や脂肪、皮膚など全身の様々な場所に存在しています。また、その部位によってMSCの性質も少し違っています。
本来MSCとは、脂肪・骨・軟骨に分化できる細胞と定義されていますが、この他のある組織細胞(肝細胞、神経細胞など)へも分化することもできます。
2.iPS細胞とMSCの違い
MSCとiPS細胞の違いとしては、MSCには免疫調整機能という機能が備わっているという点が挙げられます。自分以外の人間のiPS細胞から作製した臓器を移植すると、拒絶反応が起こってしまいます。一方、MSCには、免疫調整能があるため、移植しても拒絶反応は起きません。
また、MSCを用いた治療では、iPS細胞で問題となっている腫瘍化のリスクも少ないという利点があります。
| iPS細胞 | 間葉系幹細胞(MSC) | |
|---|---|---|
| 得られる場所 | 全身の細胞から | 全身の細胞から |
| 多分化能 | あり | 限定的 |
| 拒絶反応(他人由来の場合) | あり | なし |
| 腫瘍化のリスク | 高い | 低い |
| 費用 | 高い | 安い |
| 準備期間 | 長い | 短い |
3.MSCの治療はもう始まっている
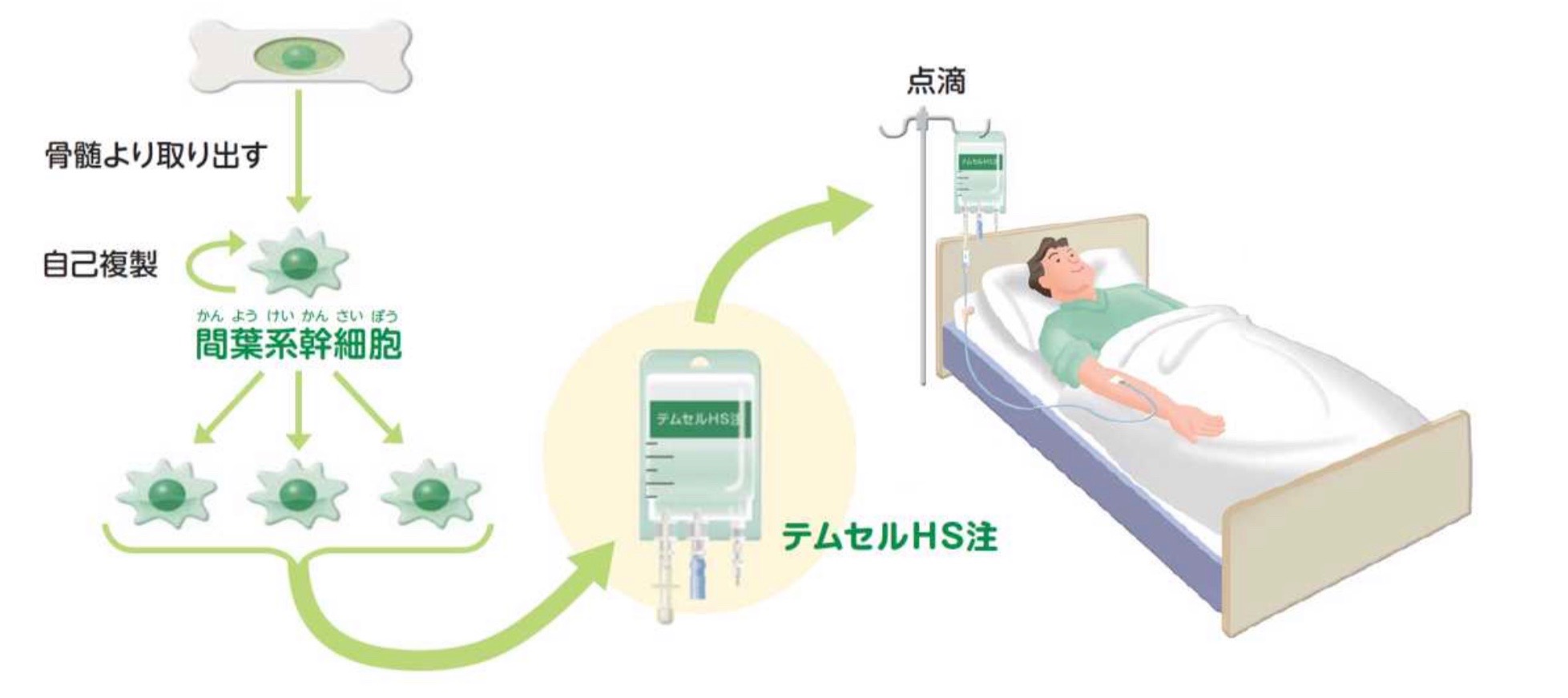
厚生労働省ホームページ「中央社会保険医療協議会 総会(第313回) 議事次第」より引用
iPS細胞を用いた治療が研究途上であるのに対して、MSCを用いた治療は既に実用化されているという点において一歩リードしています。実際に、骨髄移植後の移植片対宿主病に対する治療薬としてMSCを含有したテムセルという細胞治療薬が保険適応されています。さらに、最近の実用化例として、2018年の12月に骨髄由来のMSC(ステミラック注)を用いた脊髄損傷への治療が臨床使用可能となりました。これは、患者自身の骨髄液から採取したMSCを培養し、再び体内に戻すことで脊髄の神経の再生を促進するというものです。
4.MSCの種類
このように、現在の治療に用いられているMSCは、骨髄液から採取した骨髄由来のものが多いです。これは、骨髄由来のものが早くに発見されたためですが、研究が進むにつれて様々な臓器からMSCが作製可能であることが分かってきました。さらに、採取臓器ごとにMSCの性質が違うことが分かってきました。骨髄由来のMSCと比較して臓器修復、免疫調整能に優れたMSCとして脂肪由来のMSCが注目を集めています。
5.脂肪由来MSC
脂肪由来のMSCは、脂肪組織から採取することができるMSCです。脂肪由来のMSCには、骨髄由来のMSCより優れた点がいくつかあります。
1.含有量が多い
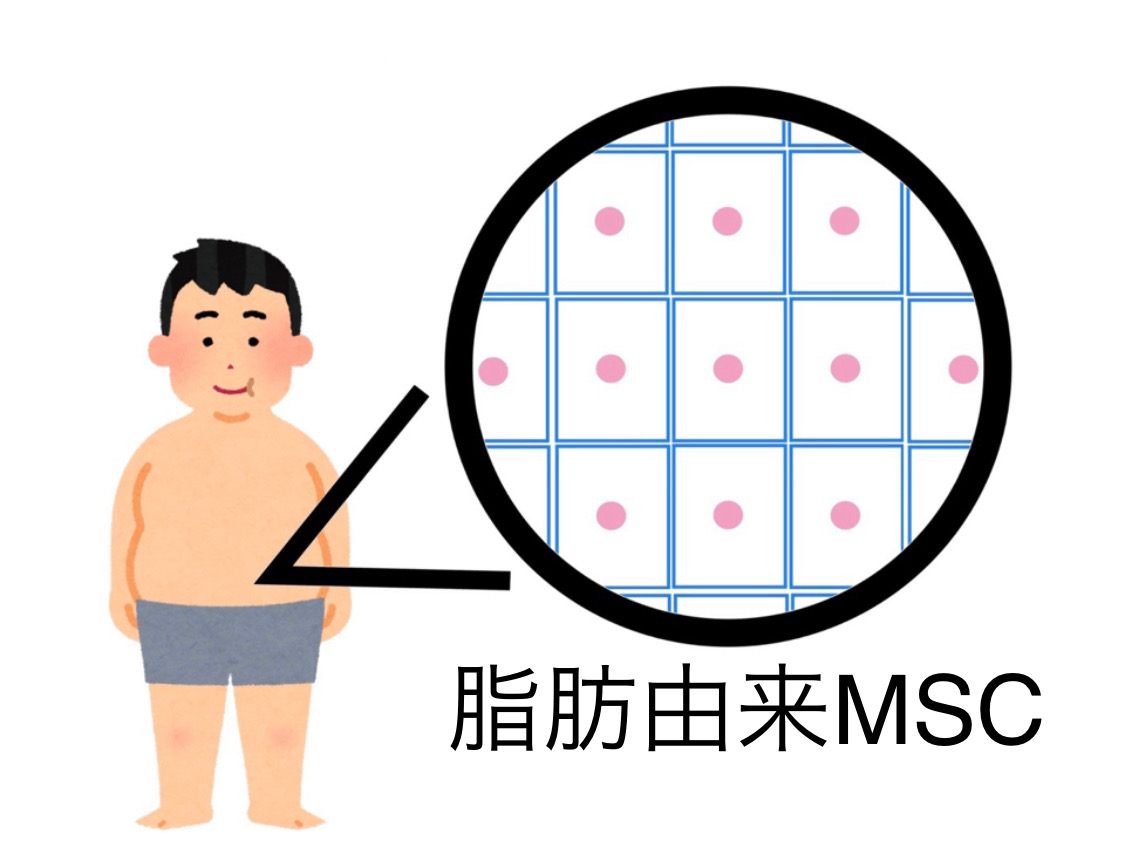
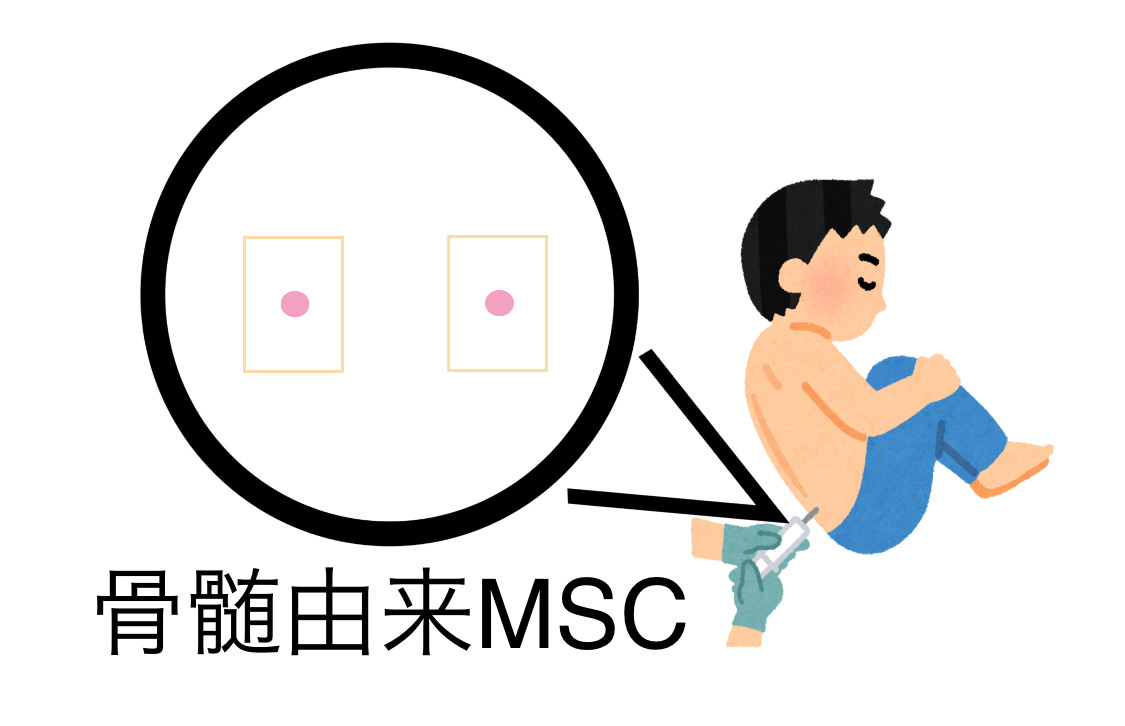
骨髄由来MSCは骨髄にある細胞の内およそ0.01%しかないのに対して、脂肪組織に含まれる脂肪由来MSCの数は骨髄中に含まれるMSCの500倍もの量が含まれています(1)。骨髄由来MSCは採取できる量が限られているのに対し、脂肪由来のMSCは全身の脂肪組織から大量に採取することができます。
2.産生する各種因子の量が多い
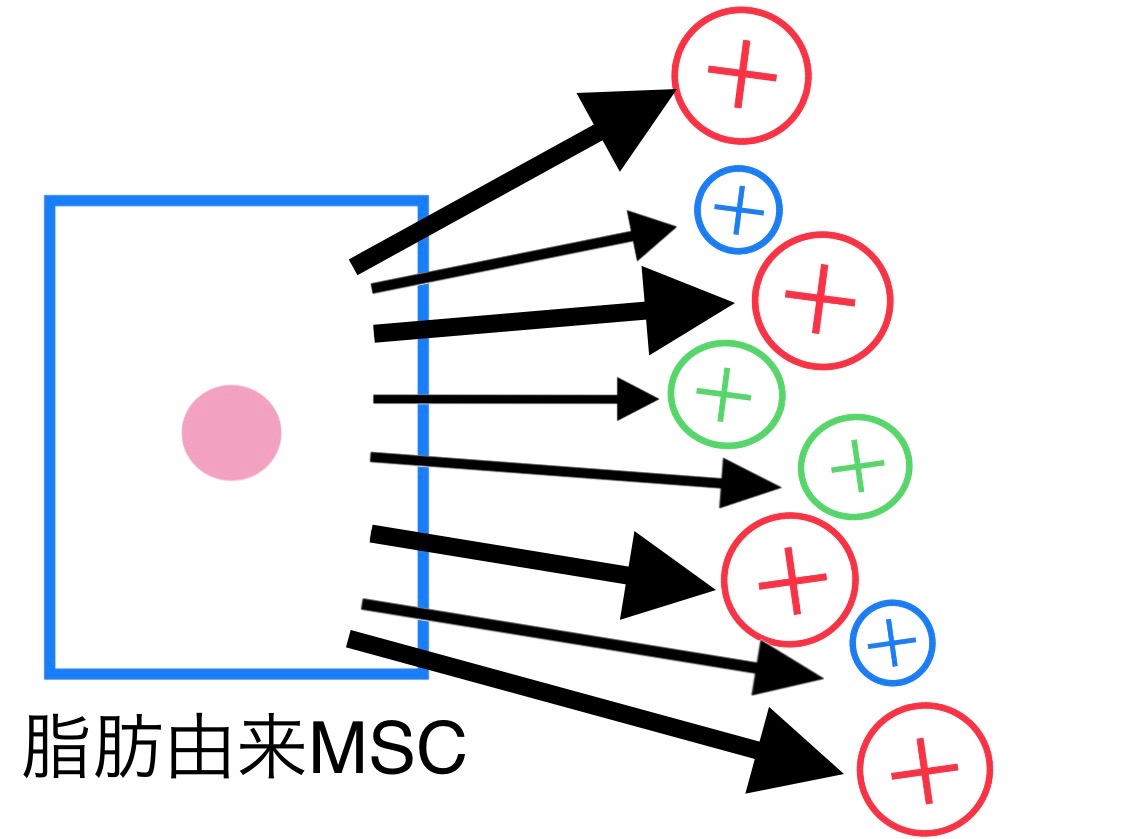
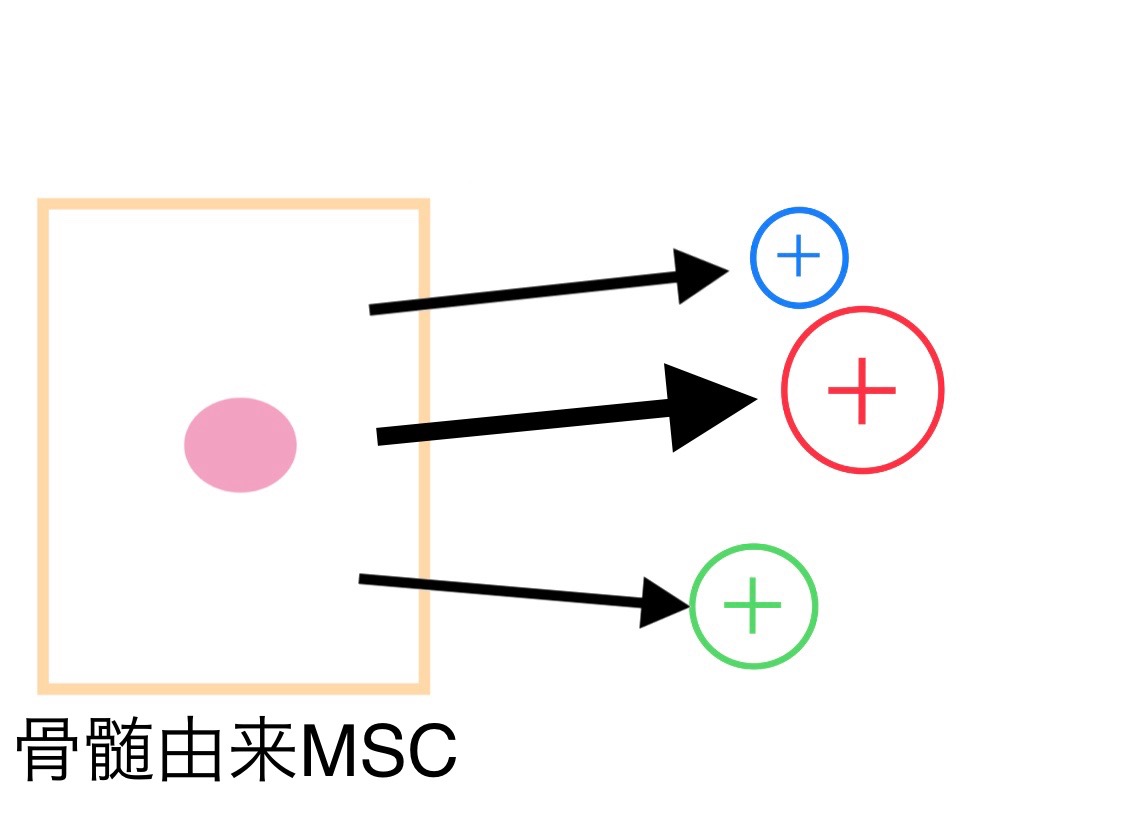
脂肪由来MSCは、骨髄由来のものと比べて臓器修復に寄与するHGF(肝細胞増殖因子)やVEGF(血管内皮増殖因子)といった成長因子(再生促進因子)の産生が多いです(2)。
3.免疫抑制機能が強い
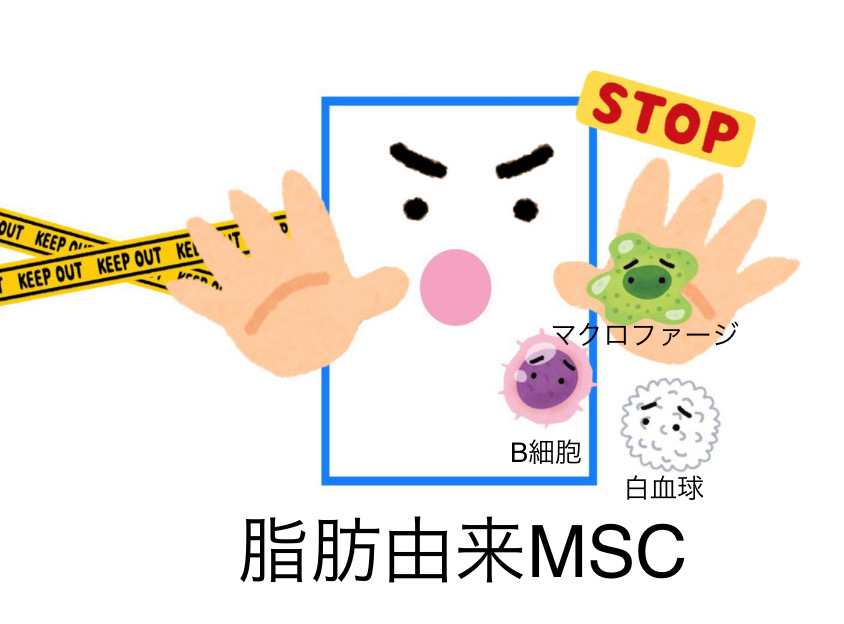

脂肪由来MSCは、骨髄由来のものと比較して免疫抑制能が高いという特徴もあります(3)。動物実験で脂肪由来MSCは、腎炎を劇的に改善させることが分かっています(4)。
4.高齢者のものでも増殖させることができる
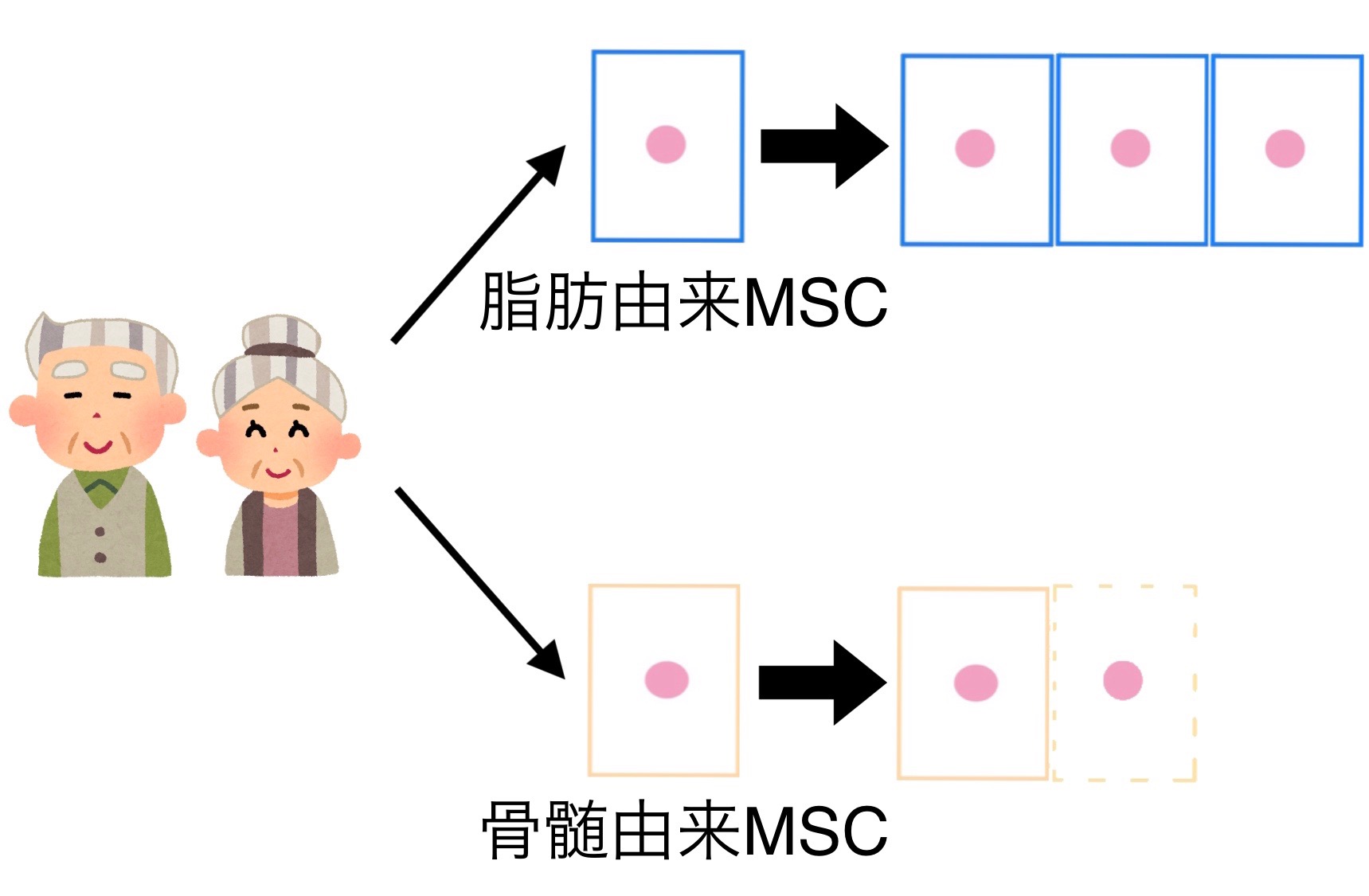
MSCは、加齢とともにその数も減少していきます。加齢による影響はそれだけではなく、骨髄由来のMSCは加齢とともに増殖のスピードが遅くなるという報告もあります(5)。それに対して脂肪由来のMSCは高齢者の脂肪組織から得たものであっても、問題なく増殖することができます。
5.採取するにあたって、患者への負担が少ない
骨髄由来のMSCを採取するためには全身麻酔を用いたりするため、採取するにあたってその患者さんへの体の負担が大きいです。対して脂肪由来のMSCでは、脂肪組織が体の表面に近いため、採取にあたって患者さんへの負担は少なくて済みます。
低血清培養法
脂肪由来のMSCはその機能面で骨髄由来のMSCより優れているのですが、名古屋大学医学部付属病院で独自に開発した培養法である低血清培養法を用いると、再生促進能力と免疫抑制能をより高めた脂肪由来MSCを作り出すことができます。また、この培養法を用いると、脂肪組織1gから、4週間以内に臨床で通常使用される量の10回分のMSCを作製することもできます。
この培養法によって作成したMSC(LASC)は、難病である糸球体腎炎やその他いくつかの疾病に対して骨髄由来MSCや通常の脂肪由来MSCよりも優れた治療効果があることが分かっています。現在、この細胞の特性を活かし、臨床応用に向けた準備を進めています。
まとめ

MSCを用いた治療は、iPS細胞を用いた治療と比べて実用化という点で一歩リードしています。MSCの治療応用として、既に臓器障害がある疾患、既存の免疫抑制薬で制御不能な難治性炎症性疾患が挙げられます。これは、MSCのもつ臓器再生能と免疫制御能といった特性を利用した治療法です。
MSCは既にある疾患において臨床応用されており、様々な疾患において治療効果が期待されています。このようにMSCさらには機能強化したLASCは、これからの再生医療にとって大きな可能性をもった細胞です。
参考文献
- Ohgushi H, Caplan AI. Stem cell technology and boice-ramics: from cell to gene engineering. J Biomed Mater Res. 1999;48(6):913-27.
- Iwashima S, Ozaki T et al. Novel culture system of mesenchymal stromal cells from human subcutaneous adipose tissue. Stem Cells Dev. 2009 May;18(4):533-43.
- Saka Y, Furuhashi K et al. Adipose-derived stromal cells cultured in a low-serum medium,but not bone marrow-derived stromal cells, impede xenoantibode production. Xenotransplantation. 2011 May-Jun;18(3):196-208.
- Furuhashi K, Tsuboi N et al. Serum-starved adipose-derived stromal cells ameliorate crescentic GN by promoting immunoregulatory macrophages. J Am Soc Nephrol. 2013 Mar;24(4):587-603.
- Mareschi K, Ferrero I et al. Expansion of mesenchymal stem cells isolated from pediatric and adult donor bone marrow. J Cell Biochem. 2006 Mar 1;97(4):744-54.
 ホーム
ホーム 患者さんへ
患者さんへ 臨床研修のご案内
臨床研修のご案内 ご紹介・専門外来
ご紹介・専門外来 医局案内
医局案内 NNFP
NNFP 研究について
研究について お問い合わせ先
お問い合わせ先 ブログ
ブログ
