研究について
生化学グループ
生化学グループの研究内容
| 糖タンパク質CD147/ベイシジンの役割 | |
| 腎臓における成長因子ミッドカインの役割 | |
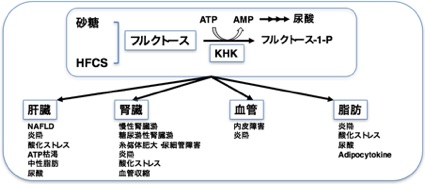
| 肥満・高血圧・糖尿病に伴う慢性腎臓病の発症・進展メカニズムの解明 | |
| エクソソームを用いた新規バイオマーカーの探索 | |
| マイクロRNAを用いた核酸医薬の開発 | |
| 糖鎖構造に着目した腎障害進展機序の探索 |
糖タンパク質CD147/ベイシジンの役割
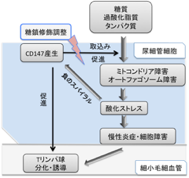
腎臓病疾患以外において、私たちはCD147が細胞の生存・増殖においてエネルギー代謝を促進する役割を担うことに注目し、食生活の変化と共に増加傾向にある生活習慣病(糖尿病・脂質代謝異常症・肥満など)の進展に関与する事を検証している。CD147を中心として疾患における臓器間の関連を分子生物学的・免疫学的に検証を行うことによって、新たな疾患機構の解明と治療法の確立につなげたい。

腎臓における成長因子ミッドカインの役割
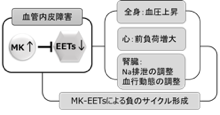

肥満・高血圧・糖尿病に伴う慢性腎臓病の発症・進展メカニズムの解明

エクソソームを用いた新規バイオマーカーの探索
エクソソームとは、ほぼ全ての細胞が放出する30-150nmの、脂質二重膜で覆われた細胞外小胞です。その由来細胞の蛋白、核酸を含むことから、特に癌領域において将来大きな可能性を持つバイオマーカーとして注目されています。しかし一方で、ほぼ全ての細胞が放出するため、血液全体からエクソソームを回収した際、腎臓で起きている微細な変化を捉えるには、どうしても感度が落ちることになってしまいます。そこで我々は、腎臓由来のエクソソームを選択的に回収する技術を開発し、新たな腎疾患のバイオマーカーとして、診断、治療効果判定、また健診での検尿異常がみられた方の二次検査として役立てる研究をしています。


血漿からビーズを用いて腎由来エクソソームを選択的に回収(中央・右)
血漿からビーズを用いて腎由来エクソソームを選択的に回収(中央・右)
マイクロRNAを用いた核酸医薬の開発
我々は、致死率が高く臨床的にも問題となっている敗血症性急性腎障害において、その発症に中心的な役割を果たすシグナルのカスケードを抑制する効果を持つマイクロRNAに注目し、適切なドラッグデリバリーシステムを用いて投与することで、障害を軽減する試みに取り組んでおり、大きな成果を得ています。今後は対象とする疾患を広げていくとともに、病態に合わせてマイクロRNAを選択するなど、プレシジョンメメディシン(精密医療)へ繋げていきたいと考えています。
糖鎖構造に着目した腎障害進展機序の探索
糖鎖の主な働きとしては細胞外のシグナル受容のためのセンサーとしての役割があり、腎障害進展に際しどのような働きをしているか明らかにすることにより、新規の腎障害治療の方策を見つけようと鋭意研究を進めています。現在、リンパ球ホーミング現象に必要なシアリル6-スルホルイス X とよばれる硫酸化糖鎖を合成する酵素であるGlcNAc6STに注目しています。この酵素はサブクラス毎に臓器分布が異なる特徴を有しているため、臓器選択性を高める事により副作用の少ない治療方略の一つとなりうる可能性を秘めていると考え、現在腎障害モデルを作成して実験を進めています。
 ホーム
ホーム 患者さんへ
患者さんへ 臨床研修のご案内
臨床研修のご案内 ご紹介・専門外来
ご紹介・専門外来 医局案内
医局案内 NNFP
NNFP 研究について
研究について お問い合わせ先
お問い合わせ先 ブログ
ブログ
