2. 分子病態解明・標的治療開発
石川裕一講師、島田和之講師、牛島洋子病院講師、中島麻梨絵助教、古川勝也病院助教、岩田哲医員
急性白血病、骨髄異形成症候群、悪性リンパ腫の病態の解明、新規治療法の開発を行っています。次世代シーケンサーを用いた網羅的遺伝子解析及び各種オミクス解析、Patient-derived xenograft(PDX:患者腫瘍細胞を異種移植したマウスモデル)の作成と解析などを通じて、患者さんの臨床像とその背景にある分子機構を明らかにし、より高い効果を持つ治療法の研究、治療薬に対する耐性化機序の解明を目指しています。また製薬企業との共同研究も積極的に行い、新たな分子標的治療薬の開発も行っています。
急性骨髄性白血病における分子層別化システムの構築(石川、牛島、岩田)
急性骨髄性白血病(AML)の発症・進展に関わる多くの遺伝子異常が同定されています。これまでに、私たちはFLT3やNPM1遺伝子異常の臨床的意義を世界に先駆け報告してきました(Blood. 1999, Blood 2001, Blood 2004, Blood 2005)。一方、AMLには複数の遺伝子変異が蓄積されていることから、網羅的な分子病態に基づいた予後層別化が必要になります。AMLの予後層別化モデルは国際的に提唱されていますが、欧米人と日本人ではAMLで認められる染色体異常、遺伝子異常の特徴や、それら分子異常の持つ臨床的意義も異なります。私たちは、日本人成人AMLにおける層別化モデルの構築を目的にした研究を継続して行っており、JALSG臨床試験に登録された症例の解析を通して日本人AMLにおける分子異常に基づいた新たな予後層別化モデルの提唱を行ってきました(Eur J Haematol 2009, Leukemia 2014, Leuk Res. 2018, Ann Hematol 2019, Blood Adv. 2020, Cancer Sci. 2020)。また、AML209GS試験に登録された1,800例を超えるAML症例での遺伝子変異解析も行っています。このように白血病の治癒を目指して、より多くの患者さんを対象に新規分子異常を含めた解析を継続し、AMLにおける分子層別化に基づいたPrecision medicineの実用化、最適化に取り組んでいます。
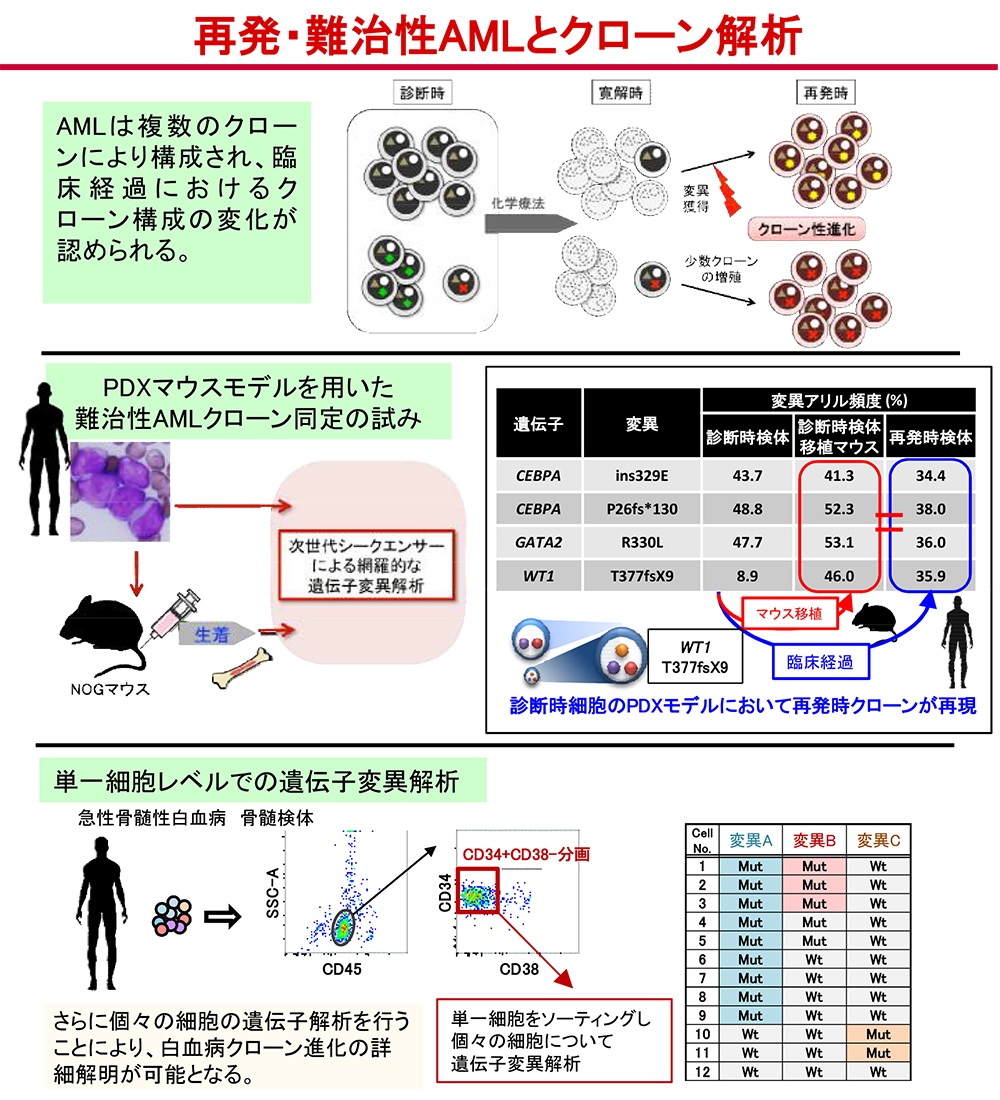
急性骨髄性白血病の発症・進展過程における分子異常とクローン進化の解明(石川、牛島、岩田)
近年の遺伝子解析技術の進歩は、AMLにおける新たな分子異常の同定のみならず、AMLの発症・進展におけるクローン進化についても新しい知見をもたらしました。私たちは、次世代シークエンス技術および、既に100種類以上樹立したPDX白血病マウスモデルを用いて、AMLの発症・進展におけるクローン進化の解明、難治性クローンの同定及びそれに関わる分子異常の解明に取り組んでいます(図1)(Nature Commun 2022, Cancer Sci 2010, Sci Rep. 2015)。特に、マルチカラーフローサイトメトリーを用いて白血病幹細胞(LSC)分画細胞を1つずつ分取するシングルセルソーティングや、他の最先端のシングルセル解析技術によって、白血病治療過程における詳細なクローン性進化の解明や治療抵抗因子の同定を行うとともに、LSC分画に対する新規治療薬の有効性の評価を行っています。また、網羅的遺伝子解析よりAMLの発症・進展に関わる分子を同定し、その生物学的意義の解明にも取り組んでいます。
加えて、近年の悪性腫瘍に対する集学的治療による生存率の改善により今後の更なる増加が予想される、二次性骨髄性腫瘍の発症機序に関する研究(Cancer Genetics 2018)や、骨髄増殖性腫瘍から急性白血病に転化する過程における分子病態の変化に関する研究も行っています。このような研究を通じて難治性白血病に関わる分子異常の解明および新規治療標的の同定を目指しています。
【図1】 PDF
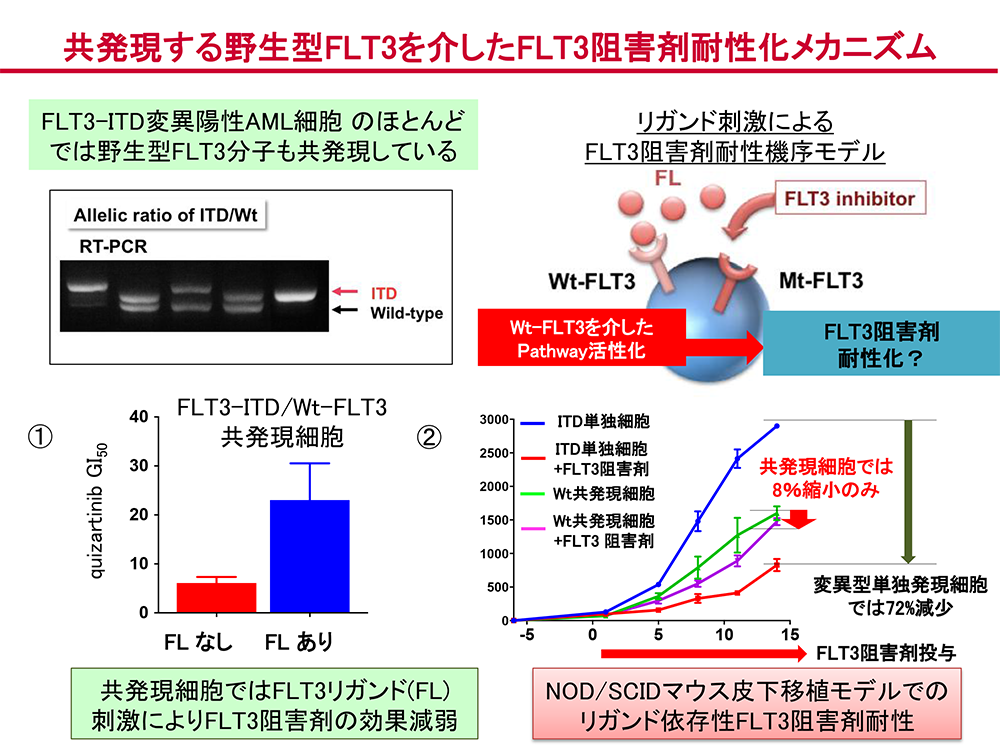
急性骨髄性白血病に対する分子標的治療薬の開発と耐性化機構の解明(石川、牛島、岩田)
当教室ではAMLに対する分子標的治療薬の開発、臨床応用に関する研究に長年携わっています。中でもFLT3阻害剤を初めとするチロシンキナーゼ阻害剤の開発および作用機序に関する研究を精力的に行っています。これまでに、製薬企業と共同でFI-700(Clin Cancer Res 2007)、KW-2449(Blood 2009)、KI-328(Int J Hematol 2010)、FF-10101(Blood 2018)などの新規化合物を導出し、KW-2449、FF-10101については、FLT3阻害剤としての臨床試験を実施しています。
分子標的治療薬の臨床応用によって、白血病の治療成績の向上が期待されますが、一般の抗がん剤と異なるような耐性機構の存在が明らかになってきています。しかし、その詳細は十分に解明されていません。私たちはFLT3阻害剤の耐性化に、白血病細胞に変異型FLT3分子とともに発現する野生型FLT3分子に対するFLT3リガンド(FL)刺激が関わっていることを見いだしました(Oncotarget 2016)(図2)。この研究では、FL添加による野生型FLT3分子の活性化により、その下流経路MAPキナーゼの経路の活性化が生じ、FLT3阻害剤とMAPキナーゼ阻害剤との併用および野生型FLT3分子の細胞膜上への移行を阻害する糖鎖修飾阻害剤の併用により、この耐性化機序を克服できることを明らかにしました。現在、これらの結果をもとに、薬剤スクリーニングより見出した新規治療薬の有効性について検討を行っています。このほかにも、造血器腫瘍に対する標的阻害剤の耐性機構に関する臨床的、基礎的研究を進めています(Blood 2009, Blood 2011, Oncotarget 2017, PLoS One 2018)。 これら新規薬剤、治療法の開発研究には細胞株のみならず、患者さん由来の細胞および、それらより樹立したPDXマウスモデルを積極的に利用し、生体内における薬剤有効性の評価、治療後の残存細胞の特性、耐性化機序の獲得機構についてシングルセルレベルでの解析も含めた検討を行っています。
【図2】 PDF
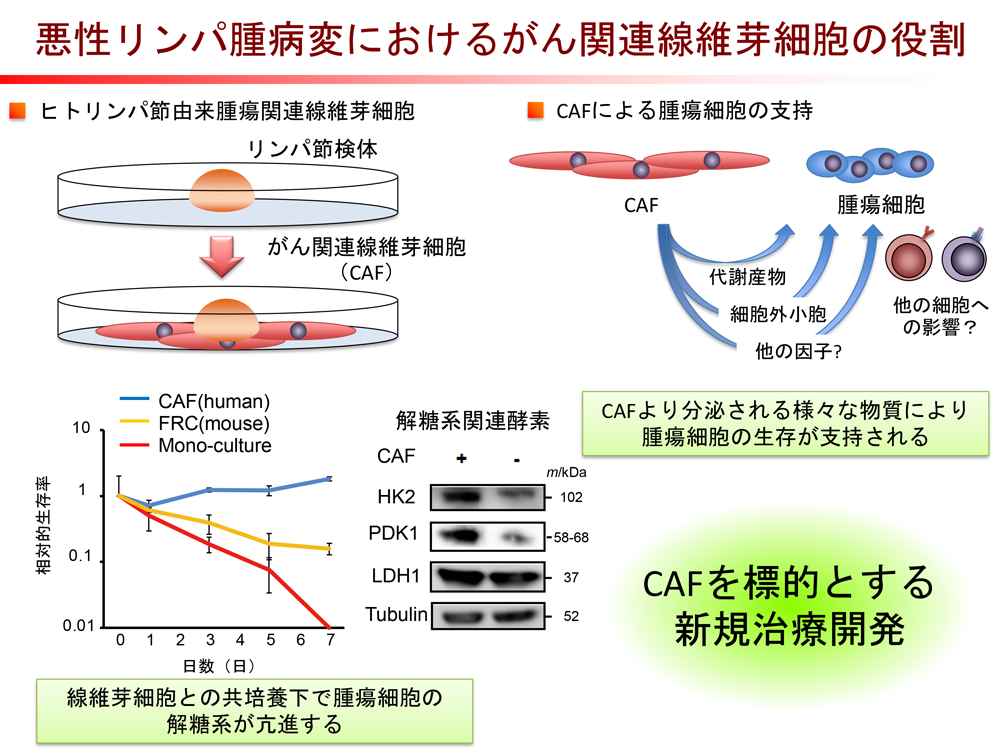
PDXモデルを用いた悪性リンパ腫の病態解明と新規治療法の開発(島田、古川)
悪性リンパ腫には様々な病型があり、WHO分類(2017)では、80を超える病型が収載されています。私たちは、その中でも中枢神経、精巣や血管内に病変を形成する悪性リンパ腫に着目して研究を進めています。特に血管内に病変を形成する血管内大細胞型B細胞リンパ腫は、以前は診断が非常に困難で、予後不良な悪性リンパ腫の代表的な病型でしたが、近年の疾患の認知度の向上と抗CD20抗体医薬併用化学療法と中枢神経指向治療を組み合わせることにより治療成績が向上してきました(J Clin Oncol 2008、Lancet Oncol 2009、2020)。しかし、なぜ「血管内に腫瘍細胞が増殖するのか」という根源的な疑問に関しては、未だ答えが得られていません。私たちは、血管内大細胞型B細胞リンパ腫の患者さんの腫瘍細胞から樹立したPDXモデルにおいて、病気の特徴が再現されることに着目し、血管内大細胞型B細胞リンパ腫の生物学的特徴を明らかにし(Leukemia 2016)、さらに国内外の他施設の研究者とも協力して、血管内大細胞型B細胞リンパ腫には免疫回避関連遺伝子の異常を高率に伴うことを明らかにしています(Blood 2021)。
また、悪性リンパ腫は通常リンパ節に病変を形成しますが、私たちは悪性リンパ腫のリンパ節病変からがん関連線維芽細胞が単離できることに着目し、その役割についての検討を進めています。現在までに、がん関連線維芽細胞が腫瘍細胞の糖代謝を亢進させることで、腫瘍細胞の生存・維持に関与していることを明らかにし(Oncotarget 2017)、その一端において、がん関連線維芽細胞より分泌されるピルビン酸が関与していることを明らかにしました(Cancer Sci 2019)(図3)。さらに、がん関連線維芽細胞から分泌される細胞外小胞に含まれるマイクロRNAが、腫瘍細胞の細胞膜上にある抗がん剤の輸送体タンパクの発現を抑制することにより、抗がん剤の腫瘍細胞への取り込みを阻害し、抗がん剤の耐性化に寄与することを明らかにしています(Oncogene 2021)。
【図3】 PDF