3. 免疫細胞療法開発
寺倉精太郎講師、葉名尻良助教
同種造血幹細胞移植後に発症する移植片対宿主病(GVHD)など移植後合併症の克服、移植片対腫瘍(GVT)効果を高めることによる再発抑制、キメラ抗原受容体(CAR)など遺伝子導入T細胞療法の開発などを目指した基礎研究に取り組んでいます。また、間葉系幹細胞を用いた移植や、骨髄破壊的移植前治療としてG-CSFを併用する臍帯血移植などの臨床研究に取り組んでいます。
遺伝子導入T細胞療法の開発研究(寺倉)
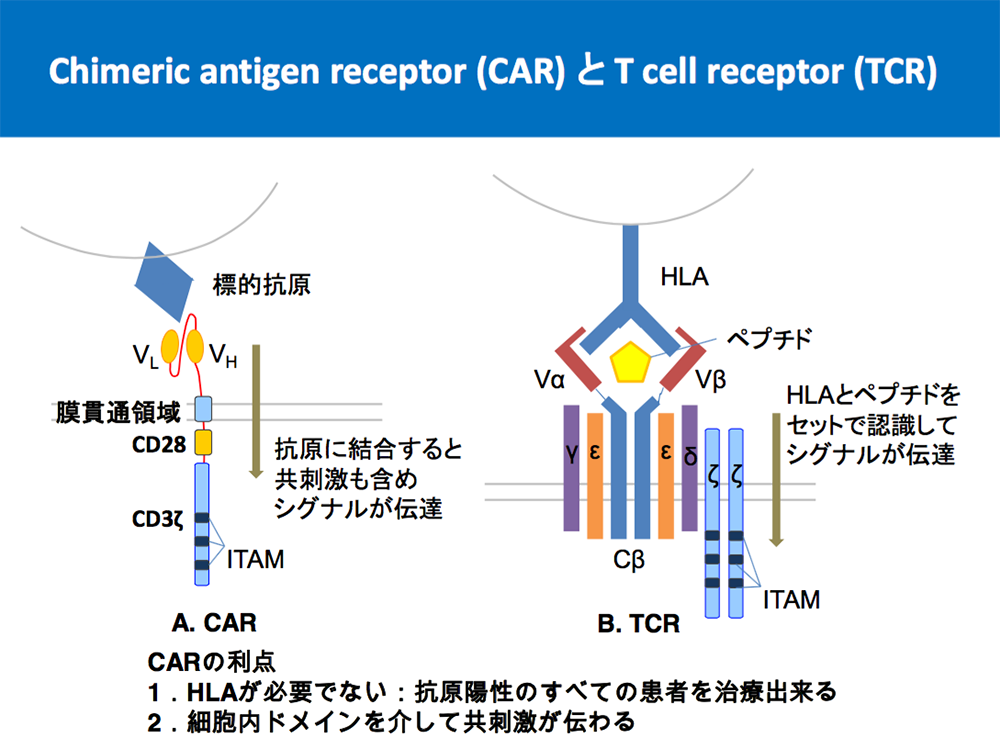
CAR遺伝子を導入したT細胞(CAR-T細胞)は、CD19を標的としたCD19CAR-T細胞が臨床応用され、非常に高い効果が得られることが分かってきました。CD19CAR-TはCD19に対する抗体を遺伝子導入によってT細胞に発現させ、CD19陽性細胞に対してのみ特異的に結合・傷害するようにさせた細胞です(図5)。私たちはこの技術にさらに工夫を加え、応用発展させる研究を行っています。例えばCD19同様にリンパ腫などに発現しているCD20やCD37に対して特異性を持たせるCD20CAR-TやCD37CAR-Tを開発し(J Immunol 2015, J Immunol 2021)、さらには患者さんの体内でCAR-T細胞がより長く効くようになるための新規細胞内ドメインの開発を行っています(Molecular Therapy 2021)。腫瘍特異的抗原に対するT細胞レセプター遺伝子を遺伝子導入する、TCR−T細胞療法の研究にも併せて取り組んでいます(Cancer Immunol Res 2018, Molecular Therapy-Oncolytics 2020)。固形がん特異的な抗原に対するCAR-Tの開発も開始しています。
【図4】 PDF
T細胞イムノメタボリズムに着目した新規養子免疫療法の開発研究(葉名尻)
悪性腫瘍に対する養子免疫療法は、CD19抗原を標的としたキメラ抗原受容体遺伝子導入T細胞(CAR-T細胞)療法がB細胞性腫瘍に著効を示していますが、他の悪性腫瘍、特に固形腫瘍に対しては顕著な有効性が示されていません。輸注したT細胞が持続的な抗腫瘍効果を発揮するためには、①T細胞が慢性的な抗原刺激でも疲弊状態に陥らず、かつ②長期間に渡って腫瘍微小環境内で生存することが重要であることが分かってきました。したがって、腫瘍微小環境においても、機能低下が引き起こされず、抗腫瘍効果を発揮する新規養子免疫療法の開発が求められています。近年、CAR-T細胞においてはシグナル伝達ドメインを改変することにより、代謝リプログラミングを人為的に誘導することが可能であることが分かってきました。そこで、T細胞代謝リプログラミングが起こる機序を明らかにし、腫瘍微小環境でも有効な新規免疫療法の開発を目的とした研究に取り組んでいます。

