腫瘍生物学では、疾患発症に関わる遺伝子の制御異常のうちエピゲノム、特に長鎖非翻訳RNAに焦点を絞り、その基礎研究を行うとともに診断・治療法への応用を目指しています。
エピゲノム異常は細胞の分化・増殖の制御異常を介して、がんや神経疾患など様々な疾患発症の原因となります。例えばがんは日本人の死亡原因の一位であり、その克服は重要な課題です。エピゲノム異常は、発がんを誘導し、周囲環境に応じてがん細胞の性格を多彩に変化させ、悪性のがんとしての形質を獲得する過程に関与しています。
エピゲノム異常の理解を深めることは有効ながん医療を生み出す手がかりとなり、エピゲノム異常の正常化もしくは制御をめざすことで新しい治療法を開発できると考えます。国内外の研究者と分野を超えて有機的な共同研究を行っており、その成果を臨床教室と共有してさらに練り上げることで実践的な応用を試みています。
2024年から難治性腫瘍であるグリオブラストーマに対して、がんの成長に必須な長鎖非翻訳RNAであるTUG1を標的とした治療薬の医師主導治験を開始しました。
私たちは、疾患の基礎医学研究を実践することで、次世代の医療に貢献することを目指します。各疾患の治療戦略を組み立てていく上で、分子生物学的な理解とその分子基盤に基づく診断・治療法の確立は、新しい有効な医療の開発に欠かせません。
私たちは様々な疾患の病態に関わる基礎研究を行っていますが、特にがんについての研究に注力しています。私たちの研究しているエピゲノム異常は、ほとんどすべてのがん細胞に存在するため、診断マーカーとしての有用性が高いと考えます。特にエピゲノムのうちDNAメチル化は安定した化学修飾であり、ヒト遺伝子の広範な領域でがん細胞に特異的な異常が検出されるため診断マーカーとして優れています。私たちはこの特性を活かしてがん診断マーカーの開発を行うとともに、微量に存在するDNAメチル化異常を高感度かつ簡便に解析できる新しい検出法の開発を行ってきました。一方、長鎖非翻訳RNAやエピゲノム異常を標的とした治療薬は、これまでの分子標的薬と異なる作用機序をもった新しいクラスのがん治療薬として期待されています。実際に現在世界規模でそのような新規治療薬の開発が加速度的に進んでいます。私たちの研究室でもがんエピゲノムを詳細に研究し、外部研究者との共同研究を通じて積極的に治療薬の開発を試みています。
がんに特異的なエピゲノム異常を“早期”に“確実”に捉えて診断に活用し、エピゲノム治療薬でがんの急所を抑える事ができれば、新たながん治療戦略を展開できると考えます。
私たちの体を作っている細胞は、一つの受精卵が巧みに遺伝子(設計図)を使い(読み)分け、分裂を繰り返した後に、ある細胞は皮膚を作り、ある細胞は骨を作っていきます。このように遺伝子の使い方を決める仕組みを“エピジェネティクス”と言います。エピジェネティクスの概念は、ワトソン博士とクリック博士によるDNA二重らせんモデル(1953年)よりも早い1942年に、ワディントン博士によって、“causal mechanisms by which the genes of the genotype bring about phenotypic effects”として提唱されました。エピジェネティクスにはぴったりとした日本語訳がないため、片仮名表記されることがほとんどです。中国では「表現遺伝学」と表記されるようで、むしろこちらのほうがわかりやすいかもしれません。
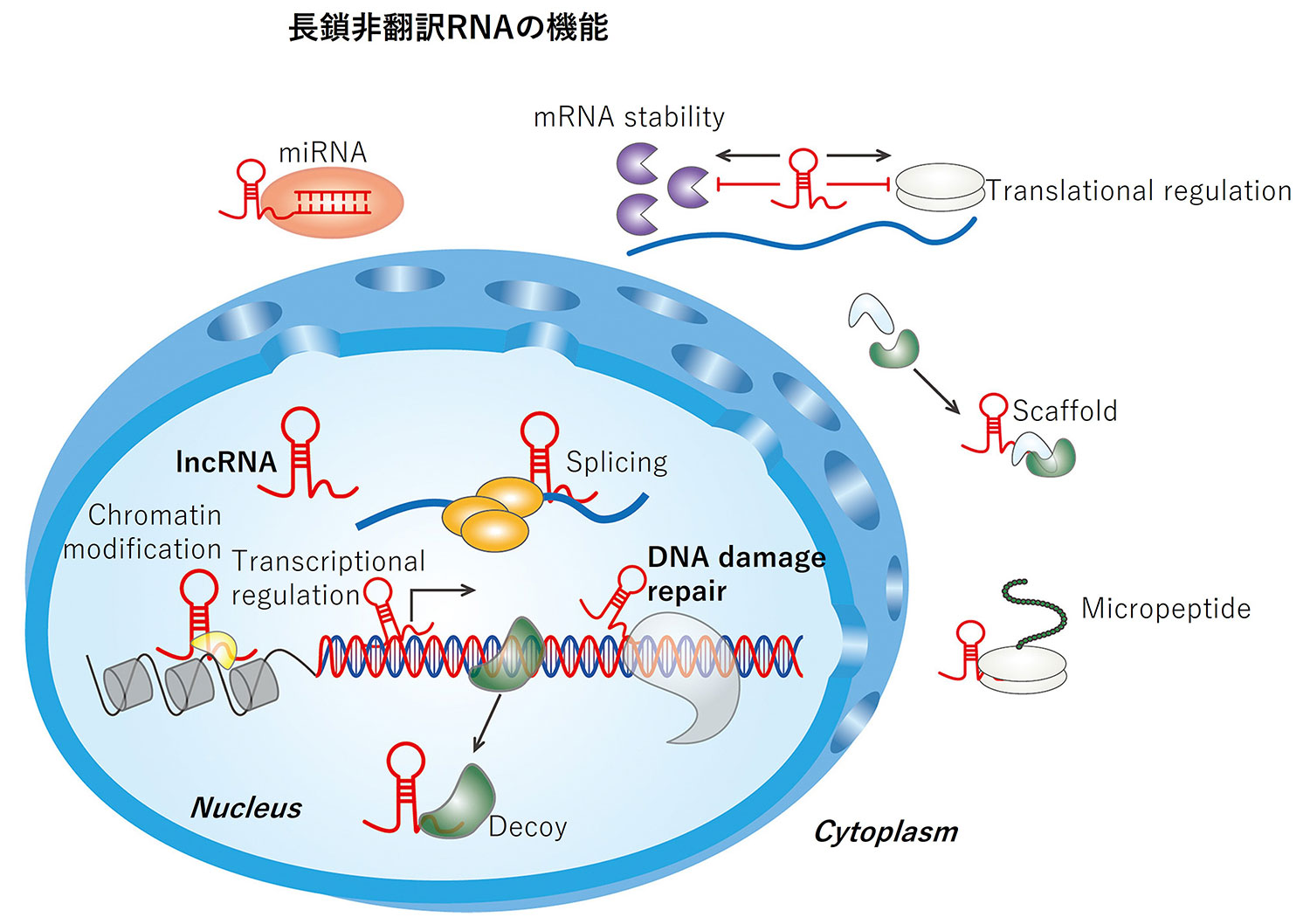
DNAの配列には、タンパク質に翻訳されない非翻訳RNAを転写する領域が大部分を占めています。そのうち長鎖非翻訳RNAは、非翻訳RNAのうち200塩基対以上のものを指します。細胞の中でタンパク質と相互作用し、細胞核内では転写因子やスプライシングやクロマチン構造の維持、細胞質内ではマイクロRNA等他のクラスのRNAの機能調節に関与することがわかってきました。私たちはこれまでがん細胞で長鎖非翻訳RNAが様々な分子機構を介して可塑性の高いがん細胞の維持・制御に関わることを研究してきました。
クロマチン構造、ヒストン修飾、DNAメチル化、非翻訳RNA等のエピジェネティクスを規定する因子はエピゲノムと呼ばれ、通常は緻密に制御されています。しかし加齢や環境物質に曝露すると、その制御機構に化学的な傷がつきます(エピゲノム異常)。さらにエピゲノム異常が積み重なると、細胞ががん化すると考えられています。実際にがん細胞を調べてみると、ほとんどすべてのがん細胞からエピゲノム異常が検出され、がんの早期から進んだがんまでその病態に影響を与えています。
しかし、すべてのがん細胞からエピゲノム異常が検出されるということは、エピゲノム異常の検出は、がん早期診断への応用が期待できるということにもつながります。さらにエピゲノム異常は、「遺伝子変異」とは異なり、薬で元に戻る可能性が高いことがわかっているので、がん細胞でエピジェネティクスの正常化を目指せば、新しいがん治療につながります。
私たちはがん細胞のエピジェネティクス異常を深く探求し、がんの診断に役立てる研究、さらに異常なエピジェネティクスを正常化させる新しいがん治療薬の開発に取り組んでいます。こうした取り組みから、発がんのメカニズムを解明することに加えて、実際のがん医療への応用を目指したがん研究を試みています。
これまでがん細胞での長鎖非翻訳RNAの働きを10年以上にわたり研究してきましたが、2024年から難治性腫瘍であるグリオブラストーマに対して、がんの成長に必須な長鎖非翻訳RNAであるTUG1を標的とした治療薬の医師主導治験を開始しました。
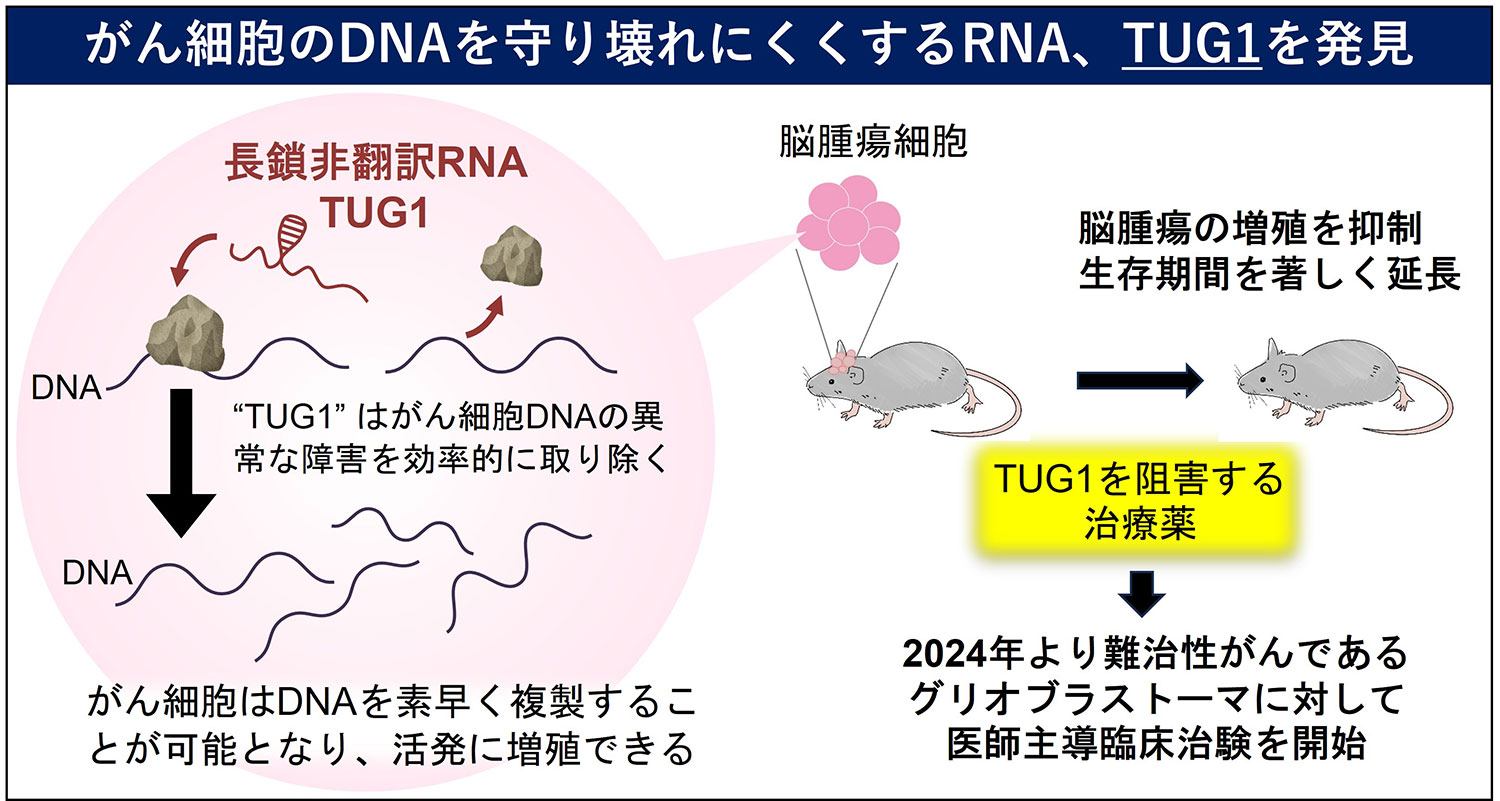
がん細胞は活発に分裂し増殖するため、非常に速くDNAをコピーする必要があります。しかしがん細胞は正常な細胞と比べてDNAの変異や異常などの障害が多く、DNAのコピー(複製)がうまくできずに止まってしまうことがしばしばあります。これまで、がん細胞がどのようにDNAの異常を解消し、すばやくコピーを続けていくのかは必ずしもよくわかっていませんでした。
私たちは、DNAの複製に問題が生じたときに、細胞内で速やかにつくられる長鎖非翻訳RNA、TUG1(Taurine Upregulated Gene 1)を発見しました。TUG1はDNAの複製を止めてしまうようなDNAの異常な構造をがん細胞で解消する働きをもつことがわかりました。この働きはがん細胞の生存には必須の機序であり、実際にTUG1が高発現するグリオブラストーマ(脳腫瘍)でアンチセンスオリゴ(TUG1-ASO)を用いてTUG1を阻害すると、DNA複製が止まり、細胞死が誘導されました。そこでTUG1-ASOを腫瘍部に効果的に届けることができるデリバリーシステムと組み合わせた治療薬(antiTUG1製剤)を東京大学との共同研究で開発しました。脳腫瘍マウスモデルをantiTUG1製剤で治療するとグリオブラストーマは著しく縮小し、生存期間が劇的に改善しました。さらに標準治療薬テモゾロミドと併用治療を行うと、相乗的に抗腫瘍効果を発揮することがわかりました。
実臨床におけるantiTUG1製剤のグリオブラストーマに対する有効性を検討するため、2024年2月より名古屋大学医学部附属病院、国立がん研究センター、京都大学医学部附属病院で医師主導臨床治験を実施しています。
 Suzuki and Iijima et al., Nature Communications 2023
Suzuki and Iijima et al., Nature Communications 2023
プレスリリースはこちら
また私たちはTUG1以外にも、脳の発生や疾患発症などに関わる様々な機能を持った長鎖非翻訳RNAについて研究を進めています。実際に脳の高次構造の形成や神経精神疾患の発症、免疫調節脳、さらに細胞遊走のシグナル伝達に関わる長鎖非翻訳RNAも同定しており、今後新しい疾患バイオロジーの展開が期待できます。
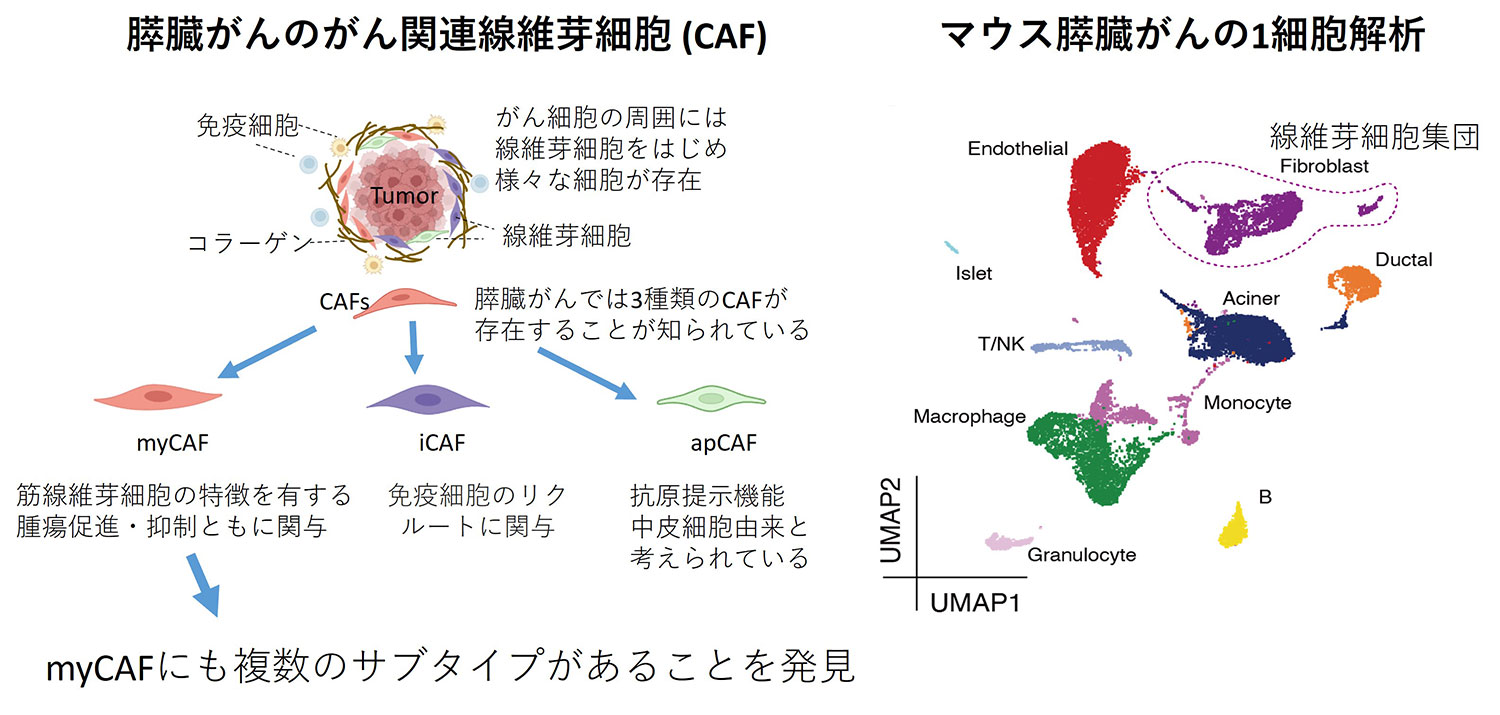
線維芽細胞は皮膚をはじめとして、多くの臓器に存在する細胞です。膵臓がんでは間質が豊富であり、その中に線維芽細胞が増生していることが知られています。がん組織に存在する線維芽細胞はがん関連線維芽細胞(CAF)と呼ばれ、がんの悪性化や治療抵抗性に関わり質が異なるCAFが存在することがこれまで報告されています。
膵臓がんはがん細胞の周囲を多数のCAFに囲まれており、CAFの性格が膵臓がんの病態に影響をあたえることがわかってきました。そこで膵臓がんにおけるCAFの詳細を研究するため、膵臓がんを発症するマウスを用いて、膵臓がんのがんと間質の発現およびエピゲノム解析を1細胞レベルで行いました。解析の結果、myCAFは単一の集団ではなく、複数のサブタイプがあり、特に膵臓がんの進行に従ってその性格が変化していくことがわかりました。さらにmyCAFのうち、膵臓がん細胞の進展を促進するタンパク質を同定し、そのタンパク質をノックアウトしたマウスでは膵臓がんの増殖が遅くなることもわかりました。膵臓がんの治療において、間質の細胞を標的とした治療法も効果がある可能性があります。
線維芽細胞の異常が原因として考えられている皮膚疾患のケロイドについても研究を行っています。
卵巣に病変を形成する子宮内膜症は、生殖年齢女性の約10%が罹患し、骨盤痛、不妊症、がん化など様々な問題を引き起こす疾患で、その疾患発症メカニズムは、月経血が子宮内から卵管を介して腹腔内に逆流することが一要素として考えられています。現時点での子宮内膜症の治療法はホルモン剤内服による偽閉経療法や手術療法での病巣切除ですが、どちらの治療も薬剤の副作用や術後の高い再発率などが問題となっています。またどちらの治療法も妊娠に与える影響が大きく、妊娠希望の女性にとって安全に使用できる非ホルモン性の新規治療戦略が望まれています。
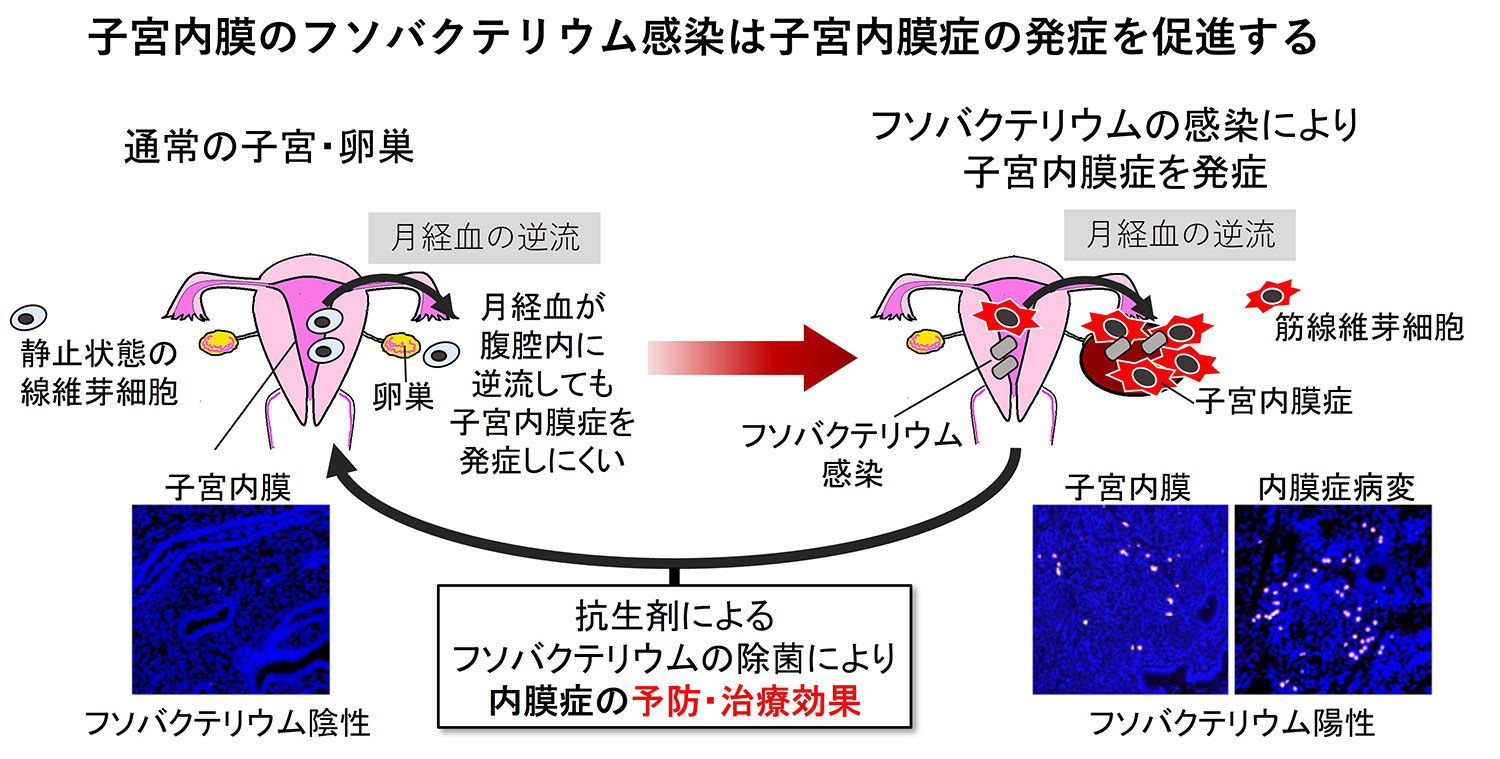
子宮内膜症病変部の線維芽細胞の遺伝子発現プロファイルをシングルセルレベルで解析した結果、子宮内膜症病変部の線維芽細胞でTransgelin (TAGLN)の発現が顕著に上昇していました。TAGLN陽性の線維芽細胞は子宮内膜症の発症に関わる増殖、遊走、腹膜中皮細胞への接着を亢進させる筋線維芽細胞の性質を示します。この線維芽細胞への分化誘導因子として、子宮内膜に浸潤するマクロファージが増加しTGF-βを産生していることに注目しました。そこで子宮内膜の細菌叢を解析した結果、子宮内膜症患者の子宮内膜ではフソバクテリウム(以下Fuso)感染が高頻度であることを見つけました。Fusoは口腔内や腸管内にも存在し、大腸がんの発症に関与する菌体として知られています。内膜症モデルマウスを用いて検証した結果、Fusoを感染させると、内膜症病変形成の個数及び重量が増悪し、さらに子宮内膜症を形成後に、Fusoに感受性のある抗生剤で除菌を行うと病変形成が改善することがわかりました。本研究成果から子宮内膜症の新たな治療法を提案する可能性が期待できます。また子宮内膜症は一部の卵巣がんの前がん病変と考えられていることや、Fusoが感染した組織ではがん細胞に対する免疫能が低下していることから、卵巣周囲組織でのFusoの慢性的な感染が卵巣がん発症に与える影響について研究を進めています。
名古屋大学大学院医学系研究科・医学部医学科
腫瘍病態学 腫瘍生物学(分子病態)
医系研究棟2号館 5F
近藤 豊
〒466-8550 名古屋市昭和区鶴舞町65番地
TEL 052-741-2111(代表)