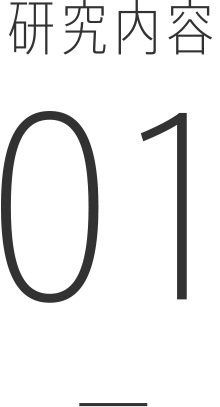がんの間質(=上皮細胞以外の領域)にはがん関連線維芽細胞(CAF; cancer-associated
fibroblasts)が増生し、特に膵がんをはじめとした高悪性度のがんではその傾向が顕著です。また加齢、組織損傷・治癒、あるいは慢性炎症に伴う多くの臓器の機能低下も間質の線維芽細胞の増加(線維化)が鍵を握っています。近年、このような間質に増生する線維芽細胞には機能多様性があることがわかってきました(総説:
Kobayashi et al., Nat Rev Gastroenterol Hepatol 16:282-295, 2019; Ando et al., Cancers 14:3315, 2022; Shiraki
et al., Nagoya J Med Sci 84:484-496,
2022)。最近、私達は、がんの抑制、損傷組織の修復、および線維化の抑制において重要な働きをする線維芽細胞のマーカーとしてMeflinを同定しました。Meflin陽性CAFは膵がんを抑制する機能を有すること(Mizutani
et al., Cancer Res 79:5367-5381, 2019; Miyai et al. Cancer Sci 111:1047-1057,
2020)(図3)、および肺がんにおいて免疫チェックポイント阻害薬の効果を増強すること(Miyai et al., Life Sci Alliance 5:e202101230, 2022;
榎本ら, 実験医学 2022年10月号 40(16):2580-2586, 2022)を明らかにしてきました。
また、Meflinは心筋虚血をはじめとする組織障害時の修復に重要であることもわかってきました(Hara et al., Circ Res 125:414-430,
2019)(図4)。加えて、Meflin遺伝子の欠損マウスに心不全を誘導すると、心臓の硬化を特徴とする心不全の一型(HFpEF;
左室駆出率の保たれた心不全あるいは拡張性心不全)を発症することが判明しています(Hara et al.,
2019)。今後は様々な病態における線維芽細胞および間質の多様性とその意義についてさらに多くの分子に着目して解明をすすめるとともに(stromal
biology)、新規治療法の開発に向けた研究もすすめたいと考えています。
図3
膵がんにおけるMeflin陽性線維芽細胞(赤)と平滑筋アクチン陽性線維芽細胞(緑)
図4
マウス心筋梗塞部位において増殖するMeflin陽性線維芽細胞(レポーターマウス)