病態外科学消化器外科学
研究室概要
世界に通用する、優れた外科医を育成する
教室では、臨床においては教室伝統のがん手術の基本を忠実に受け継ぎつつ、機能温存・低侵襲手術から拡大根治手術に至るまで最新の外科治療を行っています。研究においてはがん遺伝子解析、抗がん剤感受性試験、ウイルス療法などがん治療の新たな可能性に向けて積極的に研究を行い、また豊富な臨床経験と最新の知見を持ち合わせた次世代を担う外科医の育成も目指しています。
全国的な外科医の減少傾向は社会問題に発展しておりますが、当教室では行政に先駆けて、若手外科医の修練環境の改善や女性医師の長期労働環境の整備を行っています。
また、若い医師に外科の魅力・やりがいを伝えるべく、努力しております。外科医は手術手技のみならず、多岐にわたる知識や技術と、重症患者およびその家族と協力して疾患に立ち向かう優れた人格が要求されます。その責任の重さゆえに味わえる充実感を、知識や技術とともにこれからの医療を担っていく若手医師に伝えていきたいと考えています。
当教室では各関連病院と密に連携し、まずは卒後6年目の外科学会専門医取得を前提とした、偏りのない総合的な臨床能力の育成を重視します。その後、卒後8年目に消化器外科学会専門医が取得できるよう多くの症例が経験できる環境を用意します。また、偏らない視野の広い外科医を育成すべく、なるべく多くの指導医から指導を受けられる修練環境の整備を心がけています。これらを礎とし、大学院医学研究科でのさらなる専門性の追求と、国内外へと発信する基礎・臨床研究につなげていきます。
高度な最先端の医療を実践しつつ、先人達から受け継いだ外科の伝統を融合させて「世界に通用する、優れた外科医を育成する」ことが、教室全体の目標であります。
研究プロジェクト
1. 食道グループ
- Tumor budding と食道扁平上皮癌に関する研究
- 食道癌に対する低侵襲手術(2領域郭清、胸腔内胃管吻合再建)
- 胃管再建不能食道癌症例に対する、有茎空腸再建手術
- 臨床病期 IB/II/III 食道癌(T4 を除く)に対する術前 CF 療法/術前 DCF 療法/ 術前 CF-RT 療法の第 III 相比較試験(JCOG1109)
- 術後管理法に関する新たな工夫(新たな腸瘻造設法・新たな胸腔ドレーン管理法等)
2. 胃グループ
- 新規胃癌腹膜播種特異的分子標的治療薬の開発
腹膜播種は胃癌で高頻度かつ難治な転移再発様式です。当教室では、腹膜播種形成に特異的に関与する新規分子を同定し、これを標的とした腹腔内治療の開発を目指しています。マウス腹膜播種モデルでは、下図のように腹腔内治療群で著明な播種巣抑制効果を示しています。この治療法を実用化すべく、さらなる研究を行っています。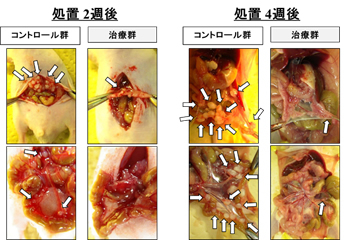
- 転移形式別Transcriptome解析による胃癌肝転移特異的バイオマーカーの研究
肝転移に代表する胃癌の血行性転移は多くの分子が関与する多段階の過程を経て形成されることが知られていますが、その中には転移経路に特異的な分子が存在すると考えています。そこで、肝転移・再発をきたした症例に特異的に発現異常を認める分子を網羅的発現解析から同定し、その胃癌肝転移診断・予測バイオマーカーとしての有用性を研究しています。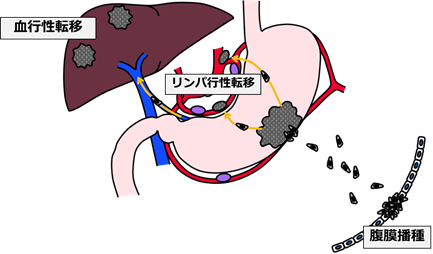
- ICGによる新しい早期胃癌マーキング法の研究
- 胃癌手術における高齢者機能評価に関する研究
- 内視鏡手術シミュレーション訓練の新しい統合的基本タスク作成
- 手術時における術者の疲労、ストレスの客観的測定法の研究
- 腹膜播種を伴う胃癌に対する腹腔内化学療法の開発
腹膜播種は胃癌の中で最も頻度の高い進行再発形式です。近年、腹膜播種に対する腹腔内化学療法の治療効果が報告されています。抗癌剤を腹腔内に投与する方法は、直接的な抗腫瘍効果が大きな利点であり、従来の全身化学療法と併用することで治療成績を改善することが期待されます。当科は腹腔内化学療法研究会の参加施設であり、先進医療下の臨床試験として多施設共同試験に参加、および主たる研究機関として腹腔内化学療法の確立を目指しています。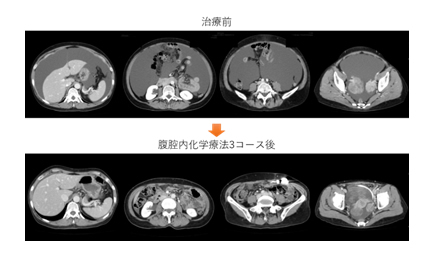
- 実臨床における胃癌化学療法バイオマーカーの探索的研究
胃癌化学療法における二次治療の一つであるnab-paclitaxel療法のバイオマーカーとしてSPARC(secreted protein acidic and rich in cysteine)に着目し、治療効果とSPARC発現との関連を研究しています。SPARCは細胞間質における非構造性のマトリックス糖蛋白で胃癌でも高頻度に高発現していることが報告されており、アルブミン親和性が高いことが知られています。paclitaxelとヒト血清アルブミンを結合させたnab-paclitaxelの腫瘍内への集積は,SPARCが媒介していると考えられていることから,SPARC発現とnab-paclitaxelの有効性の検討を行っています。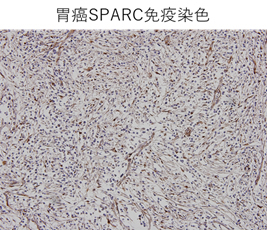
3. 肝臓グループ
- エピジェネティクスにより制御される肝細胞癌関連遺伝子の同定と機能解析
- 肝疾患における肝血流動態解析
- 周術期全身超音波診断法の臨床研究
Point-of-care ultrasonogrphy(POCUS)の概念が提唱され、欧米では急速に臨床応用が広がっている。当研究室ではPOCUSの周術期管理への応用につき検討しています。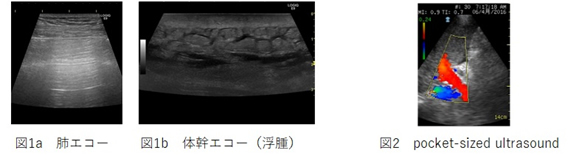
- 超音波ナビゲーション装置を用いた肝切除法の開発
4. 膵臓グループ
- 局所進行膵癌における術前治療(S-1併用放射線療法など)
- 術後合併症軽減をめざした新たな外科手技の導入(Blumgart変法など)
- 膵頭部癌に対する膵頭十二指腸切除術における上腸間膜動脈周囲神経叢右半周郭清に関するランダム化第Ⅱ相試験
- Borderline resectable膵癌に対するFOLFIRINOXまたはnab-paclitaxel + gemcitabine術前補助化学療法のランダム化第II相試験
- 膵体尾部切除での膵実質切断における脾静脈剥離-個別処理と脾静脈同時切断の多施設共同無作為化比較第Ⅲ相試験- COSMOS-DP trial–
- 局所進行切除不能膵癌に対するゲムシタビンおよびnabパクリタキセル併用化学放射線療法の第I相臨床試験Nagoya University Pancreatic Tumor Board trial 02(NUPAT-02)
- 腹膜転移を有する膵癌に対するGemcitabine (GEM) +nab-Paclitaxel (PTX)+ PTX腹腔内投与併用療法の第I/II相多施設共同臨床試験
- 膵癌切除後の腹膜再発(ゲムシタビンとフッ化ピリミジン系抗癌剤不応)に対するパクリタキセル経静脈・腹腔内併用療法の治療効果を検証するための第I/Ⅱ相臨床試験
- 膵癌における補助化学療法の個別化に向けた取り組み
- 膵腫瘍における新規予後因子発見に関する探索的研究
- 膵癌における癌浸潤・転移メカニズムの解明(上皮間葉転換など)
5. 大腸グループ
- High-risk Stage Ⅱ / Stage Ⅲ 大腸癌術後補助化学療法としてのCapeOX 療法におけるオキサリプラチン間欠投与と継続投与の有効性と安全性を評価する無作為化第Ⅱ相臨床試験(CCOG1302)
- RAS 遺伝子野生型潜在的切除可能進行再発大腸癌に対する切除を目指した治療戦略において、Panitumumab + mFOLFOX 6 療法の早期腫瘍縮小効果について検討し、本レジメンでのR0切除率との関連を検索する多施設共同観察研究(CCOG1401)
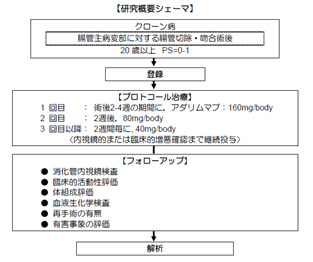
- クローン病術後抗TNF-α抗体維持療法の有効性と安全性に関する検討
- 進行再発大腸癌に対する化学療法における新たなsurrogate markerの開発
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 神田 光郎 | 教授 | 消化器外科学 |
| 田中 千恵 | 病院准教授 | 医療機器総合管理部 |
| 林 真路 | 講師・医局長(副) | 消化器外科学 |
| 服部 憲史 | 病院講師 | 消化器外科学 |
| 髙見 秀樹 | 病院講師 | 卒後臨床研修・キャリア形成支援センター |
| 清水 大 | 病院講師・医局長 | 消化器外科学 |
| 佐藤 雄介 | 病院講師 | 消化器外科学 |
| 田中 晴祥 | 病院講師 | 消化器外科学 |
| 中西 香企 | 病院講師 | メディカルxRセンター |
| 梅田 晋一 | 助教 | 消化器外科学 |
| 栗本 景介 | 病院助教 | 先端医療開発部 |
| 中川 暢彦 | 病院助教 | 消化器外科学 |
| 飯塚 彬光 | 病院助教 | 消化器外科学 |
研究実績
- 2025 (Clinical) 年
- Tanaka, H. Sakai, A . Suenaga, M. Hayashi, M. Otsu, T. Nakagawa, N. Kurimoto, K. Fukasawa, M. Shibuya, K. Watanabe, N. Sunagawa, M. Yamaguchi, J. Mizuno, T. Kokuryo, T. Takami, H. Ebata, T. Fujii, T. Kodera, Y.
FUT2 and FUT3-specific normalization of DUPAN-2 and carbohydrate antigen 19-9 in preoperative therapy for pancreatic cancer: multicentre retrospective study (GEMINI-PC-01). BRITISH JOURNAL OF SURGERY. 2025 112 (4): 1-4 - Kawakami, H. Nakanishi, K. Makiyama, A. Konishi, H. Morita, S. Narita, Y. Sugimoto, N. Minashi, K. Imano, M. Inamoto, R. Kodera, Y. Kume, H. Yamaguchi, K. Hashimoto, W. Muro, K.
Real-world effectiveness and safety of trastuzumab-deruxtecan in Japanese patients with HER2-positive advanced gastric cancer (EN-DEAVOR study). GASTRIC CANCER. 2025 28 (1): 51-61 - Mori, K. Tanaka, H. Kimura, N. Fukasawa, M. Itoh, A. Shirai, Y. Shibuya, K. Nagaoka, K. Yamamoto, Y. Fujii, T.
Significance of self-expandable metallic stent for postoperative intra-abdominal infection after pancreatoduodenectomy in patients with a hard pancreas. ANNALS OF GASTROENTEROLOGICAL SURGERY. 2025 DEC. - Umeda, S. Nakayama, G. Kishida, T. Hattori, N. Nakanishi, K. Tanaka, H. Shimizu, D. Takami, H. Hayashi, M. Kanda, M. Tanaka, C. Kodera, Y.
Efficacy and safety of postoperative adjuvant chemotherapy with oxaliplatin for elderly patients: results from the CCOG-1302 study. INTERNATIONAL JOURNAL OF CLINICAL ONCOLOGY. 2025 30 (6):1174-1182 - Hoshino, N. Kanda, M. Oba, K. Aoyama, T. Honda, M. Kashiwabara, K. Maeda, H. Mayanagi, S. Muto, M. Tanaka, K. Yamagishi, H. Sakamoto, J. Obama, K. Yoshikawa, T.
Efficacy and safety of oral 5-FU-based adjuvant chemotherapy for geriatric patients with colorectal cancer: Integrated analysis of seven clinical trials conducted at the Japanese Foundation for Multidisciplinary Treatment of Cancer. COLORECTAL DISEASE. 2025 27 (11): e70317 - Hattori, N. Nakayama, G. Umeda, S. Kishida, T. Takeda, S. Ezaka, K. Tsutsuyama, M. Sakai, M. Hattori, M. Ito, T. Kanda, M. Tanaka, C. Murotani, K. Ando, M. Kodera, Y.
Phase II study of FOLFIRI with low-dose irinotecan plus ramucirumab as second-line treatment in Japanese patients with metastatic colorectal cancer (study rindo). JAPANESE JOURNAL OF CLINICAL ONCOLOGY. 2025 hyaf198
- Tanaka, H. Sakai, A . Suenaga, M. Hayashi, M. Otsu, T. Nakagawa, N. Kurimoto, K. Fukasawa, M. Shibuya, K. Watanabe, N. Sunagawa, M. Yamaguchi, J. Mizuno, T. Kokuryo, T. Takami, H. Ebata, T. Fujii, T. Kodera, Y.
- 2025 (Experimental) 年
- Tanaka, H. Fukasawa, M. Kimura, N. Mori, K. Matsui, K. Itoh, A. Hirano, K. Watanabe, T. Shirai, Y. Nagaoka, K. Shibuya, K. Yoshioka, I. Yamamoto, Y. Niimi, H. Fujii, T.
A novel melting temperature mapping method may improve the prediction of postoperative intra-abdominal infection after pancreatoduodenectomy. BRITISH JOURNAL OF SURGERY. 2025 112 (10): znaf222 - Umeda, S. Tanaka, K. Kishida, T. Hattori, N. Tanaka, H. Shimizu, D. Takami, H. Hayashi, M. Tanaka, C. Nakayama, G. Kanda, M.
Cholinergic Receptor Nicotinic Beta 2 Subunit Promotes the Peritoneal Disseminating Metastasis of Colorectal Cancer. Cancers. 2025 28; 17(15): 2485 - Ito, Y. Kanda, M. Tanaka, H. Nakamura, K. Mizuno, M. Hori, M. Kajiyama, H. Kodera, Y.
Antitumor effects of plasma-activated sodium acetate solution on gastric cancer cells. SCIENTIFIC REPORTS. 2025 15 (1): 19807 - Iizuka, A. Kanda, M. Sato, Y. Shimizu, D. Umeda, S. Tanaka, H. Hattori, N. Hayashi, M. Tanaka, C. Kodera, Y.
Association of NR0B1 with Malignant Phenotypes in Esophageal Squamous Cell Carcinoma Through Modulation of p53-Independent Cell-Cycle Regulation. ANNALS OF SURGICAL ONCOLOGY. 2025 32 (6): 4464-4475 - Agatsuma, Y. Shimizu, D. Umeda, S. Tanaka, H. Hattori, N. Hayashi, M. Kanda, M. Tanaka, C. Nakayama, G. Fujiwara, M. Kodera, Y.
FAM32A Suppression Decreases 5-Fluorouracil-induced Apoptosis and Is Associated With Poor Prognosis in Gastric Cancer. CANCER GENOMICS & PROTEOMICS. 2025 22 (1): 55-69 - Bayasgalan, T.; Kanda, M. Sato, Y. Zhu, HT. Hamrah, MH. Martinez, FEG. Shinozuka, T. Ito, Y. Sasahara, M. Shimizu, D. Umeda, S. Inokawa, Y. Hattori, N. Hayashi, M. Tanaka, C. Kodera, Y.
SPOCD1 Enhances Cancer Cell Activities and Serves as a Prognosticator in Esophageal Squamous Cell Carcinoma. CANCER GENOMICS & PROTEOMICS. 2025 22 (2): 306-325 - Martinez, FEG. Kanda, M. Sato, Y. Zhu, HT. Bayasgalan, T. Hamrah, MH. Shimizu, D. Tanaka, H. Umeda, S. Hattori, N. Hayashi, M. Tanaka, C. Nakayama, G. Kodera, Y.
The role of CST2 in the pathogenesis and prognosis of esophageal squamous cell carcinoma. CLINICAL & TRANSLATIONAL ONCOLOGY. 2025 27 (10): 3981-3992
- Tanaka, H. Fukasawa, M. Kimura, N. Mori, K. Matsui, K. Itoh, A. Hirano, K. Watanabe, T. Shirai, Y. Nagaoka, K. Shibuya, K. Yoshioka, I. Yamamoto, Y. Niimi, H. Fujii, T.
- 2024 (Clinical) 年
- Nakanishi, K. Kanda, M. Ito, S. Mochizuki, Y. Teramoto, H. Ishigure, K. Murai, T. Asada, T. Ishiyama, A. Matsushita, H. Shimizu, D. Tanaka, C. Fujiwara, M. Murotani, K. Kodera, Y.
Oncological similarities between large type 3 and type 4 tumors in. patients with resectable gastric cancer: a propensity score-matched. analysis of a multi-institutional dataset. GASTRIC CANCER. 2024 27: 1331-1341 - Kawakami, H. Nakanishi, K. Makiyama, A. Konishi, H. Morita, S. Narita, Y. Sugimoto, N. Minashi, K. Imano, M. Inamoto, R. Kodera, Y. Kume, H. Yamaguchi, K. Hashimoto, W. Muro, K.
Real-world effectiveness and safety of trastuzumab-deruxtecan in. Japanese patients with HER2-positive advanced gastric cancer (EN-DEAVOR. study). GASTRIC CANCER. 2025 28: 51-62 - Kodera, Y.
The Magic Flute is a Singspiel, not an opera? My thoughts about the. German, Austrian and Swiss Guidelines for Systemic Treatment of Gastric Cancer. GASTRIC CANCER. 2024 27: 1-2 - Kobayashi, D. Kodera, Y. Fukushima, R. Morita, M. Fushida, S. Yamashita, N. Yoshikawa, K. Ueda, S. Yabusaki, H. Kusumoto, T. Arigami, T. Hidemura, A. Omori, T. Yamaguchi, H. Hirono, Y. Tsuji, Y. Moon, JH. Tomita, T. Imamura, H. Nakanishi, K. Shimizu, D. Hirakawa, A. Ishigami, H. Kitayama, J.
Phase II Study of Intraperitoneal Administration of Paclitaxel Combined. with S-1 and Cisplatin for Gastric Cancer with Peritoneal Metastasis. ANNALS OF SURGICAL ONCOLOGY. 2024 31: 1319-1327 - Sugiyama, F. Kanda, M. Shimizu, D. Umeda, S. Inokawa, Y. Hattori, N. Hayashi, M. Tanaka, C. Nakayama, G. Kodera, Y.
Absence of Hypercoagulation Status after Neoadjuvant Treatment is. Associated with Favorable Prognosis in Patients Undergoing Subtotal. Esophagectomy for Esophageal Squamous Cell Carcinoma. ANNALS OF SURGICAL ONCOLOGY. 2024 31: 3417-3425
- Nakanishi, K. Kanda, M. Ito, S. Mochizuki, Y. Teramoto, H. Ishigure, K. Murai, T. Asada, T. Ishiyama, A. Matsushita, H. Shimizu, D. Tanaka, C. Fujiwara, M. Murotani, K. Kodera, Y.
- 2024 (Experimental) 年
- Kanda, M. Kasahara, Y. Shimizu, D. Shinozuka, T. Sasahara, M. Nakamura, S. Iguchi, Y. Katsuno, M. Kodera, Y. Obika, S.
Dual-modified antisense oligonucleotides targeting oncogenic. protocadherin to treat gastric cancer. BRITISH JOURNAL OF CANCER. 2024 131: 1555-1566 - Ito, Y. Kanda, M. Sasahara, M. Tanaka, C. Shimizu, D. Umeda, S. Inokawa, Y. Hattori, N. Hayashi, M. Nakayama, G. Kodera, Y.
Killer cell lectin-like receptor G2 facilitates aggressive phenotypes of. gastric cancer cells via dual activation of the ERK1/2 and JAK/STAT. pathways. GASTRIC CANCER. 2024 27: 506-518 - Kanda, M. Takano, N. Miyauchi, H. Ueda, K. Mizuno, M. Kasahara, Y. Kodera, Y. Obika, S.
Preclinical toxicological assessment of amido-bridged nucleic. acid-modified antisense oligonucleotides targeting synaptotagmin XIII. for intra-abdominal treatment of peritoneal metastasis of gastric cancer. GASTRIC CANCER. 2024 27: 1229-1241 - Sasahara, M. Kanda, M. Tanaka, C. Shimizu, D. Umeda, S. Takami, H. Inokawa, Y. Hattori, N. Hayashi, M. Nakayama, G. Kodera, Y.
Therapeutic antibody targeting natriuretic peptide receptor 1 inhibits. gastric cancer growth via BCL-2-mediated intrinsic apoptosis. INTERNATIONAL JOURNAL OF CANCER. 2024 154: 1272-1284 - Shinozuka, T. Kanda, M. Sato, Y. Shimizu, D. Umeda, S. Takami, H. Hattori, N. Hayashi, M. Tanaka, C. Kodera, Y.
Therapeutic Potential of Antibody Targeting Neuronal Pentraxin Receptor. in Esophageal Squamous Cell Carcinoma. ANNALS OF SURGICAL ONCOLOGY. 2024 31: 5674-5682
- Kanda, M. Kasahara, Y. Shimizu, D. Shinozuka, T. Sasahara, M. Nakamura, S. Iguchi, Y. Katsuno, M. Kodera, Y. Obika, S.
研究キーワード
食道癌、胃癌、大腸癌、膵癌、肝癌、クローン病、潰瘍性大腸炎