脳神経病態制御学脳神経外科学/脳神経先端医療開発学/脳血管内治療学
概要
名古屋大学大学院医学系研究科 脳神経外科について
当科の歴史
当教室の歴史は古く、当時のヨーロッパの先進的な脳神経外科手術手技を本邦に導入し、日本脳神経外科学会の第1回〜第3回の会長を務めた齋藤眞教授より始まる。その後、戸田博教授及び橋本義雄教授は地域医療貢献に尽力。景山直樹教授は脳腫瘍病理学・小児脳腫瘍学・神経内分泌学を確立するとともに、日本脳腫瘍病理学会、日本脳血管内治療学会などを創設し、本邦の学問的基盤を築き上げた。特に、低侵襲手術法の先駆的手法である、下垂体腫瘍に対する経蝶形骨洞手術(Hardy approach)の本邦への導入をいち早く確立した。杉田虔一郎教授は脳神経外科の顕微鏡手術(Microsurgery)の確立に中心的役割を果たすとともに、脳動脈瘤に対するSugita clipの開発、Sugita frame、Sugita chair等、脳神経外科手術機器の開発に尽力した。自らの顕微鏡下手術のスケッチをふんだんに挿入した成書"Microneurosurgical atras"は脳神経外科医のバイブルとまで言われ、世界中で愛読された。吉田純教授は生命科学・医用工学の進歩を脳神経外科学に取り入れ、画像誘導手術法の確立、細胞免疫療法の導入の後に、本邦初の脳腫瘍に対する遺伝子治療の臨床応用を実施した。現在の若林俊彦教授は、脳神経外科ロボティクス開発、脳腫瘍のゲノム・エピゲノム・プロテオーム解析に基づく個別化・層別化医療の推進、分子標的イメージングPETプローベや標的核酸医療の新規開発、8K高精度画像技術のICT導入による内視鏡手術臨床応用、「脳とこころの研究センター」設立に伴う脳科学のアジアの拠点形成に尽力している。
本科の各診療グループの特徴
- 脳腫瘍グループ:BrainTHEATERを用いた最先端手術手技と先進医療で、生命・機能予後の向上に取り組んでいます。頭蓋底手術から覚醒下開頭術まで、遍く脳腫瘍手術に対応し、悪性腫瘍には世界最高峰の技術を取り入れて化学療法・放射線治療を行なっています。2000年には本邦初の悪性脳腫瘍に対する遺伝子治療臨床応用を実施しました。
- 下垂体・神経内分泌グループ:下垂体腫瘍の他、頭蓋底局在腫瘍に対し神経内視鏡手術、キーホール手術など特殊技術手術を駆使、iNPH(特発生成常圧水頭症)などの認知症の治療も中部地区の拠点として実践しています。
- 機能的脳外科・画像解析グループ:難治性不随意運動(パーキンソン病、振戦)、てんかん、痛みに対し、最新脳神経画像診断技術を駆使して定位脳手術を実施しています。脳深部刺激療法で本邦初導入ロボット(ニューロメイト)を駆使し新たな分野を開拓しています。
- 脊髄・脊椎グループ:神経モニタリングや術中ナビゲーション技術を駆使して、低侵襲で最大の効果を得るマイクロサージェリー技術を開発しています。脊髄再生医療の基礎研究を推進しています。
- 脳神経先端医療開発グループ:悪性脳腫瘍の遺伝子治療を本邦初に臨床応用した実績を有し、各種脳神経疾患先端医療への橋渡し研究に重点を置いた、ニューロサイエンス関係の国内有数の施設を保有しています。
- 脳血管内外科グループ:脳動脈瘤、脳動脈狭窄病変、動静脈奇形、硬膜動静脈瘻、血管外傷、脳塞栓、血管性腫瘍等、本邦の血管内治療の草分け的存在で、医師主導型臨床治験も積極的に取り入れ、本邦のディバイスラグの早期解消に務めています。
- 脳卒中外科グループ:卓越した脳動脈瘤クリップとして全世界で使用されている「スギタクリップ」の生まれた本拠地です。その他、もやもや病に対する血管吻合術、脳虚血疾患に対するバイパス術を積極的に進めています。
- 小児脳神経外科グループ:小児脳腫瘍:名古屋大学は小児がん拠点に指定されており、すべての脳腫瘍のお子さんを受け入れています。適切な医療連携のもと、迅速かつ安全に診断・治療していきます。先天疾患: 主に、二分頭蓋(脳瘤)、二分脊椎(脊髄髄膜瘤・脊髄脂肪腫)、水頭症など、脳脊髄にかかわるすべての新生児先天疾患を受け入れています。小児脳血管障害:もやもや病やAVMなどすべての小児脳血管障害を脳卒中外科グループと連携して治療にあたります。
名古屋大学医学部附属病院の特色
名古屋大学医学部附属病院は、歴代の院長が築き上げてきた基盤の上に、斬新なアイデアの下に改革を次々に断行し、その結果、名大病院は、診療実績、教育基盤、研究業績のいずれの面も大きな発展を成し遂げた。トランスレーショナル研究拠点、臨床研究中核拠点、小児がん研究拠点はもとより、産学官連携の推進、早期創成科学プロジェクトセンターと共同で各種プロジェクトの推進、脳とこころの研究センターの創設などを先導する一方、臨床現場では、病院収益を各講座の教官数の増員を図り、若手研究者の研究支援金の補填に務め、各教室の人的及び研究財政支援を図った。また、寄附講座の増設による教官数の増員も図り、教育担当の分担化と割当時間の短縮に伴う負担の軽減に務めている。
さて、名古屋大学医学部の特色として、全国に先立ちマッチングシステムを取り入れ、独自の名古屋大学方針として永年築き上げて来た卒後全科ローテーションシステムにより、全人的な医療および中部地区の地域医療を支え、優秀な臨床医が育ってきている。その結果、愛知県を中心とする東海4県への研修希望者が毎年多数参集しており、その結果、臨床に強い医師の要請機関として、その存在感は更に強まって来ている。
一方、わが国は、世界で類をみないスピードで超高齢化社会を迎え、今後、65歳以上が総人口に占める割合は、2025年には30%を越えるものと予測されている。平均寿命の上昇により、医療現場においては、高齢化に伴って増加する、がん、脳卒中、心筋梗塞、糖尿病、慢性腎疾患等の慢性疾患が医療費の多くを占めるようになってきており、この抜本的解決を目指した取り組みが緊急課題となっている。名大病院の今後取るべき方向性は、国内のみならず国際的な視野の下に、上記各種疾患に対する創薬を含めた大型臨床研究の受託推進体制を創り上げるとともに、2012年に名大に創設された創薬医薬大学院を初めとする各種研究機関から生まれでてくる名大発の創薬開発を、臨床応用に導くために支援する開発基盤を早急に立ち上げ、それ産業化して世界に冠たる臨床研究拠点を組織化することである。そしてこの目標を実現化するためには、1)創薬医薬大学院、脳とこころの研究センター、先端医療臨床研修支援センター或は中部円環コンソーシアムなどから生まれでてくる基礎研究から橋渡し研究へのシーズ発掘と育成の持続性を人的及び経済的支援をすること、2)橋渡し研究及び臨床研究を支える世界的頭脳の人材確保(ヘッドハンティング)とその下での優秀な若手人材の育成及びリクルートの推進、3)臨床研究推進基盤の国際標準化確立のための海外交流の活性化、4)圧倒的知財申請を基盤として創薬医療の成長と地元財界と組んで産業化の達成を早期に目指すことが必要であると考える。
名大病院は、東海地方を中心に、わが国の国立大学病院の中で最大級の関連病院数を誇る。約70病院(総数約31,000床)の関連施設の中には臨床研究や臨床治験が自ら行える500床以上の大規模病院が34施設あり、医学生及び卒後研修制度の人材教育、診療教育の実績では他に類を見ないネットワークを構築している。
【名称】
名古屋大学大学院医学系研究科脳神経外科学教室
【所在地】
〒466-8550 愛知県名古屋市昭和区鶴舞町65
☎ 052-741-2111 (Ext;2353/2354)
【入院症例数(名古屋大学単独)】
脳腫瘍459例、脳動脈瘤140例、脳動静脈奇形55例、脳梗塞77例、脊髄脊椎疾患65例、小児・奇形・水頭症61例、てんかん・機能的脳神経外科182例、など(2015年実績)。
【入院症例数(名古屋大学関連病院全体)】
脳腫瘍3141例、脳動脈瘤2104例、脳出血3172例、脳梗塞3197例、脊髄脊椎疾患1625例、小児・奇形・水頭症600例、てんかん・機能的脳神経外科1159例、など(2015年実績)。
研究プロジェクト
◎悪性脳腫瘍グループ
1) 脳腫瘍の発生、進展に関わる遺伝子異常と腫瘍微小環境の形成に関する研究
①脳腫瘍の術中迅速遺伝子解析研究
脳腫瘍は、遺伝子異常が蓄積することで発症すると考えられています。これまで日本を含む全世界で大規模な脳腫瘍の遺伝子解析研究が行われ、重要な遺伝子異常が同定されています。これらの結果をうけて、最新版脳腫瘍WHO2021年度分類では脳腫瘍の診断のためには遺伝子異常の有無を調べることが必須になりつつあり今後はさらに多くの遺伝子解析が重要になってくることが予想されます。当院ではこれまでも重要な遺伝子異常の解析を手術後に行っておりましたが、これまでの解析に加えて手術中にも解析可能な高速遺伝子解析装置を用いた術中遺伝子診断の研究を進めています。手術中に正確な診断を行い、摘出範囲の最終決定等、手術方針の検討に有用な研究と期待しています。

②脳腫瘍の新規低侵襲診断法リキッドバイオプシーに関する研究
脳腫瘍の一つである悪性リンパ腫では、MYD88遺伝子異常が診断に有用であることが明らかになりつつあります。最近様々ながんで血液や髄液中に腫瘍細胞由来の遺伝子の異常が流れ込んでいることが明らかになり、血液検査等で遺伝子異常を同定して診断を行うリキッドバイオプシーが新規低侵襲診断法として期待されています。この遺伝子異常を血液や髄液の検査で同定することで、低侵襲に診断可能と考え現在基礎研究と臨床研究を進めています。
③脳腫瘍のオルガノイドモデル研究
脳腫瘍は様々な性質をもつ腫瘍が混在しており、それぞれの患者さんの腫瘍の性質を把握した上で治療を検討するプレシジョンメディスンが重要になる可能性があります。そのためには手術で得られた腫瘍検体を用いてその性質を詳しく解析する必要があり、新しい研究モデルが必要と考えられています。オルガノイドモデルは近年様々ながん研究で有用な研究モデルとして注目されており、脳腫瘍分野でもその樹立が報告されており、脳腫瘍の新規研究モデルとして期待されています。当研究室でもこれまでに悪性腫瘍のみでなく良性腫瘍からも本モデルを構築しており、今後新しい治療法の開発に有用であると期待して研究を進めています。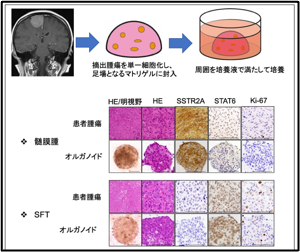
2) 脳腫瘍の新規治療開発に関する研究
①悪性神経膠腫に対する新規免疫治療CAR-T療法の開発研究
脳腫瘍の組織の中には、腫瘍細胞のみでなく、血管細胞、繊維芽細胞、免疫関連細胞など、色々な細胞が関わり複雑な腫瘍微小環境を作っていますが、どのように腫瘍微小環境を作り維持しているのかは解明されておりません。近年他のがんではこの微小環境に影響を与える免疫療法が効果を上げているが、まだ脳腫瘍の治療においてはその効果は確立されておりません。免疫細胞と脳腫瘍との相互作用を理解することは、脳腫瘍治療の選択肢を大きく広げる可能性があり、現在脳腫瘍検体を用いた研究や細胞、動物実験等の基礎研究を進めています。悪性神経膠腫である膠芽腫は放射線化学療法に抵抗性を持ち、その予後は不良で、新規の治療法の開発が求められています。免疫療法は、第4の治療法としてその地位を確立し、さまざまな癌腫で有効性が報告されています。当部では、これまで膠芽腫に対するCAR-T療法(キメラ抗原受容体T細胞)の開発を行ってきました。CAR-T療法とは、腫瘍細胞に特異的に結合する短鎖抗体にT細胞の活性化に必要なドメインを結合させたキメラ抗原受容体を遺伝子導入したT細胞を投与する免疫療法のひとつで、特定の癌腫ですでに臨床応用されています。しかし膠芽腫に対しては、まだ有効性は証明されていません。将来的に、膠芽腫に対する新規の治療法として臨床応用できるよう、どのような遺伝子改変を施せば膠芽腫に対しても有効性を示すことができるか、基礎研究を進めています。
②悪性神経膠腫に対する腫瘍溶解性ウイルス治療の開発研究
腫瘍溶解性ウイルス療法は腫瘍組織内で腫瘍細胞のみで増殖・拡散し、腫瘍細胞を破壊し、副次的に腫瘍に対する免疫応答をもたらす治療として近年注目されています。テセルパツレブは本邦で開発され使用可能となった膠芽腫に対するウイルス治療薬であり、現在は使用施設が限られるものの、今後の普及が期待されています。当研究室では脳腫瘍、中でも悪性神経膠腫に対し腫瘍溶解性ウイルスを軸とした免疫療法の開発を行っています。
③脳腫瘍に対するドラッグデリバリー
脳腫瘍など中枢神経系疾患への薬剤送達には“血液脳関門(Blood-brain barrier; BBB)”の通過率が共通の課題としてあげられます。BBBの存在により全身に投与された薬剤の大半は、中枢神経系内病巣への移行が制限されます。そのため多くの場合、中枢神経系内の脳内標的部位において薬剤の有効濃度を得る前に、全身への曝露量が問題となります。
このBBBを回避して脳内に薬剤を送達する方法として、脳内留置用剤による局所投薬、もしくは髄腔内投与があります。しかし、脳内留置用剤については腫瘍摘出後に使用する薬剤であり、また、薬剤の拡散も困難です。髄腔内投与に関しても髄液から脳内標的部位への薬剤拡散は得難いことが知られており、一部の疾患に使用されるにとどまります。
一方で、投与局所に有効な薬剤拡散を得る薬剤局所投与法としてconvection-enhanced delivery (CED)があります。CEDは脳内標的部位に留置したカテーテル先端の圧勾配を維持することで、脳内に存在する間質液の対流を強化し、投与局所に広く薬剤を分布させる技術です。化学療法剤をCEDで腫瘍局所へ投与する治療法開発を行っています。
3) 脳腫瘍の有効な治療法の開発を目指した治験・臨床研究
① 名古屋大学発の治験
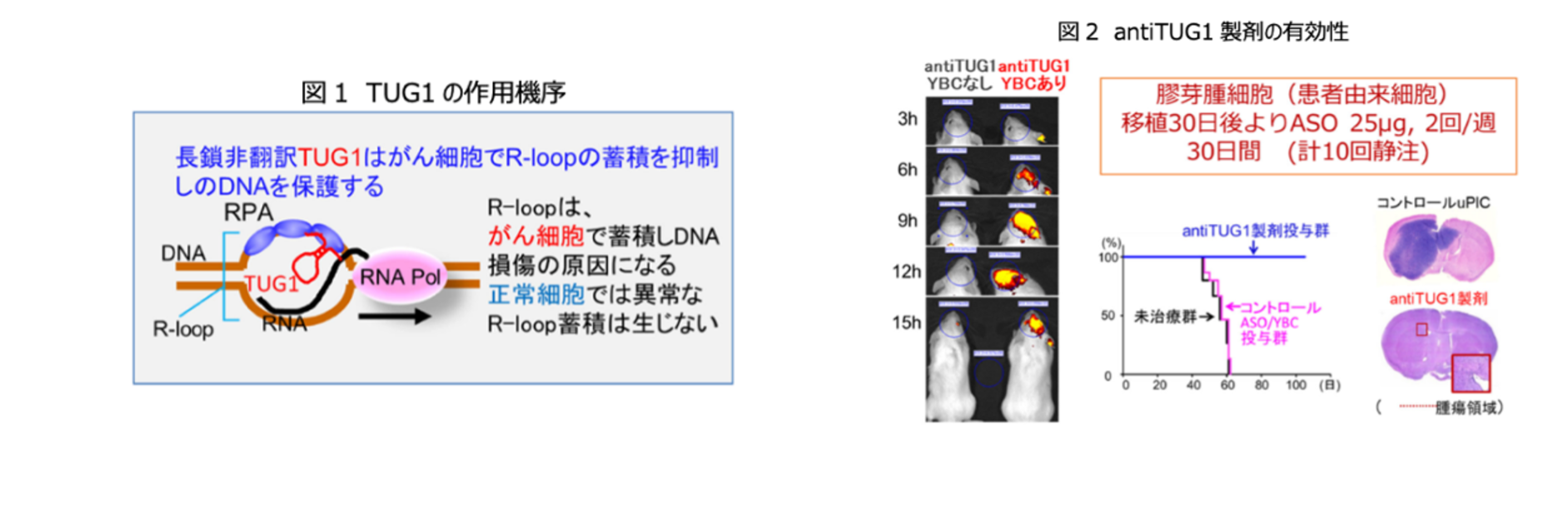
A. 再発膠芽腫に対する新規核酸医薬antiTUG1製剤による医師主導治験(TUG trial; 第Ⅰ相試験)
再発・進行膠芽腫患者を対象として、長鎖非翻訳RNAであるTUG1に対するアンチセンスオリゴヌクレオチドと新規ドラッグデリバリーシステムを組み合わせたantiTUG1製剤の第I相試験を実施しています。本薬剤は、腫瘍細胞の生存や薬剤抵抗性に関与するTUG1を標的とした新たな治療法であり、まずは第I相試験を開始し、2024年2月に名大病院にて第一例目の治療を開始しています。
B. ぺランパネルの術前予防内服による開頭腫瘍摘出術後早期のてんかん発作の抑制効果に関する研究 (GRAMPAS trial)
脳腫瘍術後早期てんかん発作の抑制のための抗てんかん薬の使用は日常臨床では行われるものの、エビデンスがありません。医師主導治験として、抗てんかん薬であるベランパネルの予防内服による脳腫瘍術後早期てんかん発作の抑制効果を検証する多施設ランダム化試験を2024年3月より開始いたしました。
② JCOG, JCCGによる臨床試験
A. 初発膠芽腫に対する造影病変全切除術と造影病変全切除+F L A I R高信号病変可及的切除術とのランダム化第Ⅲ相試験(JCOG2209)
初発膠芽腫に対して、造影病変に加えFLAIR高信号病変を切除(FLAIRectomy)することが標準治療である造影病変全切除術(Gross total resection:GTR)より優れていることをランダム化第III相試験にて検証します。
B. メトトレキサート基盤寛解導入療法後奏効例の初発中枢神経系原発悪性リンパ腫に対するチラブルチニブ維持療法の二重盲検ランダム化第II相医師主導治験 (JCOG2104)
大量メトトレキサート基盤化学療法実施後に完全奏効が達成された場合に放射線治療を行わず、チラブルチニブ維持療法の有効性を二重盲検ランダム化第II相比較試験により評価します。
C. 初発中枢神経原発胚細胞腫瘍に対する化学療法併用放射線治療に関するランダム化比較試験(JCCG CNSGCT2021)
中枢神経原発胚細胞腫瘍においてジャーミノーマ群で放射線量を減量した試験治療の非劣性、悪性胚細胞腫瘍群で標準治療に対してメソトレキサート髄注、高用量化学療法を用いた治療の優越性を検証します。
D. 小児髄芽腫に対し新規リスク分類を導入したチオテパ/メルファラン大量化学療法併用放射線減量治療の有効性と安全性を検討する第II相試験(JCCG MB19 試験)
本研究では髄芽腫の遺伝子解析の結果に基づいて再発リスクが低いグループには強度を落とした治療を、高いグループにはより強力な治療を行いその有用性を評価します。
E. 非定型奇形種様ラブドイド腫瘍(AT/RT)に対して強化髄注短期決戦型化学療法とチオテパ/メルファラン大量化学療法後に遅延放射線治療を行う集学的治療レジメンの安全性と有効性を検討する第II相試験(JCCG AT20)
非定型奇形腫瘍ラブドイド腫瘍(AT/RT)の標準リスク群では髄注併用多剤併用化学療法後に大量化学療法および局所放射線治療を実施し、高リスク群に対してはさらに3歳以下では髄注による維持療法を、4歳以上では全脳全脊髄照射を追加し、その有用性を評価します。
◎脳卒中外科グループ
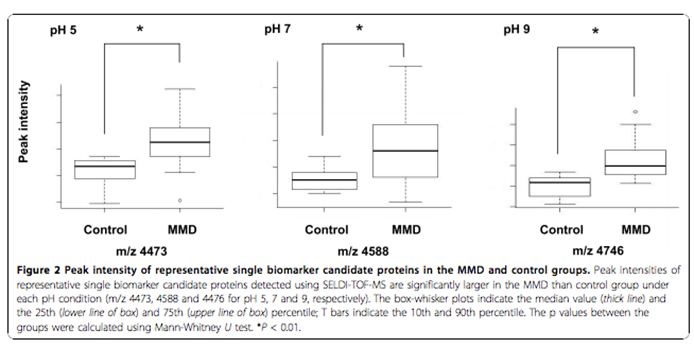
1) もやもや病の髄液中に含まれるタンパク・遺伝子解析: 研究責任者 荒木芳生
我々はもやもや病患者の髄液中に含まれるタンパクについて研究を行い、これまで2つの論文を発表している。1つは、もやもや病患者とそれ以外の疾患患者の髄液中に含まれるタンパク(ペプチド)の比較解析により、2種類のペプチド(m/z4473と m/z4588)がもやもや病患者で有意に上昇していることを報告した(Araki et al. BMC Neurology 2010, 10:112)。
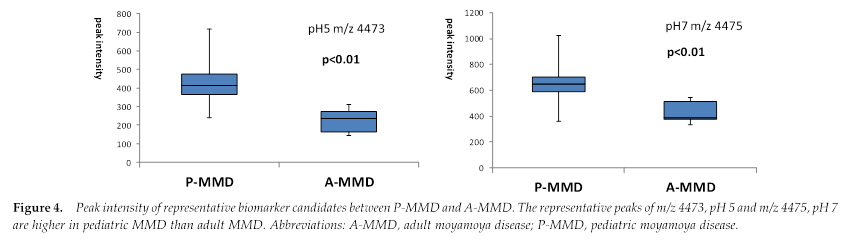
続く研究では、先の2つのペプチドのうち、m/z4473がもやもや病患者、とりわけ小児もやもや病患者において高値であり、さらにもやもや病群では年齢依存性に減少し、対照群では年齢との相関関係は見られなかったことを報告した(Maruwaka et al. Journal of Stroke and Cerebrovascular Diseases, Vol. 24, 2015: pp 104-111)。
現在、そのペプチドがどのような機能をもつのかの検証をすすめている。
さらに現在、もやもや病患者と非もやもや病患者の髄液検体を用いて遺伝子解析を行い、もやもや病の病態に関与する遺伝子を発見したいと考えている。
2) クモ膜下出血における海馬神経細胞でのnNOSリン酸化調節機構の解明: 研究責任者 荒木芳生
Nitoric oxide(以下NO)はNOS(nitric oxide synthase)によってL-arginineから産生され神経伝達物質として作用するほか、血管内皮で生成され内皮型(eNOS)とともに血管拡張作用を発揮することで局所脳血流量を増加させることが知られている。
研究協力者である大須賀浩二(愛知医科大学脳神経外科特任教授)は、以前よりラット虚血/クモ膜下出血モデルにおけるCaMKⅡの活性化とリン酸化neuronal NOS(phosphorylated nNOS, p-nNOS)との関係について検討している。p-nNOSはその部位により誘導されるNO合成によってup/down regulateされることがわかっており、我々は特に海馬におけるp-nNOSの発症早期の経時的・空間的変化について調べることで以下の項目について明らかにしたい。
(a)ラットのクモ膜下出血モデル導入(発症)早期の海馬においてp-nNOS at Ser1412が認められるかどうか(Makino et al. Brain Res. 2015)
(b)それがAMP-dependent protein kinase (PKA)活性化に依存しているかどうか
(C) CaMKⅡ活性化によるp-nNOS at Ser847やPKA活性化によるp-nNOS at Ser1412がSAH発症早期に海馬で生じるearly brain injuryにどのような影響を与えるかどうか
本研究により、クモ膜下出血発症直後に海馬で生じるNOSリン酸化系による「神経保護作用機序」が明らかになり、nNOS阻害因子によるearly brain injuryの抑制、すなわちクモ膜下出血に合併する高次脳機能障害防止につながるものと考えている。
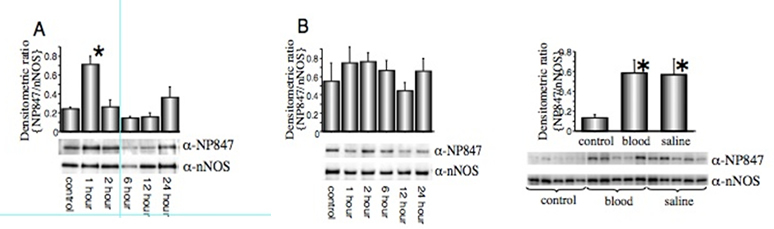
ラットクモ膜下出血モデル導入1時間後に、海馬神経細胞(細胞質・軸索)におけるp-nNOS at Ser847がCaMKⅡ活性化により増加している
(Makino et al. Brain Res. 2015)
◎機能的脳神経外科グループ(脳とこころの研究センター)
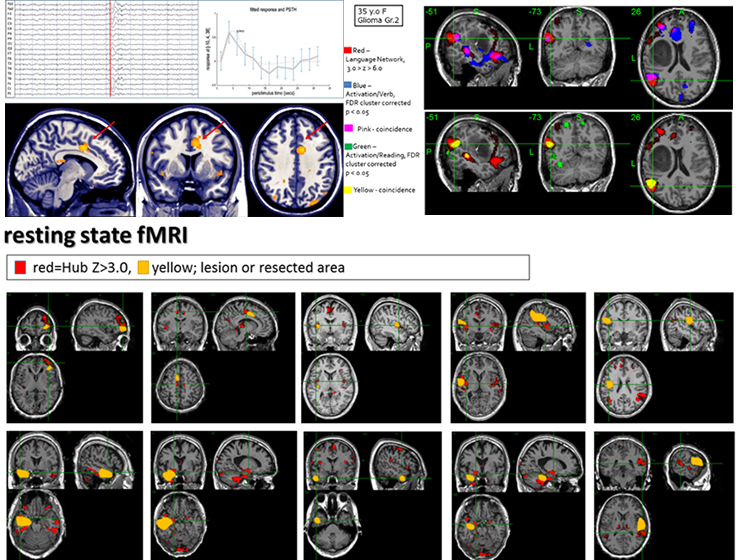
1) fMRI、EEG-fMRI、及びMEGを用いた高次脳機能ネットワーク解析と次世代のてんかん外科手術への展開:研究代表者 前澤 聡
脳神経外科領域において、安静時fMRI、DTI-トラクトグラフィ、MEGといった脳神経ネットワークに関わる最新のmodalityを使って得られる知見を有効に活用し、より安全で効果的な手術法の確立へと展開する事を目的としている。新たに脳波―機能的MRI同時記録装置(EEG-fMRI)を導入して、てんかんの焦点診断、ネットワーク解析を行なう。EEG-fMRI解析では焦点付近で発作間欠期てんかん性活動に同期したBOLD活動を捉える(左上図)。安静時機能的MRIネットワーク解析でてんかん性の以上結合の上昇を描出する(下図)。覚醒下手術中のマッピングの所見からhodologicalな視点での機能温存を検討しており、安静時ネットワーク解析によるdefault mode network等の基盤的ネットワークの変化や皮質下言語性ネットワークに注目している。安静時機能的MRIによる言語性ネットワークとタスクのある機能的MRIの結果の比較し(右上図)、実際の手術の際の電気刺激マッピングの結果と比較検討する事で、神経基盤に対する理解を深め、より非侵襲的で確実な術前脳機能評価を追及している。名古屋大学脳とこころの研究センターと連携して実施する。
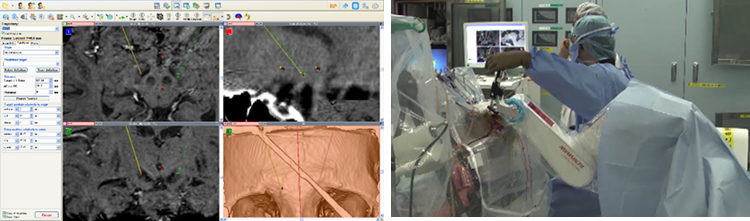
2) Neuromate® robotによる定位脳手術の臨床応用研究:研究代表者 中坪大輔
Neuromate(ニューロメイト)とは定位脳手術のための、手術支援ロボットである。ロボティクスを導入することで、安定した高精度ターゲティングを可能とし、精度と効果の向上が期待できる。欧州ではCEマーク、米国ではFDAで承認され、日本でも2015年6月に薬事承認となった。2011年にアジアで初の本格導入となり、日本の手術方法に合わせた改良、調整、運用方法を作り上げ、名古屋大学において、パーキンソン病に対する脳深部刺激術(DBS)を8例臨床研究として実施された。安全面の確認及び従来の定位用フレームシステムとの精度検証などが行われた(上図)。薬事承認後の再設置後、現在最も多く行われているのが脳深部刺激術(DBS, deep brain stimulation)である。名古屋大学では、放射線科の協力により、3TMRI での direct imaging を基にプランニングを行っている(左下図)。術中は微小電極記録(MER)による大脳基底核神経活動の詳細な検証を行い、最適な電極留置を可能としている(右下図)。
欧州や米国の一部のてんかんセンターでは、従来の硬膜下電極による頭蓋内脳波の解析だけでなく、焦点及び機能的部位に10-20本電極を留置し、機能的マッピングも同時に行っている。名古屋大学でもneuromate®を用いて、複数本の電極留置を行い、焦点診断に結び付けている。今後フレームレスの導入や、ワークステーションの改良などが予定されており、応用範囲も広がると考えられる。脳とこころの研究センターでのEEG-fMRIなど、画像解析技術とのコラボレーションにより、定位性、正確性、安全性を生かして、その研究成果を実証すべく進めている。

研究プロジェクト3
3) MRgFUS (MRI guided focused ultrasound)を使った振戦治療:研究代表者:前澤聡 中坪大輔 加藤祥子
focused ultrasound (FUS)とは、超音波エネルギーを一定箇所に集束させ、温度上昇を引き起こし、治療を行う治療機器である。MRIは非観血的な温度マッピングが可能であり、生体の熱凝固が主な作用機序であるFUS治療にとって大きな利点であり、治療効果および副作用を術中に評価することが可能である。MRガイド下集束超音波治療(MRgFUS)は、集束超音波とMRIの2つの技術を組み合わせた画期的な治療法であり、1024個の端子が付いたヘルメット型装置がFUS用の専用ベッドに備え付けられ、そのヘルメット型装置を患者の頭部に装着し、MRI内に入る。各端子から標的部位に向けて微弱超音波を照射すると、正確に脳の1カ所に集められ、温熱で組織を変性させることで治療効果をもたらす。
Insightec社製の集束超音波機器である「Exablate Neuro(エクサブレート・ニューロ)」を,2016年7月に米国食品医薬品局(FDA)が承認し、カナダ保健省からも本態性振戦への適用が承認された。日本でも本態性振戦とパーキンソン病に伴う振戦について薬事承認(PMDA)を申請中である。
本態性振戦はMRgFUSによる効果は、高精度に制御された加熱により視床Vim核内の組織を破壊することにより効果が得られる。臨床試験結果が、2013年にはバージニア大学にて15人の患者に施行し、その効果と安全性を確認されたことが報告されている。また、淡蒼球視床路(PTT)を標的とした治療により、パーキンソン病に伴う振戦に対しても効果が示されている。その他にも三叉神経痛や悪性脳腫瘍、脳血管障害に対しても有効性が期待されている。
わが国では現在、2016年8月現在、日本に五台導入されており、今後、名古屋大学脳神経外科の関連病院でも導入予定であり、本態性振戦やパーキンソン病に対する低侵襲な治療として実施し、その有用性に関する臨床研究を進める。
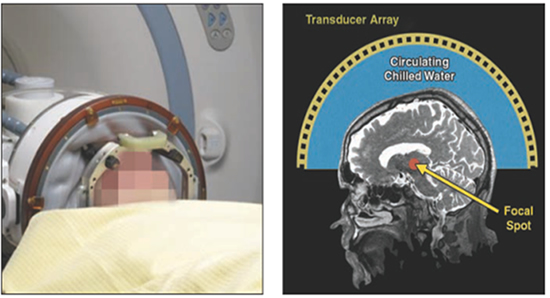
(Elias WJ,2011 NEJM)
◎脊髄・機能グループ
1) 低侵襲脊髄手術less invasive spine surgery : 研究責任者 西村由介
皮膚や筋肉などの正常組織への損傷を極力最小限とするため、当科では低侵襲脊髄手術を行っており、この臨床成績を検討している。
A)経椎体的前方除圧術
一側上肢の痛み、しびれなどで発症した頚椎症性神経根症に対し、6mmほどの小さな穴を顕微鏡手術下で作成し、人工のインプラントを留置することなく治療する。この手術により椎間可動性が温存され、隣接椎間障害を起こす危険性は極めて低くなる。我々は、現在まで良好な臨床成績、有限要素法を用いた椎体安定性を報告してきた。現在は術後の頚椎アライメントの変化、放射線画像を用いた手術椎体安定性、隣接椎間に対する影響などを検討している。
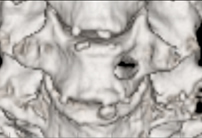
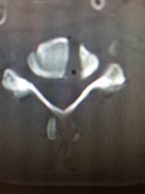
B) Wiltse approachを用いた胸腰椎後方固定術
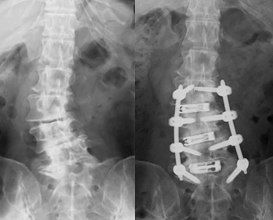
筋層間を剥離して筋肉に対しての損傷を最小限に抑えて椎間関節外側に達する手術法がWiltse approachであり、これを用いて筋肉へ損傷をほとんど及ぼすことなくスクリューを留置し、胸腰椎後方固定術を行っており、この臨床成績を検討している。従来の方法と比較して同等の治療効果を得られ、出血量を軽減し、疼痛を抑えることが可能であった。前方侵入椎体固定術(OLIF)をこの方法と併用することによりさらなる低侵襲化を行っており、さらなる治療成績の検討を行っている。
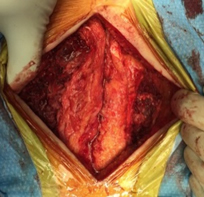
2) 術中神経モニタリング intraoperative nerve monitoring(MEP ; motor evoked potentials , SEP ; somatosensory evoked potentials) : 研究責任者 西村由介
 術中の神経機能のモニタリングとして、当科では脊椎脊髄手術全例において脊髄機能モニタリングを行っている。運動誘発電位(monitor evoked potential : MEP)と体性感覚誘発電位(somatosensory evoked potentials : SEP)を使用しており、検査技師のスタッフと連携し、術中の波形の変化に留意しながら安全な手術を行っている。術中の波形の変化には、偽陽性となることもあり、様々な因子の影響が予測され、我々はラットやマウスを用いて偽陽性となる要因を解析しており、その中でも術中の血圧変化が重要な因子となることを報告している。血圧変化がMEP波形に及ぼす影響を詳細に検討している。
術中の神経機能のモニタリングとして、当科では脊椎脊髄手術全例において脊髄機能モニタリングを行っている。運動誘発電位(monitor evoked potential : MEP)と体性感覚誘発電位(somatosensory evoked potentials : SEP)を使用しており、検査技師のスタッフと連携し、術中の波形の変化に留意しながら安全な手術を行っている。術中の波形の変化には、偽陽性となることもあり、様々な因子の影響が予測され、我々はラットやマウスを用いて偽陽性となる要因を解析しており、その中でも術中の血圧変化が重要な因子となることを報告している。血圧変化がMEP波形に及ぼす影響を詳細に検討している。
3) 脊椎・脊髄腫瘍に対する治療: 研究責任者 西村由介
 A)脊髄髄内腫瘍に対する手術治療成績
A)脊髄髄内腫瘍に対する手術治療成績
低侵襲手技を導入することにより術後脊柱変形の出現を防ぐこと、術後の麻痺と深部覚障害を最小限に抑えることを目指した治療を行っており、治療成績を検討している。腫瘍の病理標本の遺伝子解析を行い、脳腫瘍との相違に着目した脊髄腫瘍の遺伝学的解析を行っている。
B) 脊髄髄外腫瘍に対する手術治療成績
低侵襲手技を導入することにより転移性脊椎腫瘍をはじめとした悪性腫瘍に対する腫瘍摘出術・脊椎固定術の適応を拡大し、治療成績を向上する取り組み行っており、その治療成績の検討も行っている。愛知県がんセンター中央病院の整形外科腫瘍班とも連携し、複数科合同の腫瘍摘出、脊柱再建手術を行っており、その治療成績の検討も行っている。
4) 脊髄神経再生の基礎研究: 研究責任者 西村由介
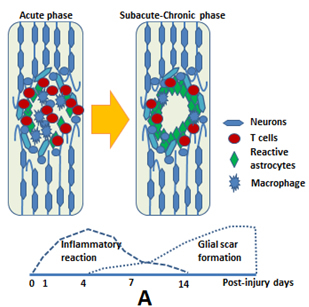 我々は以前より中枢神経内での免疫反応においてミクログリアの役割が非常に大きいことを証明してきた。(Takeuchi et al. Experimental Neurology 2008)我々の最近の研究でIFN-β遺伝子を組み込まれた神経幹細胞による脊髄損傷マウスの運動機能回復はグリア瘢痕抑制により実現されたが、同時に損傷部位でのミクログリアの集積が減少していること(図C)(Nishimura et al. Cell transplantation 2012, Ito et al. J of Neurotrauma 2009)、ミクログリアを抑制することで運動機能改善が得られること(Umebayashi et al. J Neurotrauma. 2014)を報告してきた。現在は、脊髄損傷後に生じる自己免疫性炎症に注目し、この自己免疫性炎症を制御することにより脊髄再生の実現を目指している。
我々は以前より中枢神経内での免疫反応においてミクログリアの役割が非常に大きいことを証明してきた。(Takeuchi et al. Experimental Neurology 2008)我々の最近の研究でIFN-β遺伝子を組み込まれた神経幹細胞による脊髄損傷マウスの運動機能回復はグリア瘢痕抑制により実現されたが、同時に損傷部位でのミクログリアの集積が減少していること(図C)(Nishimura et al. Cell transplantation 2012, Ito et al. J of Neurotrauma 2009)、ミクログリアを抑制することで運動機能改善が得られること(Umebayashi et al. J Neurotrauma. 2014)を報告してきた。現在は、脊髄損傷後に生じる自己免疫性炎症に注目し、この自己免疫性炎症を制御することにより脊髄再生の実現を目指している。
◎小児脳神経外科グループ
1) 脳腫瘍治療後の二次性頭蓋縫合早期癒合症:医原性キアリ奇形のリスク因子と診断マーカー: 研究責任者 近藤五郎・栗本路弘(研究協力:加藤美穂子・大澤弘勝)
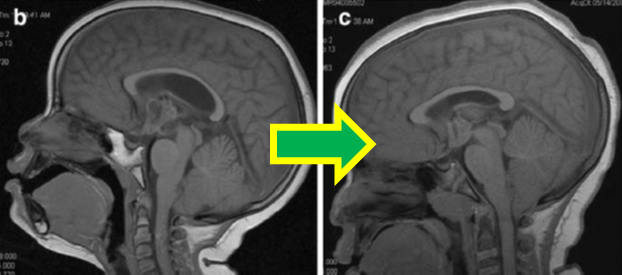
二次性頭蓋縫合早期癒合症は、何らかの疾患・治療の経過の中で生じてくる頭蓋縫合の異常閉鎖である。その多くはシャント過剰症候群に生じるとされ、頭蓋冠の成長停止とそれに伴う変形・容積縮小が問題になる。特に脳腫瘍の小児は水頭症でシャント造設をすることが多く留意を要する。また放射線治療後に早期癒合が生じた場合、骨成長の偏りから複雑な頭蓋奇形を呈し、後頭蓋窩照射の場合などはキアリ奇形様変化を来すという報告もある。しかし外科的アプローチは骨癒合不全や感染の問題から容易でなく、予防策が重要である。本研究ではこの課題に対応すべく、リスク因子と診断マーカーを探索している。特に組織非特異型ALPの活性が骨形成に寄与するため、血清ALP濃度に着目した。2013年以降、当院に入院した小児(0-15歳)で、開頭腫瘍摘出術後の40例について検証すると、初発時に水頭症がみられた26例のうち、二次性頭蓋縫合早期癒合を来したのは11例(42.3%)であった。一方、水頭症がなかった14例に早期癒合は生じなかった。また癒合例のうちシャント術を行っていたのは5例(45.5%)であった。癒合例ではいずれもALPが上昇した期間があったが、その時期に癒合が進行したとして矛盾しない経過だった。これらの結果より、腫瘍摘出術後の二次性頭蓋縫合早期癒合の発生は、術前の水頭症がリスクであることが有意に示された(P<0.01)。これは髄液の持続排出(シャント)のみならず、腫瘍摘出による単回の頭蓋内圧低下が二次性癒合の原因になることを示唆し、これまでの病態論を補完しうると考える。
また小児の放射線治療は発達遅滞に関する報告が多い一方で、二次性小頭症・早期癒合症の知見は乏しい。しかし本研究で約4割に二次性癒合変化が認められたことを鑑みると、腫瘍生存患者の発達への影響は検討に値する。よって腫瘍摘出術後の追跡では、頭蓋冠の形態にも留意する必要があり、初診時に水頭症があった例は特に気をつけねばならない。この際、微細な画像変化は捉えにくいが、血中ALP濃度がマーカーとして有用であると思われ、今後更に症例を蓄積して検討して行く予定である。(b:治療前、c:治療後(悪化傾向))
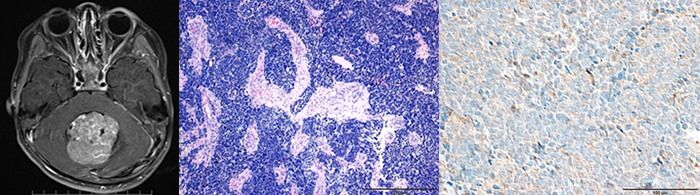
2) 再発髄芽腫のtemozolomde / irinotecan / bevacizumab三種併用療法の有効性と病理所見予測バイオマーカーの探索: 研究責任者 近藤五郎・(研究協力:脳腫瘍グループ;夏目敦至・本村和也・大岡史治)
髄芽腫の再発に対する標準治療は未だ確立しているとは言えない。今まで、再発髄芽腫の治療は、CefaloらによりTemozolomide(TMZ)の有効性が示された(Neuro Oncol 16:748-53, 2014)。次いでGrillらがTMZにCPT11を加えたregimenを報告したが、Cefaloらに比べて奏功率が悪かった。これはTMZの濃度が低いことが原因と考えられ、逆に、この研究で、再発髄芽腫におけるTMZの重要性が確認された(Neuro Oncol 15:1236-1243, 2013)。一方、AguileraらはCPT11とbevacizumab(Bev)を併用して長期生存した例を報告し、CPT11/BEVの有効性を示した(Pediatr Blood Cancer 56:491-494, 2011)。その後、TMZ/CPT11/Bevの3種併用療法が報告され、前述のregimenと比べて最も高い奏功率(55.6%)が提示された(Childs Nerv Syst 29:589-596, 2013)。この結果、髄芽腫再発例において、Temozolomide(TMZ) / irinotecan (CPT11) / bevacizumab(Bev) の三種併用療法は、今後の標準治療として期待がかかる。現在、当院ではこのプロトコールを再発髄芽腫の標準的治療としての可能性について検討している。今までに、このregimenを施行した4例に対して病理学的所見およびバイオマーカーを検討し、これらの予測因子の候補を探索した。病理学的にはdesmoplastic/nodular、MBEN、classic、anaplastic / large cell (LCA)の4型分類が言われており、近年は遺伝子解析に基づいた細分類も多用されているが、TMZ/CPT11/BEV療法の予測因子に関する見解はない。そこで我々は当院で本治療を施した症例について、免疫組織所見などを用いてVGEFを始めとするバイオマーカーとなり得る候補を網羅的に探索している。(添付図は、1)髄芽腫 画像(MRI T1WI Axial view Gd(+))、2)髄芽腫病理組織像(HE染色)、2)髄芽腫 免疫組織染色(VEGF(+))症例)
◎内視鏡・低侵襲グループ
1) 頭蓋内病変に対する新規内視鏡手術および周辺機器の開発: 研究責任者 竹内和人
内視鏡を用いた手術治療は脳神経外科領域においても広がりをみせている。約20年前に内視鏡下の経鼻的下垂体腫瘍摘出術が報告され、今後更に発展する領域である。本手術法を更に大きな腫瘍に、またより低侵襲に行うためには、新たな手術アプローチならびに周辺機器の開発が必要である。本プロジェクトの目標は以下の通りである。
- 内視鏡下経鼻拡大経蝶形骨法の適応拡大ならびに機器開発
現在すでに経鼻的軽蝶形骨法は下垂体腫瘍、鞍結節髄膜腫、頭蓋咽頭腫、脊索腫などに適応され多くの施設で行われるようになってきている。この術式は脳に触れることなく病変部にアプローチ可能であり非常に低侵襲であるといえる。しかしながら鼻腔を介した手術は操作空間が限られるため、その手術は中心部から外側に向かうにつれて難易度が高くなる。鼻腔内の知識をさらに深め、鼻腔内における新たなアプローチ法を開発することで本術式をさらに低侵襲に、さらに大きな腫瘍に対しても適応できるように開発をすすめる。また本手術には特殊は機器、例えば深部で曲がり回転するような鉗子の開発が必要である。我々は他大学、企業と協力しこれらの新たな手術機器の開発を手がけ、一部製品化に成功した。 - 内視鏡手術の脳腫瘍に対する応用とその機器開発
前述の内視鏡を用いた頭蓋底手術は世界的に大きく発展してきている。われわれはこの手術技術を応用して脳内病変の摘出にも取り組んでいる。6mm〜12mmの透明な筒を病変に向けて挿入し、その筒の中で摘出を完結させることで腫瘍周辺の脳の損傷を最小限に抑えられる。脳腫瘍手術をより低侵襲にすることが出来ると考えられるが、新規手術のため専用機器がないため開発が必要である。①同様に開発を行い、本手術法を世界に拡大することを目標とする。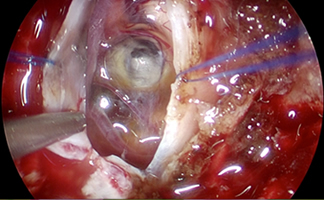
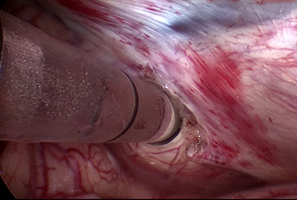
経鼻術の脳幹病変への応用。 シースを用いた脳腫瘍手術。
2) 線毛運動障害マウスを用いた水頭症発症要因の研究: 研究責任者 竹内和人
先天性水頭症は小児神経診療においてしばしば遭遇する疾患群である。先天性水頭症のうち、閉塞起点のないものを交通性水頭症といい、交通性水頭症の発症原因の一つに脳室上衣細胞に存在する線毛運動の障害があげられている。線毛は気管、卵管、脳室などの様々な体組織の細胞表面に多数存在する。線毛は特徴的な9+1構造を呈しておりダイニンの滑り運動にて周期的な回転運動をすることで表面にある物質の輸送に関与している。
線毛運動障害モデルマウスをもちいることで水頭症の成り立ちを知ることができる。線毛運動が障害されることで髄液還流が障害されやすい部位を検討するとともに、正常マウスにおける線毛運動も検討し線毛がどのように髄液循環形成に関与するかを検討する。
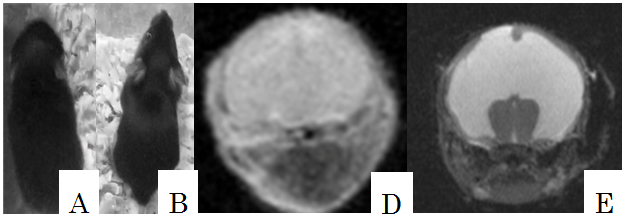
A、B:水頭症マウスと正常マウス。頭囲が拡大している。
D、E:水頭症マウスと正常マウスのMRI画像。脳室拡大が見られる。
◎脳血管内治療グループ
我々は常に臨床の場から生じた疑問を解決するためにそれに対する実験系を開発し、証明すると共に、その中から逆に治療法へのヒントや、新しい治療法が生まれ、それを臨床応用に結びつけようとしています。従って、基礎研究も常に臨床に密着した研究を目指しています。現在,以下のような研究を行っています.
基礎研究
- シリコンモデル、動物モデルにおける頭蓋内ステントの遮断の安全性について
Enterprise、Neuroformを始めとする頭蓋内ステントの遮断の可否と安全性についてシリコンモデルで確認ができました。生体内での安全性を検証するためにウサギにステントを留置し、ステントが新生内膜で覆われた時点でステントの遮断が可能であるかどうかの安全性を検証しています。 - シリコンモデル内でのカテーテル牽引力比較実験
NBCAやONYXなどの液体塞栓物質を注入した際にマイクロカテーテルが接着してしまい、マイクロカテーテルが抜去困難となり切断されてしまうトラブルが生じることがあり、抜去のために外科的治療の追加が必要となることがあります。引き抜く際に加える牽引力は血管の蛇行のためにマイクロカテーテルの先端部には一部しか伝達されず、マイクロカテーテルの材質によっても違いがあります。伝達性の違いをシリコンモデル内で比較検証しています。
- 動脈瘤コイル塞栓術におけるコイル挙動の観察
動脈瘤の塞栓術に使用されるコイルにはさまざまな特徴があります。それぞれのコイルの特徴を知るために、コイル模型を用いて挙動の観察実験を行っています。通常の血管内塞栓術施行時にはコイル挙動の観察が困難なフィリングコイルやフィニッシングコイルの特徴を、動脈瘤サイズ・形状や、コイルの充填率などの条件を変えて検討しています。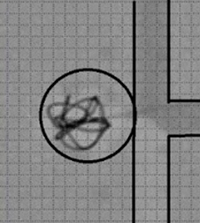
透明コイル内でのフィリングコイルの分布 - 血管内治療におけるバルーン拡張時の血管に及ぼす圧力の検討
脳動脈瘤の血管内動脈塞栓術において、コイル逸脱防止のためバルーンで支える方法をとることがあります。しかし、バルーンを拡張した時に血管を損傷する危険性があります。シリコンチューブを模擬血管として、拡張したバルーンの圧力を測定し、血管壁に力がかかりにくい安全なバルーンを検討しています。
バルーンをシリコンチューブ内で大きく拡張させると、バルーンの一部が膨隆する。
臨床研究
- 脊髄硬膜動静脈瘻と変性疾患との関連
脊髄硬膜動静脈瘻と脊椎変性疾患とのcomorbidityについて、静脈閉塞との相関を含めて解析したところ、病変側に突出するヘルニアや骨棘の合併を高率に認め、更に静脈閉塞の合併も比較的高率に認めました。脊髄硬膜動静脈瘻の成因との関連を示唆する所見と考えています。 - 未破裂脳動脈瘤の再発因子の検討
当院での多くの治療経験がある未破裂動脈瘤について、サイズ、部位などの因子を解析しています。動脈瘤のサイズ・コイル密度が再発と有意に相関する一方、太い一次コイル径の有用性は認められませんでした。 - 頚部内頚動脈狭窄症に対するステント留置術のリスク因子の検討
頚動脈狭窄症に対する治療には、直達術である内膜剥離術(CEA)と血管内治療であるステント留置術(CAS)があります。当院での蓄積データをもとに、CASを施行する場合のハイリスクな因子を検討し、より安全な治療方針を明らかにしていきます - ステント併用下脳動脈瘤コイル塞栓術後の長期成績からみた至適抗血小板療法の検討
広頚部脳動脈瘤の血管内治療において脳動脈瘤用ステントを用いたコイル塞栓術が主流となっていますが、治療時には2種類の抗血小板剤内服が必須であります。中長期的に、抗血小板剤をどのタイミングで2剤から1剤へ減量するか(DAPT-ACE studyが進行中)、また抗血小板剤の中止は可能であるかなどまだ確立していないという問題があります。当院でのステント併用下脳動脈瘤コイル塞栓術を施行した症例を長期間経過観察し、抗血小板薬の減量、中止の至適時期につき、血栓性及び出血性合併症を、リスク因子の検討ともに解析しています。 - 脳血管内治療後の穿刺部出血の検討
術後穿刺部出血はベッド上の安静時間を長期化させ、入院期間が延長する主原因の一つです。仮性動脈瘤が生じることもあり手術を要する場合もあります。発症の危険因子を明らかにし、かつベッド上の安静時間の短縮を図るために後方視的に解析を行いました。本研究の結果を穿刺部出血の予防と入院期間の短縮の両立に役立てています。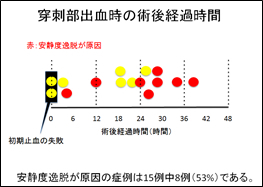
- 海綿静脈洞部の硬膜動静脈瘻におけるシャントパウチの位置の検討
硬膜動静脈瘻を超選択的に塞栓するためには正確にシャントパウチを同定する必要があります。シャントパウチの静脈洞への開口部の分布を後方視的に解析しています。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 齋藤 竜太 | 教授 | 脳神経外科学 |
| 水野 正明 | 病院教授 | 先端医療開発部 先端医療・臨床研究支援センター |
| 泉 孝嗣 | 准教授(脳血管内治療学) | 脳神経外科学(脳血管障害) |
| 本村 和也 | 准教授(脳神経外科学) | 脳神経外科学(脳腫瘍) |
| 伊藤 英治 | 講師 | 脳神経外科学(脳腫瘍) |
| 西村 由介 | 講師 | 脳神経外科学(脊椎・脊髄) |
| 種井 隆文 | 病院講師 | 脳神経外科学(痛み、パーキンソン病、てんかん) |
| 大岡 史治 | 講師 | 脳神経外科学(脳腫瘍) |
| 竹内 和人 | 病院講師 | 脳神経外科学(神経内視鏡) |
| 永田 雄一 | 助教 | 脳神経外科学(神経内視鏡) |
| 横山 欣也 | 助教 | 脳神経外科学(脳血管障害) |
| 西堀 正洋 | 病院助教 | 脳神経外科学(脳血管障害) |
| 永島 吉孝 | 病院助教 | 脳神経外科学(脊椎・脊髄) |
| 石﨑 友崇 | 病院助教 | 脳神経外科学(パーキンソン病、てんかん) |
| 金森 史哲 | 特任助教 | 脳神経外科学(脳血管障害) |
研究実績
- 2016年
- Takeuchi K, Watanabe T, Nagatani T, Nagata Y, Chu J, Wakabayashi T. Incidence and risk factors of subdural hematoma after intraoperative cerebrospinal fluid leakage during the transsphenoidal approach. Pituitary, 2016.
- Nagata Y, Takeuchi K, Kato M, Osawa H, Watanabe T, Wakabayashi T. The "steppingstone" phenomenon: a new endoscopic finding in slit-ventricle syndrome. Childs Nerv Syst, 2016.
- Nagata Y, Takeuchi K, Kato M, Chu J, Wakabayashi T. Lateral temporal encephaloceles: case-based review. Childs Nerv Syst, 2016; 32: 1025-1031.
- Muraoka S, Araki Y, Izumi T, Takeuchi K, Okamoto S, Wakabayashi T. Cerebral Infarction and Subarachnoid Hemorrhage Caused by Central Nervous System Aspergillus Infection. World Neurosurg, 2016; 90: 705.e709-705.e713.
- Maesawa S, Bagarinao E, Fujii M, Futamura M, Wakabayashi T. Use of Network Analysis to Establish Neurosurgical Parameters in Gliomas and Epilepsy. Neurol Med Chir (Tokyo), 2016; 56: 158-169.
- Shiina S, Ohno M, Ohka F, Kuramitsu S, Yamamichi A, Kato A, Motomura K, Tanahashi K, Yamamoto T, Watanabe R, Ito I, Senga T, Hamaguchi M, Wakabayashi T, Kaneko MK, Kato Y, Chandramohan V, Bigner DD, Natsume A. CAR T Cells Targeting Podoplanin Reduce Orthotopic Glioblastomas in Mouse Brains. Cancer Immunol Res, 2016; 4: 259-268.
- Kurimoto M, Suzuki H, Aoki K, Ohka F, Kondo G, Motomura K, Iijima K, Yamamichi A, Ranjit M, Wakabayashi T, Kimura S, Natsume A. Rapid sensitive analysis of IDH1 mutation in lower-grade gliomas by automated genetic typing involving a quenching probe. Cancer Invest, 2016; 34: 12-15.
- Nagata Y, Takeuchi K, Nagatani T, Watanabe T, Sato Y, Tambara M, Wakabayashi T. Bilateral occlusion of the foramina of Monro after endoscopic third ventriculostomy for aqueductal stenosis--a case report. Childs Nerv Syst, 2016; 32: 739-743.
- Maesawa S, Fujii M, Futamura M, Hayashi Y, Iijima K, Wakabayashi T. A case of secondary somatosensory epilepsy with a left deep parietal opercular lesion: successful tumor resection using a transsubcentral gyral approach during awake surgery. J Neurosurg, 2016; 124: 791-798.
- Asai T, Miyachi S, Izumi T, Matsubara N, Haraguchi K, Yamanouchi T, Ota K, Shintai K, Tajima H, Wakabayashi T. Relationship between low response to clopidogrel and periprocedural ischemic events with coil embolization for intracranial aneurysms. J Neurointerv Surg, 2016; 8: 752-755.
- Motomura K, Chalise L. [Update Knowledge for Brain Tumors(9)Peripheral Nerve Tumor]. No Shinkei Geka, 2016; 44: 699-709.
- Motomura K NA, Iijima K, Kuramitsu S, Fujii M, Yamamoto T, Maesawa S, Sugiura J, Wakabayashi T. Surgical benefits of combined awake craniotomy and intraoperative magnetic resonance imaging for gliomas associated with eloquent areas. J Neurosurg, 2016; in press.
- 2015年
- Kajita Y, Nakatsubo D, Kataoka H, Nagai T, Nakura T, Wakabayashi T. Installation of a Neuromate Robot for Stereotactic Surgery: Efforts to Conform to Japanese Specifications and an Approach for Clinical Use-Technical Notes. Neurol Med Chir (Tokyo), 2015; 55: 907-914.
- Takeuchi K, Nagatani T, Wakabayashi T. How I do it: shoelace watertight dural closure in extended transsphenoidal surgery. Acta Neurochir (Wien), 2015; 157: 2089-2092.
- Yamamuro S, Sano E, Okamoto Y, Ochiai Y, Ohta T, Ogino A, Natsume A, Wakabayashi T, Ueda T, Hara H, Nakayama T, Yoshino A, Katayama Y. Antitumorigenic effect of interferon-beta by inhibition of undifferentiated glioblastoma cells. Int J Oncol, 2015; 47: 1647-1654.
- Momota H, Kato S, Fujii M, Tsujiuchi T, Takahashi Y, Kojima S, Wakabayashi T. Primary peripheral T-cell lymphoma, not otherwise specified, of the central nervous system in a child. Brain Tumor Pathol, 2015; 32: 281-285.
- Tsuboi T, Watanabe H, Tanaka Y, Ohdake R, Yoneyama N, Hara K, Ito M, Hirayama M, Yamamoto M, Fujimoto Y, Kajita Y, Wakabayashi T, Sobue G. Characteristic laryngoscopic findings in Parkinson's disease patients after subthalamic nucleus deep brain stimulation and its correlation with voice disorder. J Neural Transm (Vienna), 2015; 122: 1663-1672.
- Takanari K, Araki Y, Okamoto S, Sato H, Yagi S, Toriyama K, Yokoyama K, Murotani K, Matsui S, Wakabayashi T, Kamei Y. Operative wound-related complications after cranial revascularization surgeries. J Neurosurg, 2015; 123: 1145-1150.
- Ranjit M, Motomura K, Ohka F, Wakabayashi T, Natsume A. Applicable advances in the molecular pathology of glioblastoma. Brain Tumor Pathol, 2015; 32: 153-162.
- Tanahashi K, Natsume A, Ohka F, Motomura K, Alim A, Tanaka I, Senga T, Harada I, Fukuyama R, Sumiyoshi N, Sekido Y, Wakabayashi T. Activation of Yes-Associated Protein in Low-Grade Meningiomas Is Regulated by Merlin, Cell Density, and Extracellular Matrix Stiffness. J Neuropathol Exp Neurol, 2015; 74: 704-709.
- Tanei T, Kajita Y, Wakabayashi T. [Pharmacological treatment and neuromodulation therapy for central neuropathic pain: current trend and issue of spinal cord stimulation]. No Shinkei Geka, 2015; 43: 507-515.
- Makino K, Osuka K, Watanabe Y, Usuda N, Hara M, Aoyama M, Takayasu M, Wakabayashi T. Increased ICP promotes CaMKII-mediated phosphorylation of neuronal NOS at Ser(8)(4)(7) in the hippocampus immediately after subarachnoid hemorrhage. Brain Res, 2015; 1616: 19-25.
- Ohkawa Y, Momota H, Kato A, Hashimoto N, Tsuda Y, Kotani N, Honke K, Suzumura A, Furukawa K, Ohmi Y, Natsume A, Wakabayashi T, Furukawa K. Ganglioside GD3 Enhances Invasiveness of Gliomas by Forming a Complex with Platelet-derived Growth Factor Receptor alpha and Yes Kinase. J Biol Chem, 2015; 290: 16043-16058.
- Suzuki H, Aoki K, Chiba K, Sato Y, Shiozawa Y, Shiraishi Y, Shimamura T, Niida A, Motomura K, Ohka F, Yamamoto T, Tanahashi K, Ranjit M, Wakabayashi T, Yoshizato T, Kataoka K, Yoshida K, Nagata Y, Sato-Otsubo A, Tanaka H, Sanada M, Kondo Y, Nakamura H, Mizoguchi M, Abe T, Muragaki Y, Watanabe R, Ito I, Miyano S, Natsume A, Ogawa S. Mutational landscape and clonal architecture in grade II and III gliomas. Nat Genet, 2015; 47: 458-468.
- Fujii M, Maesawa S, Motomura K, Futamura M, Hayashi Y, Koba I, Wakabayashi T. Intraoperative subcortical mapping of a language-associated deep frontal tract connecting the superior frontal gyrus to Broca's area in the dominant hemisphere of patients with glioma. J Neurosurg, 2015; 122: 1390-1396.
- Uozumi Y, Okamoto S, Araki Y, Izumi T, Matsubara N, Yokoyama K, Sumitomo M, Miyachi S, Wakabayashi T. Treatment of Symptomatic Bilateral Cavernous Carotid Aneurysms: Long-term Results of 6 Cases. J Stroke Cerebrovasc Dis, 2015; 24: 1013-1018.
- Hiroyuki M, Ogino J, Takahashi A, Hasegawa T, Wakabayashi T. Rhabdoid glioblastoma: an aggressive variaty of astrocytic tumor. Nagoya J Med Sci, 2015; 77: 321-328.
- Tanei T, Fujii M, Takebayashi S, Nakahara N, Wakabayashi T. [Supratentorial-infraoccipital approach supported by navigation and intraoperative magnetic resonance imaging for glioma located at the medial posterior temporal lobe: two case reports]. No Shinkei Geka, 2015; 43: 241-246.
- Matsubara N, Miyachi S, Izumi T, Yamanouchi T, Asai T, Ota K, Wakabayashi T. Results and current trends of multimodality treatment for infectious intracranial aneurysms. Neurol Med Chir (Tokyo), 2015; 55: 155-162.
- Tanaka Y, Tsuboi T, Watanabe H, Kajita Y, Fujimoto Y, Ohdake R, Yoneyama N, Masuda M, Hara K, Senda J, Ito M, Atsuta N, Horiguchi S, Yamamoto M, Wakabayashi T, Sobue G. Voice features of Parkinson's disease patients with subthalamic nucleus deep brain stimulation. J Neurol, 2015; 262: 1173-1181.
- Maesawa S, Bagarinao E, Fujii M, Futamura M, Motomura K, Watanabe H, Mori D, Sobue G, Wakabayashi T. Evaluation of resting state networks in patients with gliomas: connectivity changes in the unaffected side and its relation to cognitive function. PLoS One, 2015; 10: e0118072.
- Sugiyama M, Hasegawa H, Ito S, Sugiyama K, Maeda M, Aoki K, Wakabayashi T, Hamaguchi M, Natsume A, Senga T. Paired related homeobox 1 is associated with the invasive properties of glioblastoma cells. Oncol Rep, 2015; 33: 1123-1130.
- Maruwaka M, Yoshikawa K, Okamoto S, Araki Y, Sumitomo M, Kawamura A, Yokoyama K, Wakabayashi T. Biomarker research for moyamoya disease in cerebrospinal fluid using surface-enhanced laser desorption/ionization time-of-flight mass spectrometry. J Stroke Cerebrovasc Dis, 2015; 24: 104-111.
- Tsuboi T, Watanabe H, Tanaka Y, Ohdake R, Yoneyama N, Hara K, Nakamura R, Watanabe H, Senda J, Atsuta N, Ito M, Hirayama M, Yamamoto M, Fujimoto Y, Kajita Y, Wakabayashi T, Sobue G. Distinct phenotypes of speech and voice disorders in Parkinson's disease after subthalamic nucleus deep brain stimulation. J Neurol Neurosurg Psychiatry, 2015; 86: 856-864.
- Iwami K, Momota H, Fujii M, Natsume A, Yagi S, Toriyama K, Kamei Y, Wakabayashi T. Anaplastic meningioma with rapid growth after omental flap transposition: a case report and experimental study. Brain Tumor Pathol, 2015; 32: 137-144.
- 2014年
- Tanei T, Morita Y, Yashima A, Wakita H, Takebayashi S, Nakahara N, Wakabayashi T. [Severe rhabdomyolysis and intracranial hemorrhage associated with synthetic cannabinoid: a case report]. No Shinkei Geka, 2014; 42: 867-871.
- Tanahashi K, Natsume A, Ohka F, Momota H, Kato A, Motomura K, Watabe N, Muraishi S, Nakahara H, Saito Y, Takeuchi I, Wakabayashi T. Assessment of tumor cells in a mouse model of diffuse infiltrative glioma by Raman spectroscopy. Biomed Res Int, 2014; 2014: 860241.
- Tanei T, Takebayashi S, Nakahara N, Nagatani T, Wakabayashi T. [Biopsy of brain parenchymal lesions: procedure selection and ingenuity of accurate and safety biopsy]. No Shinkei Geka, 2014; 42: 837-840.
- Nishimura Y, Hara M, Nakajima Y, Haimoto S, Yamamoto Y, Wakabayashi T. Outcomes and complications following posterior long lumbar fusions exceeding three levels. Neurol Med Chir (Tokyo), 2014; 54: 707-715.
- Umebayashi D, Hara M, Nishimura Y, Wakabayashi T. A morphologically atypical case of atlantoaxial rotatory subluxation. J Korean Neurosurg Soc, 2014; 55: 284-288.
- Takeuchi K, Nagatani T, Okumura E, Wakabayashi T. A novel method for managing water and electrolyte balance after transsphenoidal surgery: preliminary study of moderate water intake restriction. Nagoya J Med Sci, 2014; 76: 73-82.
- Momota H, Fujii M, Tatematsu A, Shimoyama Y, Tsujiuchi T, Ohno M, Natsume A, Wakabayashi T. Papillary glioneuronal tumor with a high proliferative component and minigemistocytes in a child. Neuropathology, 2014; 34: 484-490.
- Ohka F, Ito M, Ranjit M, Senga T, Motomura A, Motomura K, Saito K, Kato K, Kato Y, Wakabayashi T, Soga T, Natsume A. Quantitative metabolome analysis profiles activation of glutaminolysis in glioma with IDH1 mutation. Tumour Biol, 2014; 35: 5911-5920.
- Umebayashi D, Natsume A, Takeuchi H, Hara M, Nishimura Y, Fukuyama R, Sumiyoshi N, Wakabayashi T. Blockade of gap junction hemichannel protects secondary spinal cord injury from activated microglia-mediated glutamate exitoneurotoxicity. J Neurotrauma, 2014; 31: 1967-1974.
- Tsujiuchi T, Natsume A, Motomura K, Kondo G, Ranjit M, Hachisu R, Sugimura I, Tomita S, Takehara I, Woolley M, Barua NU, Gill SS, Bienemann AS, Yamashita Y, Toyokuni S, Wakabayashi T. Preclinical evaluation of an O(6)-methylguanine-DNA methyltransferase-siRNA/liposome complex administered by convection-enhanced delivery to rat and porcine brains. Am J Transl Res, 2014; 6: 169-178.
- Yamashita Y, Ito Y, Isomura H, Takemura N, Okamoto A, Motomura K, Tsujiuchi T, Natsume A, Wakabayashi T, Toyokuni S, Tsurumi T. Lack of presence of the human cytomegalovirus in human glioblastoma. Mod Pathol, 2014; 27: 922-929.
- Okochi Y, Nihashi T, Fujii M, Kato K, Okada Y, Ando Y, Maesawa S, Takebayashi S, Wakabayashi T, Naganawa S. Clinical use of (11)C-methionine and (18)F-FDG-PET for germinoma in central nervous system. Ann Nucl Med, 2014; 28: 94-102.
- Arima H, Wakabayashi T, Nagatani T, Fujii M, Hirakawa A, Murase T, Yambe Y, Yamada T, Yamakawa F, Yamamori I, Yamauchi M, Oiso Y. Adipsia increases risk of death in patients with central diabetes insipidus. Endocr J, 2014; 61: 143-148.
- Miyachi S, Matsubara N, Izumi T, Asai T, Yamanouchi T, Ota K, Oda K, Wakabayashi T. The 'one and a half round microcatheterization technique' for stent-assisted coil embolization of intracranial aneurysm: technical case series. J Neurointerv Surg, 2014; 6: 357-362.
- 2013年
- Matsubara N, Miyachi S, Okamaoto T, Izumi T, Asai T, Yamanouchi T, Ota K, Oda K, Wakabayashi T. Spinal cord infarction is an unusual complication of intracranial neuroendovascular intervention. Interv Neuroradiol, 2013; 19: 500-505.
- Nakahara N, Takebayashi S, Tanei T, Hirano M, Fujii M, Wakabayashi T. [Image-guided surgery for motor eloquent area glioma supported by intraoperative MRI]. No Shinkei Geka, 2013; 41: 1047-1063.
- Wakabayashi T, Natsume A, Fujii M. [Chemotherapy for malignant gliomas: an update]. Gan To Kagaku Ryoho, 2013; 40: 1283-1287.
- Umebayashi D, Hara M, Nakajima Y, Nishimura Y, Wakabayashi T. Posterior fixation for atlantoaxial subluxation in a case with complex anomaly of persistent first intersegmental artery and assimilation in the C1 vertebra. Neurol Med Chir (Tokyo), 2013; 53: 882-886.
- Nishimura Y, Hara M, Natsume A, Nakajima Y, Fukuyama R, Wakabayashi T, Ginsberg HJ. Spinal intradural cystic venous angioma originating from a nerve root in the cauda equina. J Neurosurg Spine, 2013; 19: 716-720.
- Miyachi S, Matsubara N, Izumi T, Asai T, Yamanouchi T, Ota K, Oda K, Wakabayashi T. Stent/balloon combination assist technique for wide-necked basilar terminal aneurysms. Interv Neuroradiol, 2013; 19: 299-305.
- Asai T, Miyachi S, Izumi T, Matsubara N, Yamanouchi T, Ota K, Oda K, Wakabayashi T. [Systematic review of complications for proper informed consent (9) periprocedural complications of carotid artery stenting: a review article]. No Shinkei Geka, 2013; 41: 719-729.
- Tanei T, Kajita Y, Noda H, Takebayashi S, Hirano M, Nakahara N, Wakabayashi T. [Efficacy of tramadol/acetaminophen medication for central post-stroke pain]. No Shinkei Geka, 2013; 41: 679-685.
- Tanei T, Nagatani T, Nakahara N, Watanabe T, Nishihata T, Nielsen ML, Takebayashi S, Hirano M, Wakabayashi T. Use of high-field intraoperative magnetic resonance imaging during endoscopic transsphenoidal surgery for functioning pituitary microadenomas and small adenomas located in the intrasellar region. Neurol Med Chir (Tokyo), 2013; 53: 501-510.
- Nakajima Y, Hara M, Makino K, Umebayashi D, Wakabayashi T. [A case of far lateral lumbar disk herniation treated with Transforaminal Lumbar Interbody Fusion(TLIF)]. No Shinkei Geka, 2013; 41: 629-636.
- Hasegawa H, Hyodo T, Asano E, Ito S, Maeda M, Kuribayashi H, Natsume A, Wakabayashi T, Hamaguchi M, Senga T. The role of PLK1-phosphorylated SVIL in myosin II activation and cytokinetic furrowing. J Cell Sci, 2013; 126: 3627-3637.
- Natsume A, Ito M, Katsushima K, Ohka F, Hatanaka A, Shinjo K, Sato S, Takahashi S, Ishikawa Y, Takeuchi I, Shimogawa H, Uesugi M, Okano H, Kim SU, Wakabayashi T, Issa JP, Sekido Y, Kondo Y. Chromatin regulator PRC2 is a key regulator of epigenetic plasticity in glioblastoma. Cancer Res, 2013; 73: 4559-4570.
- Matsubara N, Miyachi S, Tsukamoto N, Kojima T, Izumi T, Haraguchi K, Asai T, Yamanouchi T, Ota K, Wakabayashi T. Endovascular intervention for acute cervical carotid artery occlusion. Acta Neurochir (Wien), 2013; 155: 1115-1123.
- Fujitani S, Matsuda K, Nakamura F, Baba K, Usui N, Tottori T, Mihara T, Terada K, Usui K, Inoue Y, Kajita Y, Wakabayashi T. Statistical parametric mapping of interictal 123I-iomazenil SPECT in temporal lobe epilepsy surgery. Epilepsy Res, 2013; 106: 173-180.
- Jiang Z, Nimura Y, Hayashi Y, Kitasaka T, Misawa K, Fujiwara M, Kajita Y, Wakabayashi T, Mori K. Anatomical annotation on vascular structure in volume rendered images. Comput Med Imaging Graph, 2013; 37: 131-141.
- Gupta R, Miyachi S, Matsubara N, Izumi T, Naito T, Haraguchi K, Wakabayashi T. A unique type of dural arteriovenous fistula at confluence of sinuses treated with endovascular embolization: a case report. Neurointervention, 2013; 8: 34-40.
- Ando H, Natsume A, Iwami K, Ohka F, Kuchimaru T, Kizaka-Kondoh S, Ito K, Saito K, Sugita S, Hoshino T, Wakabayashi T. A hypoxia-inducible factor (HIF)-3alpha splicing variant, HIF-3alpha4 impairs angiogenesis in hypervascular malignant meningiomas with epigenetically silenced HIF-3alpha4. Biochem Biophys Res Commun, 2013; 433: 139-144.
- Iwami K, Natsume A, Ohno M, Ikeda H, Mineno J, Nukaya I, Okamoto S, Fujiwara H, Yasukawa M, Shiku H, Wakabayashi T. Adoptive transfer of genetically modified Wilms' tumor 1-specific T cells in a novel malignant skull base meningioma model. Neuro Oncol, 2013; 15: 747-758.
- Kajita Y, Yoshida K, Nagai T, Wakabayashi T. [Mood States in outpatients with lesional epilepsy at the neurosurgical clinic and improvement in mood States after lamotrigine addiction]. No Shinkei Geka, 2013; 41: 209-218.
- Nagasaka T, Inao S, Wakabayashi T. What does the CT angiography "spot sign" of intracerebral hemorrhage mean in modern neurosurgical settings with minimally invasive endoscopic techniques? Neurosurg Rev, 2013; 36: 341-348.
- Yamada Y, Nakamura S, Ito K, Umemura E, Hara K, Nagasaka T, Abe A, Baba S, Furuichi Y, Izumi Y, Klein OD, Wakabayashi T. Injectable bone tissue engineering using expanded mesenchymal stem cells. Stem Cells, 2013; 31: 572-580.
- Gupta R, Miyachi S, Matsubara N, Izumi T, Naito T, Haraguchi K, Wakabayashi T. Pial arteriovenous fistula as a cause of bilateral thalamic hyperintensities--an unusual case report and review of the literature. J Neurol Surg A Cent Eur Neurosurg, 2013; 74 Suppl 1: e18-24.
- Nishimura Y, Natsume A, Ito M, Hara M, Motomura K, Fukuyama R, Sumiyoshi N, Aoki I, Saga T, Lee HJ, Wakabayashi T, Kim SU. Interferon-beta delivery via human neural stem cell abates glial scar formation in spinal cord injury. Cell Transplant, 2013; 22: 2187-2201.
- Motomura K, Mittelbronn M, Paulus W, Brokinkel B, Keyvani K, Sure U, Wrede K, Nakazato Y, Tanaka Y, Nonoguchi N, Pierscianek D, Kim YH, Mariani L, Vital A, Perry A, Ohgaki H. PDGFRA gain in low-grade diffuse gliomas. J Neuropathol Exp Neurol, 2013; 72: 61-66.
- Pierscianek D, Kim YH, Motomura K, Mittelbronn M, Paulus W, Brokinkel B, Keyvani K, Wrede K, Nakazato Y, Tanaka Y, Mariani L, Vital A, Sure U, Ohgaki H. MET gain in diffuse astrocytomas is associated with poorer outcome. Brain Pathol, 2013; 23: 13-18.
- 2012年
- Nagai T, Kajita Y, Maesawa S, Nakatsubo D, Yoshida K, Kato K, Wakabayashi T. Preoperative regional cerebral blood flow and postoperative clinical improvement in patients with Parkinson's disease undergoing subthalamic nucleus deep brain stimulation. Neurol Med Chir (Tokyo), 2012; 52: 865-872.
- Nishimura Y, Hara M, Natsume A, Takemoto M, Fukuyama R, Wakabayashi T. Intra-extradural dumbbell-shaped hemangioblastoma manifesting as subarachnoid hemorrhage in the cauda equina. Neurol Med Chir (Tokyo), 2012; 52: 659-665.
- Tanei T, Nakahara N, Takebayashi S, Hirano M, Nagatani T, Nishihata T, Wakabayashi T. Endoscopic biopsy for lesions located in the parenchyma of the brain: preoperative planning based on stereotactic methods. Technical note. Neurol Med Chir (Tokyo), 2012; 52: 617-621.
- Tanemura E, Nagatani T, Aimi Y, Kishida Y, Takeuchi K, Wakabayashi T. Quality of life in nonfunctioning pituitary macroadenoma patients before and after surgical treatment. Acta Neurochir (Wien), 2012; 154: 1895-1902.
- Okada Y, Nihashi T, Fujii M, Kato K, Okochi Y, Ando Y, Yamashita M, Maesawa S, Takebayashi S, Wakabayashi T, Naganawa S. Differentiation of newly diagnosed glioblastoma multiforme and intracranial diffuse large B-cell Lymphoma using (11)C-methionine and (18)F-FDG PET. Clin Nucl Med, 2012; 37: 843-849.
- Motomura K, Natsume A, Watanabe R, Ito I, Kato Y, Momota H, Nishikawa R, Mishima K, Nakasu Y, Abe T, Namba H, Nakazato Y, Tashiro H, Takeuchi I, Mori T, Wakabayashi T. Immunohistochemical analysis-based proteomic subclassification of newly diagnosed glioblastomas. Cancer Sci, 2012; 103: 1871-1879.
- Uozumi Y, Sumitomo M, Maruwaka M, Araki Y, Izumi T, Miyachi S, Kato T, Hasegawa T, Kida Y, Okamoto S, Wakabayashi T. Moyamoya syndrome associated with gamma knife surgery for cerebral arteriovenous malformation: case report. Neurol Med Chir (Tokyo), 2012; 52: 343-345.
- Ohno M, Natsume A, Wakabayashi T. Cytokine therapy. Adv Exp Med Biol, 2012; 746: 86-94.
- Haraguchi K, Miyachi S, Izumi T, Matsubara N, Naito T, Asai T, Yamanouchi T, Wakabayashi T. [Resistance to antiplatelet agents assessed by a point-of-care platelet function test and thromboembolic adverse events in neurointervention]. No Shinkei Geka, 2012; 40: 399-406.
- Ohka F, Natsume A, Wakabayashi T. Current trends in targeted therapies for glioblastoma multiforme. Neurol Res Int, 2012; 2012: 878425.
- Tanei T, Nakahara N, Takebayashi S, Hirano M, Wakabayashi T. Simultaneous surgical resections of two distant metastatic malignant melanoma lesions--case report. Nagoya J Med Sci, 2012; 74: 173-179.
- Tanei T, Nakahara N, Takebayashi S, Hirano M, Kajita Y, Wakabayashi T. [Dual lead spinal cord stimulation using octad lead for central post-stroke pain]. No Shinkei Geka, 2012; 40: 325-329.
- Iwami K, Shimato S, Ohno M, Okada H, Nakahara N, Sato Y, Yoshida J, Suzuki S, Nishikawa H, Shiku H, Natsume A, Wakabayashi T. Peptide-pulsed dendritic cell vaccination targeting interleukin-13 receptor alpha2 chain in recurrent malignant glioma patients with HLA-A*24/A*02 allele. Cytotherapy, 2012; 14: 733-742.
- Naito T, Miyachi S, Matsubara N, Isoda H, Izumi T, Haraguchi K, Takahashi I, Ishii K, Wakabayashi T. Magnetic resonance fluid dynamics for intracranial aneurysms--comparison with computed fluid dynamics. Acta Neurochir (Wien), 2012; 154: 993-1001.
- Kishida Y, Natsume A, Toda H, Toi Y, Motomura K, Koyama H, Matsuda K, Nakayama O, Sato M, Suzuki M, Kondo Y, Wakabayashi T. Correlation between quantified promoter methylation and enzymatic activity of O6-methylguanine-DNA methyltransferase in glioblastomas. Tumour Biol, 2012; 33: 373-381.
- Iwami K, Momota H, Natsume A, Kinjo S, Nagatani T, Wakabayashi T. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. J Neurosurg, 2012; 116: 630-635.
- Kishida Y, Natsume A, Kondo Y, Takeuchi I, An B, Okamoto Y, Shinjo K, Saito K, Ando H, Ohka F, Sekido Y, Wakabayashi T. Epigenetic subclassification of meningiomas based on genome-wide DNA methylation analyses. Carcinogenesis, 2012; 33: 436-441.
- Motomura K, Mittelbronn M, Paulus W, Brokinkel B, Keyvani K, Sure U, Wrede K, Nakazato Y, Tanaka Y, Pierscianek D, Kim YH, Mariani L, Vital A, Ohgaki H. DMBT1 homozygous deletion in diffuse astrocytomas is associated with unfavorable clinical outcome. J Neuropathol Exp Neurol, 2012; 71: 702-707.
- 2011年
- Wakabayashi T. [Clinical trial updates for malignant brain tumors]. Rinsho Shinkeigaku, 2011; 51: 853-856.
- Hayashi S, Osuka K, Watanabe Y, Yasuda M, Takayasu M, Wakabayashi T. Hypothermia enhances the colocalization of calmodulin kinase IIalpha with neuronal nitric oxide synthase in the hippocampus following cerebral ischemia. Neurosci Lett, 2011; 505: 228-232.
- Ohka F, Natsume A, Motomura K, Kishida Y, Kondo Y, Abe T, Nakasu Y, Namba H, Wakai K, Fukui T, Momota H, Iwami K, Kinjo S, Ito M, Fujii M, Wakabayashi T. The global DNA methylation surrogate LINE-1 methylation is correlated with MGMT promoter methylation and is a better prognostic factor for glioma. PLoS One, 2011; 6: e23332.
- Motomura K, Natsume A, Fujii M, Ito M, Momota H, Wakabayashi T. Long-term survival in patients with newly diagnosed primary central nervous system lymphoma treated with dexamethasone, etoposide, ifosfamide and carboplatin chemotherapy and whole-brain radiation therapy. Leuk Lymphoma, 2011; 52: 2069-2075.
- Iwami K, Natsume A, Wakabayashi T. Cytokine networks in glioma. Neurosurg Rev, 2011; 34: 253-263; discussion 263-254.
- Fujii M, Miyachi S, Matsubara N, Kinkori T, Takebayashi S, Izumi T, Ohshima T, Tsurumi A, Hososhima O, Wakabayashi T, Yoshida J. Selective propofol injection into the M1 segment of the middle cerebral artery (MCA Wada test) reduces adverse effects and enhances the reliability of the Wada test for determining speech dominance. World Neurosurg, 2011; 75: 503-508.
- Ichikawa T, Miyachi S, Izumi T, Matsubara N, Naito T, Haraguchi K, Wakabayashi T, Koketsu N. Fenestration of a supraclinoid internal carotid artery associated with dual aneurysms: case report. Neurosurgery, 2011; 69: E1005-1008; discussion E1009.
- Nagasaka T, Tsugeno M, Ikeda H, Okamoto T, Inao S, Wakabayashi T. A novel monoshaft bipolar cautery for use in endoscopic intracranial surgery. A short technical note. Clin Neurol Neurosurg, 2011; 113: 607-611.
- Motomura K, Natsume A, Kishida Y, Higashi H, Kondo Y, Nakasu Y, Abe T, Namba H, Wakai K, Wakabayashi T. Benefits of interferon-beta and temozolomide combination therapy for newly diagnosed primary glioblastoma with the unmethylated MGMT promoter: A multicenter study. Cancer, 2011; 117: 1721-1730.
- Wakabayashi T, Kayama T, Nishikawa R, Takahashi H, Hashimoto N, Takahashi J, Aoki T, Sugiyama K, Ogura M, Natsume A, Yoshida J. A multicenter phase I trial of combination therapy with interferon-beta and temozolomide for high-grade gliomas (INTEGRA study): the final report. J Neurooncol, 2011; 104: 573-577.
- Natsume A, Kinjo S, Yuki K, Kato T, Ohno M, Motomura K, Iwami K, Wakabayashi T. Glioma-initiating cells and molecular pathology: implications for therapy. Brain Tumor Pathol, 2011; 28: 1-12.
- Tanei T, Nakahara N, Takebayashi S, Ito M, Hashizume Y, Wakabayashi T. Primary angiitis of the central nervous system mimicking tumor-like lesion--case report. Neurol Med Chir (Tokyo), 2011; 51: 56-59.
- Tanei T, Kajita Y, Noda H, Takebayashi S, Nakatsubo D, Maesawa S, Wakabayashi T. Efficacy of motor cortex stimulation for intractable central neuropathic pain: comparison of stimulation parameters between post-stroke pain and other central pain. Neurol Med Chir (Tokyo), 2011; 51: 8-14.
- Momota H, Iwami K, Fujii M, Motomura K, Natsume A, Ogino J, Hasegawa T, Wakabayashi T. Rhabdoid glioblastoma in a child: case report and literature review. Brain Tumor Pathol, 2011; 28: 65-70.
- Matsubara N, Miyachi S, Tsukamoto N, Izumi T, Naito T, Haraguchi K, Wakabayashi T. Endovascular coil embolization for saccular-shaped blood blister-like aneurysms of the internal carotid artery. Acta Neurochir (Wien), 2011; 153: 287-294.
- Mitsui T, Fujii M, Tsuzaka M, Hayashi Y, Asahina Y, Wakabayashi T. Skin shift and its effect on navigation accuracy in image-guided neurosurgery. Radiol Phys Technol, 2011; 4: 37-42.
- Nagasaka T, Tsugeno M, Ikeda H, Okamoto T, Inao S, Wakabayashi T. Early recovery and better evacuation rate in neuroendoscopic surgery for spontaneous intracerebral hemorrhage using a multifunctional cannula: preliminary study in comparison with craniotomy. J Stroke Cerebrovasc Dis, 2011; 20: 208-213.
- Matsubara N, Miyachi S, Nagano Y, Ohshima T, Hososhima O, Izumi T, Tsurumi A, Wakabayashi T, Sano A, Fujimoto H. Evaluation of the characteristics of various types of coils for the embolization of intracranial aneurysms with an optical pressure sensor system. Neuroradiology, 2011; 53: 169-175.
- 2010年
- Maesawa S, Fujii M, Nakahara N, Watanabe T, Wakabayashi T, Yoshida J. Intraoperative tractography and motor evoked potential (MEP) monitoring in surgery for gliomas around the corticospinal tract. World Neurosurg, 2010; 74: 153-161.
- Araki Y, Yoshikawa K, Okamoto S, Sumitomo M, Maruwaka M, Wakabayashi T. Identification of novel biomarker candidates by proteomic analysis of cerebrospinal fluid from patients with moyamoya disease using SELDI-TOF-MS. BMC Neurol, 2010; 10: 112.
- Mizuno M, Wakabayashi T. [Brain tumor]. Nihon Rinsho, 2010; 68 Suppl 8: 623-626.
- Natsume A, Motomura K, Wakabayashi T. [The genome atlas of brain tumors]. Nihon Rinsho, 2010; 68 Suppl 8: 473-480.
- Iwami K, Natsume A, Wakabayashi T. Gene therapy for high-grade glioma. Neurol Med Chir (Tokyo), 2010; 50: 727-736.
- Ohno M, Natsume A, Ichiro Iwami K, Iwamizu H, Noritake K, Ito D, Toi Y, Ito M, Motomura K, Yoshida J, Yoshikawa K, Wakabayashi T. Retrovirally engineered T-cell-based immunotherapy targeting type III variant epidermal growth factor receptor, a glioma-associated antigen. Cancer Sci, 2010; 101: 2518-2524.
- Ito E, Saito K, Nagatani T, Ishiyama J, Terada K, Yoshida M, Wakabayashi T. Intradural cranial chordoma. World Neurosurg, 2010; 73: 194-197; discussion e131.
- Motomura K, Ogura M, Natsume A, Yokoyama H, Wakabayashi T. A free-radical scavenger protects the neural progenitor cells in the dentate subgranular zone of the hippocampus from cell death after X-irradiation. Neurosci Lett, 2010; 485: 65-70.
- Tanei T, Takebayashi S, Nishihata T, Nakahara N, Wakabayashi T. [Removal of an arteriovenous malformation near the pyramidal tract using the neuronavigation system: a case report]. No Shinkei Geka, 2010; 38: 745-750.
- Tanei T, Kajita Y, Wakabayashi T. Motor cortex stimulation for intractable neuropathic facial pain related to multiple sclerosis. Neurol Med Chir (Tokyo), 2010; 50: 604-607.
- Natsume A, Kondo Y, Ito M, Motomura K, Wakabayashi T, Yoshida J. Epigenetic aberrations and therapeutic implications in gliomas. Cancer Sci, 2010; 101: 1331-1336.
- Tanaka Y, Yu Q, Doumoto K, Sano A, Hayashi Y, Fujii M, Kajita Y, Mizuno M, Wakabayashi T, Fujimoto H. Development of a real-time tactile sensing system for brain tumor diagnosis. Int J Comput Assist Radiol Surg, 2010; 5: 359-367.
- Watanabe Y, Hayashi Y, Fujii M, Kimura M, Sugiura A, Tsuzaka M, Wakabayashi T. [Development of automatic navigation measuring system using template-matching software in image guided neurosurgery]. Nihon Hoshasen Gijutsu Gakkai Zasshi, 2010; 66: 131-136.
- Nakajima Y, Osuka K, Seki Y, Gupta RC, Hara M, Takayasu M, Wakabayashi T. Taurine reduces inflammatory responses after spinal cord injury. J Neurotrauma, 2010; 27: 403-410.
- 2009年
- Wakabayashi T, Fujii M, Kajita Y, Natsume A, Maezawa S, Yoshida J. Advanced new neurosurgical procedure using integrated system of intraoperative MRI and neuronavigation with multimodal neuroradiological images. Nagoya J Med Sci, 2009; 71: 101-107.
- Tanei T, Kajita Y, Nihashi T, Kaneoke Y, Takebayashi S, Nakatsubo D, Wakabayashi T. Changes in regional blood flow induced by unilateral subthalamic nucleus stimulation in patients with Parkinson's disease. Neurol Med Chir (Tokyo), 2009; 49: 507-513.
- Ohno M, Natsume A, Kondo Y, Iwamizu H, Motomura K, Toda H, Ito M, Kato T, Wakabayashi T. The modulation of microRNAs by type I IFN through the activation of signal transducers and activators of transcription 3 in human glioma. Mol Cancer Res, 2009; 7: 2022-2030.
- Nagasaka T, Tsugeno M, Ikeda H, Okamoto T, Takagawa Y, Inao S, Wakabayashi T. Balanced irrigation-suction technique with a multifunctional suction cannula and its application for intraoperative hemorrhage in endoscopic evacuation of intracerebral hematomas: technical note. Neurosurgery, 2009; 65: E826-827; discussion E827.
- Ito E, Saito K, Nagatani T, Teranishi M, Aimi Y, Wakabayashi T. Cavernous sinus thrombophlebitis caused by porphyromonas gingivalis with abscess formation extending to the orbital cavity. Case report. Neurol Med Chir (Tokyo), 2009; 49: 370-373.
- Maesawa S, Fujii M, Nakahara N, Watanabe T, Saito K, Kajita Y, Nagatani T, Wakabayashi T, Yoshida J. Clinical indications for high-field 1.5 T intraoperative magnetic resonance imaging and neuro-navigation for neurosurgical procedures. Review of initial 100 cases. Neurol Med Chir (Tokyo), 2009; 49: 340-349; discussion 349-350.
- Fujii M, Wakabayashi T. [Image-guided neurosurgery using intraoperative MRI]. Brain Nerve, 2009; 61: 823-834.
- Natsume A, Kondo Y, Wakabayashi T. [Epigenetic analyses of brain tumor stem cells]. Brain Nerve, 2009; 61: 791-798.
- Watanabe Y, Fujii M, Hayashi Y, Kimura M, Murai Y, Hata M, Sugiura A, Tsuzaka M, Wakabayashi T. Evaluation of errors influencing accuracy in image-guided neurosurgery. Radiol Phys Technol, 2009; 2: 120-125.
- Yuki K, Natsume A, Yokoyama H, Kondo Y, Ohno M, Kato T, Chansakul P, Ito M, Kim SU, Wakabayashi T. Induction of oligodendrogenesis in glioblastoma-initiating cells by IFN-mediated activation of STAT3 signaling. Cancer Lett, 2009; 284: 71-79.
- Tanei T, Kajita Y, Kaneoke Y, Takebayashi S, Nakatsubo D, Wakabayashi T. Staged bilateral deep brain stimulation of the subthalamic nucleus for the treatment of Parkinson's disease. Acta Neurochir (Wien), 2009; 151: 589-594.
- Ohno M, Natsume A, Fujii M, Ito M, Wakabayashi T. Interferon-beta, MCNU, and conventional radiotherapy for pediatric patients with brainstem glioma. Pediatr Blood Cancer, 2009; 53: 37-41.
- Matsubara N, Miyachi S, Nagano Y, Ohshima T, Hososhima O, Izumi T, Tsurumi A, Wakabayashi T, Sakaguchi M, Sano A, Fujimoto H. A novel pressure sensor with an optical system for coil embolization of intracranial aneurysms. Laboratory investigation. J Neurosurg, 2009; 111: 41-47.
- Wakabayashi T, Natsume A, Hatano H, Fujii M, Shimato S, Ito M, Ohno M, Ito S, Ogura M, Yoshida J. p16 promoter methylation in the serum as a basis for the molecular diagnosis of gliomas. Neurosurgery, 2009; 64: 455-461; discussion 461-452.
- Ito M, Natsume A, Takeuchi H, Shimato S, Ohno M, Wakabayashi T, Yoshida J. Type I interferon inhibits astrocytic gliosis and promotes functional recovery after spinal cord injury by deactivation of the MEK/ERK pathway. J Neurotrauma, 2009; 26: 41-53.
- Kurimoto F, Saito K, Watanabe T, Nagatani T, Nishiwaki K, Wakabayashi T, Iwase S. Preliminary measurement of intraoperative sympathetic nerve activity using microneurography and laser Doppler flowmetry during surgical resection of suprasellar tumors. Neurol Med Chir (Tokyo), 2009; 49: 13-21.
- Oi S, Natsume A, Ito M, Kondo Y, Shimato S, Maeda Y, Saito K, Wakabayashi T. Synergistic induction of NY-ESO-1 antigen expression by a novel histone deacetylase inhibitor, valproic acid, with 5-aza-2'-deoxycytidine in glioma cells. J Neurooncol, 2009; 92: 15-22.
- 2008年
- Wakabayashi T, Kayama T, Nishikawa R, Takahashi H, Yoshimine T, Hashimoto N, Aoki T, Kurisu K, Natsume A, Ogura M, Yoshida J. A multicenter phase I trial of interferon-beta and temozolomide combination therapy for high-grade gliomas (INTEGRA Study). Jpn J Clin Oncol, 2008; 38: 715-718.
- Shimato S, Natsume A, Wakabayashi T, Tsujimura K, Nakahara N, Ishii J, Ito M, Akatsuka Y, Kuzushima K, Yoshida J. Identification of a human leukocyte antigen-A24-restricted T-cell epitope derived from interleukin-13 receptor alpha2 chain, a glioma-associated antigen. J Neurosurg, 2008; 109: 117-122.
- Natsume A, Wakabayashi T, Tsujimura K, Shimato S, Ito M, Kuzushima K, Kondo Y, Sekido Y, Kawatsura H, Narita Y, Yoshida J. The DNA demethylating agent 5-aza-2'-deoxycytidine activates NY-ESO-1 antigenicity in orthotopic human glioma. Int J Cancer, 2008; 122: 2542-2553.
- Wakabayashi T. [Treatment of marignant brain tumor: today and tomorrow]. No Shinkei Geka, 2008; 36: 81-82.
- Wakabayashi T, Natsume A, Hashizume Y, Fujii M, Mizuno M, Yoshida J. A phase I clinical trial of interferon-beta gene therapy for high-grade glioma: novel findings from gene expression profiling and autopsy. J Gene Med, 2008; 10: 329-339.
- Natsume A, Wakabayashi T, Ishii D, Maruta H, Fujii M, Shimato S, Ito M, Yoshida J. A combination of IFN-beta and temozolomide in human glioma xenograft models: implication of p53-mediated MGMT downregulation. Cancer Chemother Pharmacol, 2008; 61: 653-659.
- 2007年
- Takeuchi H, Natsume A, Wakabayashi T, Aoshima C, Shimato S, Ito M, Ishii J, Maeda Y, Hara M, Kim SU, Yoshida J. Intravenously transplanted human neural stem cells migrate to the injured spinal cord in adult mice in an SDF-1- and HGF-dependent manner. Neurosci Lett, 2007; 426: 69-74.
- Ishii D, Natsume A, Wakabayashi T, Hatano H, Asano Y, Takeuchi H, Shimato S, Ito M, Fujii M, Yoshida J. Efficacy of temozolomide is correlated with 1p loss and methylation of the deoxyribonucleic acid repair gene MGMT in malignant gliomas. Neurol Med Chir (Tokyo), 2007; 47: 341-349; discussion 350.
- Nakane Y, Natsume A, Wakabayashi T, Oi S, Ito M, Inao S, Saito K, Yoshida J. Malignant transformation-related genes in meningiomas: allelic loss on 1p36 and methylation status of p73 and RASSF1A. J Neurosurg, 2007; 107: 398-404.
- Ito M, Wakabayashi T, Natsume A, Hatano H, Fujii M, Yoshida J. Genetically heterogeneous glioblastoma recurring with disappearance of 1p/19q losses: case report. Neurosurgery, 2007; 61: E168-169; discussion E169.
- Tsuno T, Natsume A, Katsumata S, Mizuno M, Fujita M, Osawa H, Nakahara N, Wakabayashi T, Satoh Y, Inagaki M, Yoshida J. Inhibition of Aurora-B function increases formation of multinucleated cells in p53 gene deficient cells and enhances anti-tumor effect of temozolomide in human glioma cells. J Neurooncol, 2007; 83: 249-258.
- 2006年
- Wakabayashi T, Natsume A, Yoshida J. [Glioma]. Nihon Rinsho, 2006; 64: 1327-1332.
- Hatano H, Wakabayashi T, Yoshida J. [Pineal lesion tumors (germinoma)]. Nihon Rinsho, 2006; Suppl 1: 178-182.
- Shimato S, Mitsudomi T, Kosaka T, Yatabe Y, Wakabayashi T, Mizuno M, Nakahara N, Hatano H, Natsume A, Ishii D, Yoshida J. EGFR mutations in patients with brain metastases from lung cancer: association with the efficacy of gefitinib. Neuro Oncol, 2006; 8: 137-144.
- Shimato S, Wakabayashi T, Mizuno M, Nakahara N, Hatano H, Natsume A, Ishii D, Hasegawa Y, Hyodo I, Nagasaka T, Yoshida J. Brain metastases from apocrine carcinoma of the scalp: case report. J Neurooncol, 2006; 77: 285-289.
- 2005年
- Wakabayashi T, Saito K, Yoshida J. [Neurofibromatosis ]. Nihon Rinsho, 2005; 63 Suppl 9: 164-169.
- Natsume A, Ishii D, Wakabayashi T, Tsuno T, Hatano H, Mizuno M, Yoshida J. IFN-beta down-regulates the expression of DNA repair gene MGMT and sensitizes resistant glioma cells to temozolomide. Cancer Res, 2005; 65: 7573-7579.
- Arima T, Natsume A, Hatano H, Nakahara N, Fujita M, Ishii D, Wakabayashi T, Doyu M, Nagasaka T, Yoshida J. Intraventricular chordoid meningioma presenting with Castleman disease due to overproduction of interleukin-6. Case report. J Neurosurg, 2005; 102: 733-737.
- 2004年
- Fujita M, Mizuno M, Nagasaka T, Wakabayashi T, Maeda K, Ishii D, Arima T, Kawajiri A, Inagaki M, Yoshida J. Aurora-B dysfunction of multinucleated giant cells in glioma detected by site-specific phosphorylated antibodies. J Neurosurg, 2004; 101: 1012-1017.
- Yoshida J, Mizuno M, Wakabayashi T. Interferon-beta gene therapy for cancer: basic research to clinical application. Cancer Sci, 2004; 95: 858-865.
- Yoshida J, Mizuno M, Fujii M, Kajita Y, Nakahara N, Hatano M, Saito R, Nobayashi M, Wakabayashi T. Human gene therapy for malignant gliomas (glioblastoma multiforme and anaplastic astrocytoma) by in vivo transduction with human interferon beta gene using cationic liposomes. Hum Gene Ther, 2004; 15: 77-86.
- 2003年
- Takasu S, Takahashi T, Okamoto S, Oriuchi N, Nakayashiki N, Okamoto K, Muramatsu H, Hayashi T, Nakahara N, Mizuno M, Wakabayashi T, Higuchi T, Endo K, Kozaki K, Miyaishi O, Saga S, Ueda R, Yoshida J, Yoshikawa K. Radioimmunoscintigraphy of intracranial glioma xenograft with a technetium-99m-labeled mouse monoclonal antibody specifically recognizing type III mutant epidermal growth factor receptor. J Neurooncol, 2003; 63: 247-256.
- Nakahara N, Pollack IF, Storkus WJ, Wakabayashi T, Yoshida J, Okada H. Effective induction of antiglioma cytotoxic T cells by coadministration of interferon-beta gene vector and dendritic cells. Cancer Gene Ther, 2003; 10: 549-558.
- Maeda K, Mizuno M, Wakabayashi T, Takasu S, Nagasaka T, Inagaki M, Yoshida J. Morphological assessment of the development of multinucleated giant cells in glioma by using mitosis-specific phosphorylated antibodies. J Neurosurg, 2003; 98: 854-859.
- Ito A, Shinkai M, Honda H, Yoshikawa K, Saga S, Wakabayashi T, Yoshida J, Kobayashi T. Heat shock protein 70 expression induces antitumor immunity during intracellular hyperthermia using magnetite nanoparticles. Cancer Immunol Immunother, 2003; 52: 80-88.
- 2002年
- Ohno T, Wakabayashi T, Takemura A, Yoshida J, Ito A, Shinkai M, Honda H, Kobayashi T. Effective solitary hyperthermia treatment of malignant glioma using stick type CMC-magnetite. In vivo study. J Neurooncol, 2002; 56: 233-239.
研究キーワード
低悪性度神経膠腫、最大規模ゲノム解析、次世代シークエンサー、ポドプラニン、キメラ遺伝子改変T細胞受容体T細胞療法、イムノウォールIDH1遺伝子変異迅速マイクロ診断デバイス、経頭蓋磁気刺激、覚醒下機能マッピング、覚醒下手術、術中MRI、島回機能研究、もやもや病、一酸化窒素合成酵素、内視鏡、低侵襲手術、機器開発、水頭症、線毛運動異常、ダイニン、脳波―安静時機能的MRI同時記録、定位手術ロボット、MRIガイド超音波集束治療、てんかん、パーキンソン病、本態性振戦、髄芽腫、後天性キアリ1型様奇形、硬膜動静脈瘻、計算流体力学、医工連携
大学院生、研修医、医学生の皆さんへ
例えば、脳神経外科の手術の中で、脳腫瘍の手術は、基本的には可能な限り腫瘍を完全に切除するのだが、機能予後を考慮すると全摘出が容易な症例は必ずしも多くはない。先進的画像診断技術と術中支援システムの統合により、腫瘍進展範囲と優位機能領域との関係を術前に明らかにすることもある程度可能だが、浸潤性脳腫瘍の場合、腫瘍境界が術前には不明確であることも少なくない。このようなときに、術前画像情報を用いてニューロナビゲーション手術へどのように応用しているか、更には術中MRIによってブレインシフトを補正する事で機能欠落を生じない最大限の腫瘍切除と機能温存を可能とする最新脳神経外科手術を駆使しなくてはならない。また、脳内の的確な位置に製剤を投与する為の脳神経外科ロボット”Neuro Mate(ニューロメイト)“の登場により、薬物の脳内拡散を最大限にするConvection enhanced delivery(CED)法の応用で、次世代治療法としてLipofection法によるsiRNAを用いた核酸医薬の開発を目指している。これらナノパーティクルを脳内に的確に投与するナノサージェリー(nanosurgery)の世界はこれから、脳神経外科領域を大きく変革する契機になると期待されている・・・・・。
さて、脳神経外科の手術は、1960年代の手術顕微鏡の導入、80年代の頭部CT、90年代のMRIの普及に伴う画像診断技術の著しい向上により目覚ましい進歩を遂げた。しかしながら神経膠腫を代表とする浸潤性脳実質内腫瘍は、高倍率の手術顕微鏡をもってしても腫瘍の境界を同定することが困難で、MRI等に描出された腫瘍を正確に摘出することは必ずしも容易でない。これらの腫瘍に対する手術では、90年代に導入が始まった、ニューロナビゲーションを基本技術とする、画像誘導手術の発展が欠かせない。更には、脳診断画像の進歩により術前診断、手術戦略立案、術中支援に役立つ。MRI像については標準的であるT1強調像、T2強調像、FLAIR画像の他に拡散強調画像、ADC (Apparent Diffusion Coefficient)map、DTI(Diffusion Tensor Imaging)、T2*、MR Spectroscopy、functional MRI、MR Angiographyなどがすでに臨床応用され、術前の組織診断及び機能局在診断に威力を発揮している。また、FDG-PET、Methionine-PETに代表されるPET検査、SPECT検査等核医学検査、脳磁図が利用可能であり、病変部位の同定に役立っている。更に、X線CT検査も最近ではmultislice herical CTの普及がある。これらの多様な画像とコンピューター工学の進歩により、3D virtual imageなどの画像解析技術が手術技術の向上に多大な貢献をしている。
術中診断モダリティーとして、1995年にPeter Blackが米国ボストンのBrigham and Women’s Hospital, Harvard Medical Schoolにおいて世界で初めて術中MRIを導入した。その後、様々な術中MRI手術室が導入されているが、2006年に、名古屋大学の吉田純教授らは”Brain THEATER”と名付けられた手術支援システムを構築した。Brain THEATERはHITACHI製のopen MRIユニット(0.4 Tesla APERTO)を核とし、ナビゲーションシステム・手術顕微鏡・神経生理学的モニタリングシステム等周辺機器が一体となって機能し、安全でかつ高度な近未来型手術室を導入した。この術中MRI手術室に隣接してコントロールルームが設置され、MRI撮像、手術計画の立案、手術映像配信などの機能を持つ(図1)。
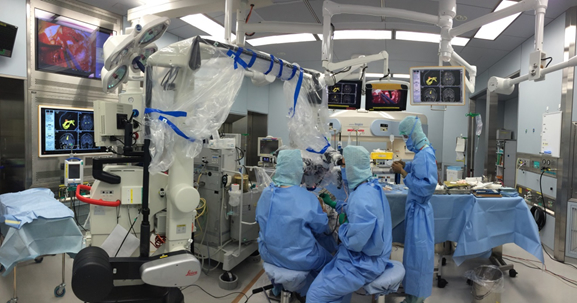
図1:脳神経外科手術室 ”Brain Theater”での実際の手術風景
手術時には、術直前に撮影したMRI画像、PET画像等の融合画像をニューロナビゲーションへ登録し、これを用いて手術計画の立案を実施。その後、ナビゲーションの誘導に従って、開頭、顕微鏡下手術を順次遂行し、あらかじめ設定した標的に向かって手術を進める。(図2)
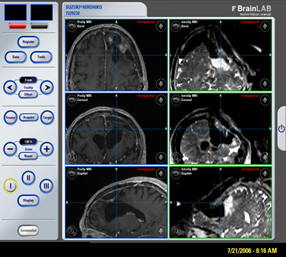
図2:ナビゲーション画面上に描出されている術前標的(左)と摘出後の術中画像(右)。
しかし、それでもなお、現存の治療では治癒に至る事のない難治性疾患が山積されているのが脳神経外科領域の現状である。当大学医学部附属病院には、平成16年に設立された「遺伝子・再生医療センター」のインフラ整備に伴い、平成17年にはバイオマテリアル調整部門が設立され、平成18年にはシステム管理体制として国際標準化機構ISO9001:2000およびISO13485:2003認証を取得した。そこには、遺伝子治療ユニット、細胞治療ユニット、再生ユニットおよび産学連携ユニットがあり、GMPに準拠したリポソームの院内製造も可能である。平成22年度には、当センターは臨床研究支援センターと統合した形の、「先端医療・臨床研究支援センター」となり、先端医療でのデータマネジメントシステムも、CRC(Clinical Research Coordinator)が管理する体制も整備された。この統合により、臨床データの管理及び解析能力が格段に向上し、今後の先端利用開発における臨床情報解析が極めて質の高いレベルで実施されるようになった。(図3)
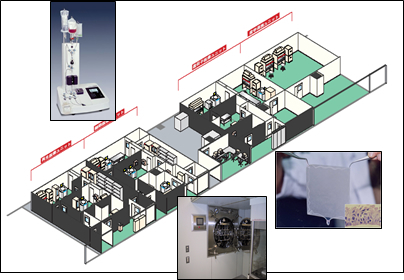
図3:名古屋大学医学部附属病院先端医療・臨床研究支援センターバイオマテリアル調整部門
医工連携による技術革新に裏打ちされ、様々な脳神経疾患に対する分子標的の発見に伴う、分子イメージングから、その標的を目掛けての分子標的治療の開発は、脳神経外科領域の難治性疾患に対して新たな挑戦が始まっている。
さて、当名古屋大学医学部脳神経外科教室の歴史は古く、日本脳神経外科学会の開拓者・齋藤眞教授より始まる。その後、景山直樹教授は脳腫瘍学・脳内分泌学を確立し、杉田虔一郎教授は脳神経外科の顕微鏡手術の確立・スギタクリップ等の脳神経外科手術機器開発に中心的役割を果たした。吉田 純教授は生命科学・医用工学の進歩を取り入れ、脳腫瘍の遺伝子治療、細胞・再生医療や、脳血管内治療の開拓に尽力するとともに、コンピューターを駆使した新たな画像診断技術を脳神経外科手術室に導入した。この手術室はBrainTHEATERと呼ばれ、術中MRIやナビゲーションを駆使した高度な画像誘導手術が可能となりました。平成20年6月からは若林俊彦教授のもと、近未来型脳神経外科手術装置の開発、コンピュータシュミレーションモデルを用いた脳外科疾患診断と脳外科手術支援、遺伝子治療、核酸医療、再生医療、細胞療法等の先端医療開発に力を注ぎ、治療成績の向上に取り組んでいる。平成23年度には、アジア初となる脳神経外科手術ロボット“Neuro Mate”が導入されました。分子生物学的研究の成果とコンピューター技術の融合により、分子イメージング開発、新規手術機器開発、及び新しい個別化及び層別化医療の実現と分子標的薬の開発による治療の向上を目指している。このような活気溢れる教室に、君たちのエネルギーを注ぎ込み、思いっきり新たな世界へ向かって羽ばたく未来を創造しようではないか。来たれ若者!