微生物・免疫学 分子細胞免疫学 (免疫学)
概要
免疫系は自己・非自己を識別し、微生物などの非自己を排除するだけでなく、広範な生命機能に関わり、生体の恒常性を保つのみならず、妊娠の成立などにも重要な役割を果たしている。しかし、過剰な免疫応答はアレルギーや自己免疫疾患を引き起こし、不十分な免疫応答は慢性感染症、発がんへとつながる。とりわけ、がんにおいては、免疫系は異常細胞を排除し発がんを抑制しているが(免疫監視)、がん細胞はやがて自身の免疫原性を低下させることなどに加えて、様々な免疫抑制機構を獲得することで免疫系から逃避し(免疫逃避)、臨床的な「がん」となる。当教室では、免疫系が保つ生体の恒常性と免疫異常によりもたらされる様々な病態を理解することでダイナミックな生命現象としての免疫系の本態にせまり、免疫監視から免疫逃避という免疫学の最も重要な課題の理解につなげる基礎からトランスレーショナル(橋渡し)研究までを進めている。
研究プロジェクト
1. T細胞の多様性に着目した新規がん免疫療法に関する研究
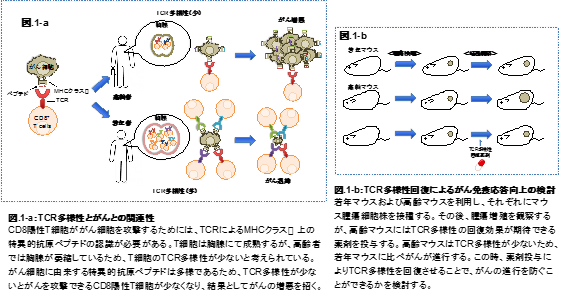
がん環境下では様々な免疫細胞が機能し、がん細胞の排除あるいはがん細胞の生存維持に関わっている。とりわけ、がん細胞の排除に関わる免疫細胞としてCD8陽性T細胞(CD8+T cells)が存在する。CD8+T cellsはT細胞受容体(TCR)による抗原認識および副刺激により活性化し、がん細胞を選択的に攻撃することができる。一方で、がん環境は免疫チェックポイント分子・免疫抑制細胞・サイトカインの作用により免疫抑制状態を作り出し、その結果がん細胞はCD8+ T cellsの攻撃から逃れている。がんに対する免疫応答が減弱する理由としてこのようながんの逃避機構が考えられるが、がん局所に浸潤しているCD8+ T cellsの多様性が少ないことも要因である。CD8+ T cellsはそれぞれ一つの細胞につき一種類のTCRを発現し、TCRの種類によりCD8+ T cellsの多様性が決まる。TCRは抗原決定基(エピトープ)と呼ばれる抗原の一部を認識するため、CD8+ T cellsの多様性が高いほど抗原に反応できるCD8+ T cell数が増える。
我々は、このCD8+ T cellsの多様性に着目した新たながん免疫療法の開発に向けた研究をおこなっている。研究アプローチとして、TCRの多様性が低い高齢マウスを用いた実験を試みている。T細胞は胸腺にて発達するため、胸腺でのTCRの分化に関わる分子に着目し、その分子を薬剤により制御することでTCRの多様性を回復させ、がん細胞を攻撃できるCD8+ T cellsを増加させる。その後、既存の免疫療法による治療をおこない、治療効果が向上するか否かを検討する。
2. 免疫チェックポイント阻害剤を利用した新規がん免疫療法の開発
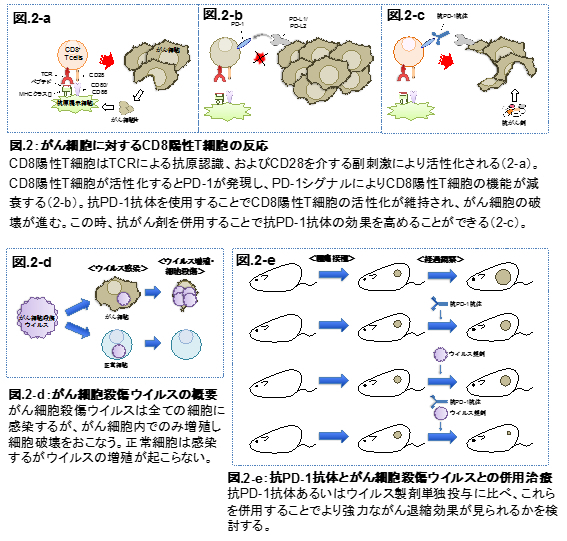
免疫チェックポイント分子はT細胞が活性化されると発現し、T細胞の機能を負に制御する。これにより、T細胞の過剰な活性化による自己免疫応答を抑えている。一方で、がん環境下においては免疫チェックポイント分子シグナルが入り易く、T細胞が抑制状態に維持されるため、がん細胞への免疫応答が原弱している。近年がん免疫治療薬として注目されている抗PD-1抗体は、免疫チェックポイント分子であるPD-1のシグナルを阻害する抗体医薬であり、これによってCD8+ T cellsの活性化が維持され、抗腫瘍免疫応答が増強される。抗PD-1抗体は難治性がん患者に対し劇的な効果を示しているが、その効果は限定的であるため、その効果を向上させる治療薬との併用治療法が期待されている。現在の臨床研究では標準治療として使用されている抗がん剤との併用療法が進められており、一定の延命効果が報告されている。我々は動物モデルを用い、新規併用治療法の候補となり得る薬剤の探索を進めている。中でも、新たながん治療薬として期待されているウイルス製剤との併用治療法の開発を進めている。
3. 免疫細胞に関連する転写因子の新たな制御機構の解明
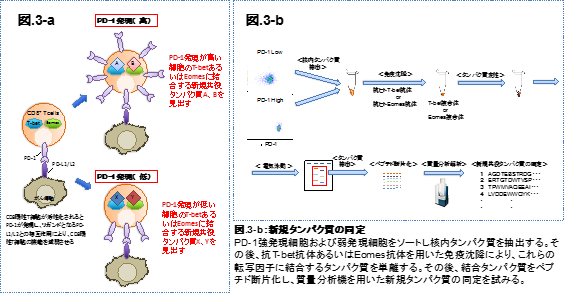
生命活動を司る遺伝子の発現には様々な転写因子が働いている。免疫細胞においても同様であり、細胞の分化、機能、遊走等に関わる遺伝子発現も転写因子により制御されている。免疫抑制細胞として中心的役割を担う制御性T細胞(Tregs)において、その機能制御に重要な働きをしているFOXP3も転写因子であり、Tregsを見分ける分子マーカーとしても知られている。また、CD8+ T cellsの機能維持に重要な働きをする転写因子としてT-betおよびEomesが知られており、これらの発現差異により活性化の強さや生存性が制御されている。本研究ではこれらの細胞に存在する転写因子に着目し、がん局所あるいはT細胞の抗原への応答性の差異において、これらの転写因子の新たな制御機構の解明を目指している。本研究では、上記転写因子に対する抗体を用いた免疫沈降からタンパク質複合体を精製し、これらを質量分析にて解析し、新規タンパク質の同定を試みている。
4. がん患者検体を用いたがん免疫臨床研究
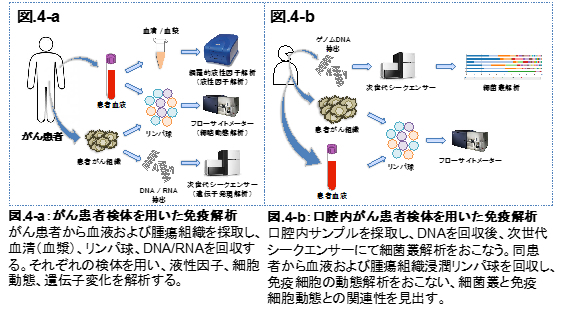
より良い免疫療法を開発するためには、がん患者体内の免疫応答を解析することが重要である。我々は各内科および外科教室と協力し、がん患者から血液またはがん組織を採取できる環境を整えている。患者体内において末梢血とがん局所のそれぞれに存在する免疫細胞の動態が異なるため、血液とがん組織の免疫細胞を比較することで、がん局所の免疫応答を増強できる新たな知見が得られると考えられる。また、抗CTLA-4抗体あるいは抗PD-1抗体を投与された患者由来の検体も入手しており、抗体治療前後での免疫応答の変化を解析することで、抗体治療に効果のある患者の選別や、自己免疫疾患発症の原因解明が可能になると考えている。さらに、腸内細菌あるいは口腔内細菌の解析も進めており、これらの細菌叢と免疫応答とのあらたな相関性を見出すことを目的としている。
5. 鈴木准教授のグループはCD8+CD122+細胞に関する免疫学研究を行っている。CD122はIL-2受容体β鎖で、マウスCD8+細胞中の10%くらいはCD122を元から発現している。そして、CD4+細胞のうちCD25すなわちIL-2受容体α鎖を発現している細胞が制御性T細胞である、これは坂口志文博士が見つけたが、なんとCD8+細胞中のCD122を発現している細胞も制御性T細胞であることを私(鈴木)が発表したのが2004年だからもう10年以上前になる。それよりさらに前の1995年、私はCD122のKOマウスを作り、そこから20年以上CD122やこのCD8+CD122+細胞に関わる研究をしてきた。
現在の研究テーマは、少しこの細胞の発見当初とは違ってきているが、以下の様な内容に分かれ、広がっている。
i) 制御性T細胞としてのCD8+CD122+細胞
a) 細胞集団を絞り込んでより純粋な制御性細胞を得られるようにする。そのためのマーカーとしてCD49dが見つかったが、引き続きその他の候補もマイクロアレイ等を使って検索中である。できればCD4+Tregのfoxp3に相当するものをCD8+でも見つけたい。
b)制御のメカニズムとしてはFas/FasL経路を使用した活性化T細胞の細胞死誘導が主体と考えられるが他のメカニズム(IL-10などのサイトカイン)も否定できない。
c)ヒトのCD8+制御性T細胞
ヒトのCD8+ 細胞の様相はマウスとはかなり異なっている。まずCD8+細胞の他にCD8dim細胞が存在し、それらはTCR−CD122highであるのでNK細胞であるとわかる。そしてCD8+細胞の中にはCD122high の細胞はいない。そこで、マイクロアレイ法を駆使しCD8+CD122+細胞とCD8+CD122−細胞との比較で見つかってきた遺伝子がcxcr3であった。果たして、抗ヒトCXCR3抗体は、ヒト末梢血CD8+細胞の10〜20%を染め、マウスにおいてはCD8+CD122+細胞とほぼ同じ集団に限られて発現していた。以上のデータはCXCR3がヒトでマウスCD122の代わりに使えることを示すものと思われる。
d)骨髄移植後の免疫異常を予防もしくは抑制するT細胞
遺伝的背景が同一の個体間の移植(Syngeneic Transplantation) においては、通常免疫応答は起こらない(寛容状態になる)と考えられるが、実際はFasもしくはFasL を欠失したマウス(lprマウスやgldマウス)を使って骨髄移植を行うと酷い皮膚炎を起こしたり肺炎を起こして死亡したりする(我々の独自の実験結果。まだ論文発表されていない)。これは、移植片や宿主に対して免疫系が反応して起こったことではなく、外来性の抗原に対する免疫応答がうまく制御できていないためのように考えられる。このlprやgldマウスを用いた骨髄移植の実験系を発展させ、どの細胞が皮膚炎や肺炎の防止・抑制に働いているかを明らかにする(CD8+CD122+CD49dlow細胞である可能性はかなり高いと思われる。)。混合骨髄移植でgld yやlpr のパートナーとして、野生型マウスの他にCD8KOやCD4KO、その結果を見ながら目的の細胞を絞りこんでいくことが可能である。(目的の細胞はCD8+であると言うプレリミナリーな結果が出ている)。この最終的結果を示せば、骨髄移植後のGVHD(移植片対宿主病)と思われている免疫異常に対して、CD8+制御性T細胞の細胞療法を適応させることが現実味を帯びてくるのではないだろうか。
ii) メモリ細胞としてのCD8+CD122+細胞
いわゆるcentral memory T cellsは、このCD8+制御性T細胞とほぼ同じ細胞表面形質を持つ。CD8+CD122+CD62L+(マウス)CD8+CXCR3+CD45RO+CCR7+(ヒト)などと言われているが、両者は同一の細胞で、見方によって制御性細胞としての活性も示すし、メモリ細胞のようにも振る舞う(少なくともnaive細胞ではない)のかもしれない。いずれにせよ、CD8+CD122+CD49dlow細胞にメモリ細胞活性があるかどうかを早急に調べる。
iii) がん免疫への関わり
CDå8+CD122+CD49dlow細胞を臨床医学に応用しようとする場合、考えるべきことの第一にはどのような細胞を制御するかであるが、CD4+Tregは直接的にはCD4+細胞を制御することが主体と考えられ、CD8+制御性細胞の直接の「制御対象」でより大きな意味を持つものはCD8+T細胞と考えられる(CD4+細胞もCD8+制御性T細胞で制御されるが主にはCD4+Tregで制御される)。移植片の拒絶やがんに対する免疫応答は、最終的なエフェクターとしてCD8+細胞傷害性T細胞が重要となることが知られており、特に近年がんに対する免疫応答増強効果を狙った抗体薬の進歩が著しい。CD8+細胞傷害性T細胞を直接制御するCD8+制御性T細胞はがん免疫にとっても欠かせない重要なキャラクターである。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 西川 博嘉 | 教授 | 分子細胞免疫学 |
| 赤塚 美樹 | 特任教授 | 分子細胞免疫学 |
| 日野原 邦彦 | 特任准教授 | 分子細胞免疫学 |
| 伊藤 佐知子 | 講師 | 分子細胞免疫学 |
| KOCHIN Vitaly | 助教 | 分子細胞免疫学 |
研究実績
- 2025年
- Kumagai S, Momoi Y, Nishikawa H: Immunogenomic Cancer Evolution: A framework to understand cancer immunosuppression. Sci Immunol. 10(105):eabo5570 2025
- Nishinakamura H, Shinya S, Irie T, Sakihama S, Naito T, Watanabe K, Sugiyama D, Tamiya M, Yoshida T, Hase T, Yoshida T, Karube K, Koyama S, Nishikawa H: Coactivation of innate immune suppressive cells induces acquired resistance against combined TLR agonism and PD-1 blockade. Sci Trans Med 17(785):eadk3160 2025.
- Sato T, Sugiyama D, Koseki J, Kojima Y, Hattori S, Sone K, Nishinakamura H, Ishikawa T, Ishikawa Y, Kato T, Kiyoi H, Nishikawa H: Sustained inhibition of CSF1R signaling augments antitumor immunity through inhibiting tumor-associated macrophages. JCI Insight 10(1):e178146 2025 ).
- Tsuge A, Watanabe S, Kawazoe A, Togashi Y, Itahashi K, Masuda M, Sai A, Takei S, Muraoka H, Ohkubo S, Sugiyama D, Yan Y, Fukuoka S, Doi T, Shitara K, Koyama S, Nishikawa H: The HSP90 Inhibitor Pimitespib Targets Regulatory T Cells in the Tumor Microenvironment. Cancer Immunol Res. 13(2):273-285 2025 .
- Wagner M, Nishikawa H, Koyasu S: Reinventing type 2 immunity in cancer. Nature 637(8045):296-303. 2025.
- Koganemaru S, Koyama S, Suto F, Koga M, Inaki K, Kuwahara Y, Arita T, Hirata T, Goto H, Wada N, Kobayashi M, Shibutani T, Okabayashi T, Nakamaru K, Kawazoe A, Togashi Y, Nishikawa H, Shitara K: The Tumor Immune Microenvironment and Therapeutic Efficacy of Trastuzumab Deruxtecan in Gastric Cancer. Cancer Res Commun. 5(1):84-93 2025.
- 2024年
- Kumagai S, Itahashi K, Nishikawa H: Regulatory T cell-mediated immunosuppression orchestrated by cancer: towards an immuno-genomic paradigm for precision medicine. Nat Rev Clin Oncol. 21(5):337-353. 2024.
- Nishikawa H: Establishment of immune suppression by cancer cells in the tumor microenvironment. Proc Jpn Acad Ser B Phys Biol Sci. 100(2):114-122. 2024.
- Kondo M, Kumagai S, Nishikawa H: Metabolic advantages of regulatory T cells dictated by cancer cells. Int Immunol 36(2):75-86 2024 .
- Liu M, Akahori Y, Imai N, Wang L, Negishi K, Kato T, Fujiwara H, Miwa H, Shiku H, Miyahara Y. MAGE-A4 pMHC-targeted CAR-T cells exploiting TCR machinery exhibit significantly improved in vivo function while retaining antigen specificity. J Immunother Cancer. 2024 Nov 20;12(11):e010248. doi: 10.1136/jitc-2024-010248. PMID: 39572159; PMCID: PMC11580264.
- Zhou W, Kawashima S, Ishino T, Kawase K, Ueda Y, Yamashita K, Watanabe T, Kawazu M, Dansako H, Suzuki Y, Nishikawa H, Inozume T, Nagasaki J, Togashi Y: Stem-like progenitor and terminally differentiated TFH-like CD4+ T cell exhaustion in the tumor microenvironment. Cell Rep. 43(2):113797 2024.
- Takei S, Tanaka Y, Lin YT, Koyama S, Fukuoka S, Hara H, Nakamura Y, Kuboki Y, Kotani D, Kojima T, Bando H, Mishima S, Ueno T, Kojima S, Wakabayashi M, Sakamoto N, Kojima M, Kuwata T, Yoshino T, Nishikawa H, Mano H, Endo I, Shitara K, Kawazoe A: Multiomic molecular characterization of the response to combination immunotherapy in MSS/pMMR metastatic colorectal cancer. J Immunother Cancer. 12(2):e008210 2024.
- Naoi Y, Morinaga T, Nagasaki J, Ariyasu R, Ueda Y, Yamashita K, Zhou W, Kawashima S, Kawase K, Honobe-Tabuchi A, Ohnuma T, Kawamura T, Umeda Y, Kawahara Y, Nakamura Y, Kiniwa Y, Yamasaki O, Fukushima S, Kawazu M, Suzuki Y, Nishikawa H, Hanazawa T, Ando M, Inozume T, Togashi Y: CD106 in tumor-specific exhausted CD8+ T cells mediates immunosuppression by inhibiting TCR signaling. Cancer Res. 84(13):2109-2122 2024.
- Habu T, Kumagai S, Bando H, Fujisawa T, Mishima S, Kotani D, Nakamura M, Hojo H, Sakashita S, Kinoshita T, Yano T, Mitsunaga S, Nishikawa H, Koyama S, Kojima T: Definitive chemoradiotherapy induces T-cell-inflamed tumor microenvironment in unresectable locally advanced esophageal squamous cell carcinoma. J Gastroenterol. May 31 2024.
- Tsukada Y, Bando H, Inamori K, Wakabayashi M, Togashi Y, Koyama S, Kotani D, Yuki S, Komatsu Y, Homma S, Taketomi A, Uemura M, Kato T, Fukui M, Nakamura N, Kojima M, Kawachi H, Kirsch R, Yoshida T, Sato A, Nishikawa H, Ito M, Yoshino T: Three-year outcomes of preoperative chemoradiotherapy plus nivolumab in microsatellite stable and microsatellite instability-high locally advanced rectal cancer. Br J Cancer. 131(2):283-289 2024.
- Zhang M, Ono M, Kawaguchi S, Iida M, Chattrairat K, Zhu Z, Nagashima K, Yanagida T, Yamaguchi J, Nishikawa H, Natsume A, Baba Y, Yasui T: On-Site Stimulation of Dendritic Cells by Cancer-Derived Extracellular Vesicles on a Core-Shell Nanowire Platform. ACS Appl Mater Interfaces. 16(23):29570-29580 2024.
- Hisashi Nagase, Takuma Kato, Takayuki Yoshimoto,State-of-the-Art Cancer Immunotherapies,Int J Mol Sci.2024 Feb 22;25(5):2532.
- Yuta Takeuchi, Yizheng Wang, Katsunori Sasaki, Osamu Sato, Takahiro Tsuchikawa, Linan Wang, Yasunori Amaishi, Sachiko Okamoto, Junichi Mineno, Yoshifumi Hirokawa, Kanako C Hatanaka, Yutaka Hatanaka, Takuma Kato, Hiroshi Shiku, Satoshi Hirano,Exhaustion, rather than lack of infiltration and persistence, of CAR-T cells hampers the efficacy of CAR-T therapy in an orthotopic PDAC xenograft model,Biomed Pharmacother. 2024 Jan: 170:116052. Epub 2023 Dec 22.
- Yoshiaki Shimada, Yoshiki Akatsuka, Kazuya Nokura,Bilateral reversible optic neuropathy as the first sign of Waldenström macroglobulinema,Case Reports /GMS Ophthalmol Cases. 2024 Jun 25.
- Wang L, Matsumoto M, Akahori Y, Seo N, Shirakura K, Kato T, Katsumoto Y, Miyahara Y, Shiku H. Preclinical evaluation of a novel CAR-T therapy utilizing a scFv antibody highly specific to MAGE-A4p230-239/HLA-A∗02:01 complex. Mol Ther. 2024 Mar 6;32(3):734-748. doi: 10.1016/j.ymthe.2024.01.018. Epub 2024 Jan 18. PMID: 38243600; PMCID: PMC10928314.
- 2023年
- Kondo M, Kumagai S, Nishikawa H: Metabolic advantages of regulatory T cells dictated by cancer cells. Int Immunol Oct. 14 2023 .
- Sugiyama D, Hinohara K, Nishikawa H: Significance of regulatory T cells in cancer immunology and immunotherapy. Exp Dermatol. 32(3):256-263 2023 .
- Shinichiro K, Maeda Y, Sugiyama D, Watanabe K, Nishikawa H, Hinohara K: The cancer epigenome: non-cell autonomous player in tumor immunity. Cancer Sci. 114(3):730-740 2023 .
- Shiraishi K, Takahashi A, Momozawa Y, Daigo Y, Kaneko S, Kawaguchi T, Kunitoh H, Matsumoto S, Horinouchi H, Goto A, Honda T, Shimizu K, Torasawa M, Takayanagi D, Saito M, Saito A, Ohe Y, Watanabe SI, Goto K, Tsuboi M, Tsuchihara K, Takata S, Aoi T, Takano A, Kobayashi M, Miyagi Y, Tanaka K, Suzuki H, Maeda D, Yamaura T, Matsuda M, Shimada Y, Mizuno T, Sakamoto H, Yoshida T, Goto Y, Yoshida T, Yamaji T, Sonobe M, Toyooka S, Yoneda K, Masago K, Tanaka F, Hara M, Fuse N, Nishizuka SS, Motoi N, Sawada N, Nishida Y, Kumada K, Takeuchi K, Tanno K, Yatabe Y, Sunami K, Hishida T, Miyazaki Y, Ito H, Amemiya M, Totsuka H, Nakayama H, Yokose T, Ishigaki K, Nagashima T, Ohtaki Y, Imai K, Takasawa K, Minamiya Y, Kobayashi K, Okubo K, Wakai K, Shimizu A, Yamamoto M, Iwasaki M, Matsuda K, Inazawa J, Shiraishi Y, Nishikawa H, Murakami Y, Kubo M, Matsuda F, Kamatani Y, Hamamoto R, Matsuo K, Kohno T: Identification of telomere maintenance gene variations related to lung adenocarcinoma risk by genome-wide association and whole genome sequencing analyses. Cancer Commun (Lond). Oct. 26 2023.
- Harusato A, Seo W, Abo H, Nakanishi Y, Nishikawa H, Itoh Y: Protocol for acquiring samples to assess the impact of microplastics on immune microenvironments in the mouse intestine. STAR Protoc. 4(4):102648 2023.
- Hiramatsu H, Yokomori R, Shengyi L, Tanaka N, Mori S, Kiyotani K, Gotoh O, Kusumoto S, Nakano N, Suehiro Y, Ito A, Choi I, Ohtsuka E, Hidaka M, Nosaka K, Yoshimitsu M, Imaizumi Y, Iida S, Utsunomiya A, Noda T, Nishikawa H, Ueda R, Sanda T, Ishida T: Clinical landscape of TP73 structural variants in ATL patients. Leukemia. Oct 20 2023.
- Okuma HS, Watanabe K, Tsuchihashi K, Machida R, Sadachi R, Hirakawa A, Ariyama H, Kanai M, Kamikura M, Anjo K, Hiramitsu A, Sekine S, Okita N, Mano H, Nishikawa H, Nakamura K, Yonemori K: Phase 2 trial of nivolumab in metastatic rare cancer with dMMR or MSI-H and relation with immune phenotypic analysis (the ROCK trial). Clin Cancer Res. Oct 11 2023.
- Ito M, Iwama S, Sugiyama D, Yasuda Y, Okuji T, Kobayashi T, Zhou X, Yamagami A, Onoue T, Miyata T, Sugiyama M, Hagiwara D, Suga H, Banno R, Nishikawa H, Arima H: Anti-tumor effects of anti-programmed cell death-1 antibody treatment are attenuated in streptozotocin-induced diabetic mice. Sci Rep. 13(1):5939. 2023.
- Harusato A, Seo W, Abo H, Nakanishi Y, Nishikawa H, Itoh Y: Impact of particulate microplastics generated from polyethylene terephthalate on gut pathology and immune microenvironments. iScience. 26(4):106474 2023.
- Habu T, Kumanishi R, Ogata T, Fujisawa T, Mishima S, Kotani D, Kadowaki S, Nakamura M, Hojo H, Fujiwara H, Kumagai S, Koyama S, Fujita T, Kinoshita T, Nishikawa H, Yano T, Tajika M, Muro K, Mitsunaga S, Kojima T, Bando H: Complete response to definitive chemoradiotherapy in unresectable locally advanced esophageal squamous cell carcinoma. Esophagus. 20(3):533-540. 2023.
- Barakat C, Inagaki Y, Mizuno S, Nishio N, Katsuyama N, Sato Y, Kobayashi M, Ozeki K, Iida H, Tomita A, Sawa M, Demachi-Okamura A, Takahashi Y, Nishikawa H, Akatsuka Y : Development of TCR-T cell therapy targeting mismatched HLA-DPB1 for relapsed leukemia after allogeneic transplantation.Int J Hematol. 2023 Jun 13. doi: 10.1007/s12185-023-03621-y. Online ahead of print.PMID: 37310580
- Nishiwaki S, Sugiura I, Sato T, Kobayashi M, Osaki M, Sawa M, Adachi Y, Okabe M, Saito S, Morishita T, Kohno A, Nishiyama T, Iida H, Kurahashi S, Kuwatsuka Y, Sugiyama D, Ito S, Nishikawa H, Kiyoi H: Autologous peripheral blood stem cell transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia is safe but poses challenges for long-term maintenance of molecular remission: Results of the Auto-Ph17 study. EJHaem. 4(2):358-369 2023.
- Hiramatsu H, Nosaka K, Kusumoto S, Nakano N, Choi I, Yoshimitsu M, Imaizumi Y, Hidaka M, Sasaki H, Makiyama J, Ohtsuka E, Jo T, Ogata M, Ito A, Yonekura K, Tatetsu H, Kato T, Kawakita T, Suehiro Y, Ishitsuka K, Iida S, Matsutani T, Nishikawa H, Utsunomiya A, Ueda R, Ishida T: Landscape of immunoglobulin heavy chain gammagene class switch recombination in patients with adult T-cell leukemia-lymphoma. Haematologica. 108(4):1173-1178 2023.(2023)
- Harusato A, Seo W, Abo H, Nakanishi Y, Nishikawa H, Itoh Y : Impact of particulate microplastics generated from polyethylene terephthalate on gut pathology and immune microenvironments.iScience. 2023 Mar 25;26(4):106474. doi: 10.1016/j.isci.2023.106474. eCollection 2023 Apr 21.PMID: 37091249 Free PMC article.
- Ito M, Iwama S, Sugiyama D, Yasuda Y, Okuji T, Kobayashi T, Zhou X, Yamagami A, Onoue T, Miyata T, Sugiyama M, Hagiwara D, Suga H, Banno R, Nishikawa H, Arima H : Anti-tumor effects of anti-programmed cell death-1 antibody treatment are attenuated in streptozotocin-induced diabetic mice.Sci Rep. 2023 Apr 12;13(1):5939. doi: 10.1038/s41598-023-33049-7.PMID: 37046033 Free PMC article.
- Kameda K, Yanagiya R, Miyatake Y, Carreras J, Higuchi H, Murayama H, Ishida T, Ito A, Iida S, Fukuhara N, Harigae H, Fujioka Y, Takahashi N, Wada H, Ishida F, Nakazawa H, Ishihara R, Murakami Y, Tagawa H, Matsuura T, Nakagawa S, Iwabuchi S, Hashimoto S, Imadome KI, Nakamura N, Ishizawa K, Kanda Y, Ando K, Kotani A : Hepatic niche leads to aggressive natural killer cell leukemia proliferation through transferrin-transferrin receptor 1 axis.Blood. 2023 May 5:blood.2022018597. doi: 10.1182/blood.2022018597. Online ahead of print.PMID: 37146246
- Nomura A, Kobayashi T, Seo W, Ohno-Oishi M, Kakugawa K, Muroi S, Yoshida H, Endo TA, Moro K, Taniuchi I : Identification of a novel enhancer essential for Satb1 expression in TH2 cells and activated ILC2s.Life Sci Alliance. 2023 May 16;6(8):e202301897. doi: 10.26508/lsa.202301897. Print 2023 Aug.PMID: 37193606 Free PMC article.
- 2022年
- Shinichiro K, Maeda Y, Sugiyama D, Watanabe K, Nishikawa H, Hinohara K: The cancer epigenome: non-cell autonomous player in tumor immunity. Cancer Sci. 2022 Dec 5. (2022)
- Sugiyama D, Hinohara K, Hiroyoshi N: Significance of regulatory T cells in cancer immunology and immunotherapy. Exp Dermatol. 2022 Dec 2. doi: 10.1111/exd.14721. (2022)
- Hiramatsu H, Nosaka K, Kusumoto S, Nakano N, Choi I, Yoshimitsu M, Imaizumi Y, Hidaka M, Sasaki H, Makiyama J, Ohtsuka E, Jo T, Ogata M, Ito A, Yonekura K, Tatetsu H, Kato T, Kawakita T, Suehiro Y, Ishitsuka K, Iida S, Matsutani T, Nishikawa H, Utsunomiya A, Ueda R, Ishida T: Landscape of immunoglobulin heavy chain gamma gene class switch recombination in patients with adult T-cell leukemia-lymphoma. Haematologica. 2022 Nov 24. (2022)
- Itahashi K, Irie T, Yuda J, Kumagai S, Tanegashima T, Lin Y-Z, Watanabe S, Goto Y, Suzuki J, Aokage K, Tsuboi M, Minami Y, Ishii G, Ohe Y, Ise W, Kurosaki T, Suzuki Y, Koyama S, Nishikawa H: BATF epigenetically and transcriptionally controls the activation program of regulatory T cells in human tumors. Sci Immunol. Epub 2022 Oct 7. (2022)
- Aoki C, Imai K, Mizutani T, Sugiyama D, Miki R, Koya Y, Kobayashi T, Ushida T, Iitani Y, Nakamura N, Owaki T, Nishikawa H, Toyokuni S, Kajiyama H, Kotani T: Molecular hydrogen has a positive impact on pregnancy maintenance through enhancement of mitochondrial function and immunomodulatory effects on T cells. Life Sci. 2022 Sep 15;308:120955. (2022)
- Kelkka T, Tyster M, Lundgren S, Feng X, Kerr C, Hosokawa K, Huuhtanen J, Keränen M, Patel B, Kawakami T, Maeda Y, Nieminen O, Kasanen T, Aronen P, Yadav B, Rajala H, Nakazawa H, Jaatinen T, Hellström-Lindberg E, Ogawa S, Ishida F, Nishikawa H, Nakao S, Maciejewski J, Young NS, Mustjoki S: Anti-COX-2 autoantibody is a novel biomarker of immune aplastic anemia. Leukemia. 2022 Sep;36(9):2317-2327. Epub 2022 Aug 5. (2022)
- Nagaharu K, Kojima Y, Hirose H, Minoura K, Hinohara K, Minami H, Kageyama Y, Sugimoto Y, Masuya M, Nii S, Seki M, Suzuki Y, Tawara I, Shimamura T, Katayama N, Nishikawa H, Ohishi K: A bifurcation concept for B-lymphoid/plasmacytoid dendritic cells with largely fluctuating transcriptome dynamics. Cell Rep. 2022 Aug 30;40(9):111260. (2022)
- Itahashi K, Irie T, Nishikawa H: Regulatory T-cell development in the tumor microenvironment. Eur J Immunol. 2022 Aug;52(8):1216-1227. Epub 2022 Jul 25. (2022)
- Kobayashi T, Kumagai S, Doi R, Afonina E, Koyama S, Nishikawa H: Isolation of tumor-infiltrating lymphocytes from preserved human tumor tissue specimens for downstream characterization. STAR Protoc. 2022 Sep 16;3(3):101557. Epub 2022 Jul 18. (2022)
- Yukami H, Kawazoe A, Lin YT, Koyama S, Fukuoka S, Hara H, Takahashi N, Kojima T, Asayama M, Yoshii T, Bando H, Kotani D, Nakamura Y, Kuboki Y, Mishima S, Wakabayashi M, Kuwata T, Goto M, Higuchi K, Yoshino T, Doi T, Nishikawa H, Shitara K: Updated efficacy outcomes of anti-PD-1 antibodies plus multikinase inhibitors for advanced gastric cancer patients with or without liver metastases in clinical trials. Clin Cancer Res. 2022 Aug 15;28(16):3480-3488. (2022)
- Miyai Y, Sugiyama D, Hase T, Asai N, Taki T, Nishida K, Fukui T, Chen-Yoshikawa TF, Kobayashi H, Mii S, Shiraki Y, Hasegawa Y, Nishikawa H, Ando Y, Takahashi M, Enomoto A: Meflin-positive cancer-associated fibroblasts enhance tumor response to immune checkpoint blockade. Life Sci Alliance. 2022 Mar 2;5(6):e202101230. Print 2022 Jun. (2022)
- Goda N, Sasada S, Shigematsu H, Masumoto N, Arihiro K, Nishikawa H, Sakaguchi S, Okada M, Kadoya T: The ratio of CD8 + lymphocytes to tumor-infiltrating suppressive FOXP3 + effector regulatory T cells is associated with treatment response in invasive breast cancer. Discov Oncol. 2022 Apr 19;13(1):27. (2022)
- Ong JZL, Yokomori R, Wong RWJ, Tan TK, Ueda R, Ishida T, Iida S, Sanda T: Requirement for TP73 and genetic alterations originating from its intragenic super-enhancer in adult T-cell leukemia. Leukemia. 2022 Sep;36(9):2293-2305. Epub 2022 Jul 30. (2022)
- Sakamoto Y, Ishida T, Masaki A, Murase T, Ohtsuka E, Takeshita M, Muto R, Iwasaki H, Ito A, Kusumoto S, Nakano N, Tokunaga M, Yonekura K, Tashiro Y, Iida S, Utsunomiya A, Ueda R, Inagaki H: CCR7 alterations associated with inferior outcome of adult T-cell leukemia/lymphoma under mogamulizumab treatment. Hematol Oncol. 2022 Aug 31. (2022)
- Tanaka N, Mori S, Kiyotani K, Ota Y, Gotoh O, Kusumoto S, Nakano N, Suehiro Y, Ito A, Choi I, Ohtsuka E, Hidaka M, Nosaka K, Yoshimitsu M, Imaizumi Y, Iida S, Utsunomiya A, Noda T, Nishikawa H, Ueda R, Ishida T: Genomic determinants impacting the clinical outcome of mogamulizumab treatment for adult T-cell leukemia/lymphoma. Haematologica. 2022 Apr 14. (2022)
- Aokage K, Tsuboi M, Zenke Y, Horinouchi H, Nakamura N, Ishikura S, Nishikawa H, Kumagai S, Koyama S, Kanato K, Kataoka T, Wakabayashi M, Fukutani M, Fukuda H, Ohe Y, Watanabe SI; Lung Cancer Surgical Study Group of the Japan Clinical Oncology Group: Study protocol for JCOG1807C (DEEP OCEAN): a interventional prospective trial to evaluate the efficacy and safety of durvalumab before and after operation or durvalumab as maintenance therapy after chemoradiotherapy against superior sulcus non-small cell lung cancer. Jpn J Clin Oncol. 2022 Apr 6;52(4):383-387. (2022)
- Hasegawa H, Shitara K, Takiguchi S, Takiguchi N, Ito S, Kochi M, Horinouchi H, Kinoshita T, Yoshikawa T, Muro K, Nishikawa H, Suna H, Kodera Y: A multicenter, open-label, single-arm phase I trial of neoadjuvant nivolumab monotherapy for resectable gastric cancer. Gastric Cancer. 2022 Mar 7. (2022)
- Kumagai S, Koyama S, Itahashi K, Tanegashima T, Lin Y-T, Togashi Y, Kamada T, Irie T, Okumura G, Kohno H, Ito D, Fujii R, Watanabe S, Sai A, Fukuoka S, Sugiyama E, Watanabe G, Owari T, Nishinakaumra H, Sugiyama D, Maeda Y, Kawazoe A, Yukami H, Cida K, Ohara Y, Yoshida T, Shinno Y, Takeyasu Y, Shirasawa M, Nakama K, Aokage K, Suzuki J, Ishii G, Kuwata T, Sakamoto N, Kawazu M, Ueno T, Mori T, Yamazaki N, Tsuboi M, Yatabe Y, Kinoshita T, Doi T, Shitara K, Mano H, Nishikawa H: Lactic acid promotes PD-1 expression in regulatory T cells in highly glycolytic tumor microenvironments. Cancer Cell. 2022 Jan 25:S1535-6108(22)00003-4. (2022)
- Nagasaki J, Inozume T, Sax N, Ariyasu R, Ishikawa M, Yamashita K, Kawazu M, Ueno T, Irie T, Tanji E, Morinaga T, Honobe A, Ohnuma T, Yoshino M, Iwata T, Kawase K, Sasaki K, Hanazawa T, Kochin V, Kawamura T, Matsue H, Hino M, Mano H, Suzuki Y, Nishikawa H, Togashi Y: PD-1 blockade therapy promotes infiltration of tumor-attacking exhausted T cell clonotypes. Cell Rep. 2022 Feb 1;38(5):110331. (2022)
- Bando H, Tsukada Y, Inamori K, Togashi Y, Koyama S, Kotani D, Fukuoka S, Yuki S, Komatsu Y, Homma S, Taketomi A, Uemura M, Kato T, Fukui M, Wakabayashi M, Nakamura N, Kojima M, Kawachi H, Kirsch R, Yoshida T, Suzuki Y, Sato A, Nishikawa H, Ito M, Yoshino T: Preoperative Chemoradiotherapy Plus Nivolumab Before Surgery in Microsatellite Stable and Microsatellite Instability-High Locally Advanced Rectal Cancer Patients. Clin Cancer Res. 2022 Jan 21:clincanres.3213.2021. (2022)
- Aokage K, Tsuboi M, Zenke Y, Horinouchi H, Nakamura N, Ishikura S, Nishikawa H, Kumagai S, Koyama S, Kanato K, Kataoka T, Wakabayashi M, Fukutani M, Fukuda H, Ohe Y, Watanabe SI; Lung Cancer Surgical Study Group of the Japan Clinical Oncology Group: Study protocol for JCOG1807C (DEEP OCEAN): a interventional prospective trial to evaluate the efficacy and safety of durvalumab before and after operation or durvalumab as maintenance therapy after chemoradiotherapy against superior sulcus non-small cell lung cancer. Jpn J Clin Oncol. 2022 Jan 7:hyab208. (2022)
- Okamoto A, Fujigaki H, Iriyama C, Goto N, Yamamoto H, Mihara K, Inaguma Y, Miura Y, Furukawa K, Yamamoto Y, Akatsuka Y, Kasahara S, Miyao K, Tokuda M, Sato S, Mizutani Y, Osawa M, Hattori K, Iba S, Kajiya R, Okamoto M, Saito K, Tomita A: CD19-positive lymphocyte count is critical for acquisition of anti-SARS-CoV-2 IgG after vaccination in B-cell lymphoma. Blood Adv. 2022 Jan 13:bloodadvances.2021006302. (2022)
- Harusato A, Chassaing B, Dauriat CJG, Ushiroda C, Seo W, Itoh Y: Dietary Emulsifiers Exacerbate Food Allergy and Colonic Type 2 Immune Response through Microbiota Modulation. Nutrients. 2022 Nov 23;14(23):4983. doi: 10.3390/nu14234983. (2022)
- Seo W, Nomura A, Taniuchi I: The Roles of RUNX Proteins in Lymphocyte Function and Anti-Tumor Immunity: Cells. 2022 Oct 3;11(19):3116. doi: 10.3390/cells11193116. (2022)
- 2021年
- Maeda Y, Wada H, Sugiyama D, Saito T, Irie T, Itahashi K, Minoura K, Suzuki S, Kojima T, Kakimi K, Nakajima J, Funakoshi T, Iida S, Oka M, Shimamura T, Doi T, Doki Y, Nakayama E, Ueda R, Nishikawa H: Depletion of central memory CD8 + T cells might impede the antitumor therapeutic effect of Mogamulizumab. Nat Commun. 12(1):7280 2021.
- Takeuchi Y, Tanegashima T, Sato E, Irie T, Sai A, Itahashi K, Kumagai S, Tada Y, Togashi Y, Koyama S, Akbay E.A, Karasaki T, Kataoka K, Funaki S, Shintani Y, Nagatomo I, Kida H, Ishii G, Miyoshi T, Aokage K, Kakimi K, Ogawa S, Okumura M, Eto M, Kumanogoh A, Tsuboi M, Nishikawa H: Highly immunogenic cancer cells require activation of the WNT pathway for immunological escape. Sci Immunol. 6(65):eabc6424 2021.
- Kumagai S, Koyama S, Nishikawa H: Antitumour immunity regulated by aberrant ERBB family signalling. Nat Rev Cancer. 21(3):181-197 2021.
- Isoyama S, Mori S, Sugiyama D, Kojima Y, Tada Y, Shitara K, Hinohara K, Dan S, Nishikawa H: Cancer immunotherapy with PI3K and PD-1 dual-blockade via optimal modulation of T cell activation signal. J Immunother Cancer. 9(8):e002279 2021.
- Watanabe K, Nishikawa H: Engineering strategies for broad application of TCR-T and CAR-T cell therapies. Int Immunol. 33(11):551-562 2021.
- Koyama S, Nishikawa H: Mechanisms of regulatory T cell infiltration in tumors: implications for innovative immune precision therapies. J Immunother Cancer. 9(7):e002591 2021.
- Satoh K, Kobayashi Y, Fujimaki K, Hayashi S, Ishida S, Sugiyama D, Sato T, Kyungtaek L, Miyamoto M, Kozuma S, Kadokura M, Wakita K, Hata M, Hirahara K, Amano M, Watanabe I, Okamoto A, Tuettenberg A, Jonuleit H, Tanemura A, Maruyama S, Agatsuma T, Wada T, Nishikawa H: Novel anti-GARP antibody DS-1055a augments antitumor immunity by depleting highly suppressive GARP+ regulatory T cells. Int Immunol. 33(8):435-446 2021.
- Inamori K, Togashi Y, Fukuoka S, Akagi K, Ogasawara K, Irie T, Motooka D, Kobayashi Y, Sugiyama D, Kojima M, Shiiya N, Nakamura S, Maruyama S, Suzuki Y, Ito M, Nishikawa H: Importance of lymph node immune responses in MSI-H/dMMR colorectal cancer. JCI Insight. 6(9):137365. 2021.
- Seo W, Jerin C, Nishikawa H: Transcriptional regulatory network for the establishment of CD8 + T cell exhaustion. Exp Mol Med. 53(2):202-209 2021.
- Arakawa A, Ichikawa H, Kubo T, Motoi N, Kumamoto T, Nakajima M, Yonemori K, Noguchi E, Sunami K, Shiraishi K, Kakishima H, Yoshida H, Hishiki T, Kawakubo N, Kuroda T, Kiyokawa T, Yamada K, Yanaihara N, Takahashi K, Okamoto A, Hirabayashi S, Hasegawa D, Manabe A, Ono K, Matsuoka M, Arai Y, Togashi Y, Shibata T, Nishikawa H, Aoki K, Yamamoto N, Kohno T, Ogawa C: Vaginal Transmission of Cancer from Mothers with Cervical Cancer to Infants. N Engl J Med. 384(1):42-50 2021.
- Yasuda Y, Iwama S, Sugiyama D, Okuji T, Kobayashi T, Ito M, Okada N, Enomoto A, Ito S, Yan Y, Sugiyama M, Onoue T, Tsunekawa T, Ito Y, Takagi H, Hagiwara D, Goto M, Suga H, Banno R, Takahashi M, Nishikawa H, Arima H: CD4+ T cells are essential for the development of destructive thyroiditis induced by anti-PD-1 antibody in thyroglobulin-immunized mice. Sci Transl Med. 13(593):eabb7495 2021.
- Kawazu M, Ueno T, Saeki K, Sax N, Togashi Y, Kaneseki T, Chida K, Kishigami F, Sato K, Kojima S, Otsuka M, Kawazoe A, Nishinakamura H, Maeda Y, Yamamoto Y, Yamashita K, Inoue S, Tanegashima T, Matsubara D, Tane K, Tanaka Y, Iinuma H, Hashiguchi Y, Hazama S, Khor SS, Tokunaga K, Tsuboi M, Niki T, Eto M, Shitara K, Torigoe T, Ishihara S, Aburatani H, Haeno H, Nishikawa H, Mano H: HLA Class I analysis provides insight into the genetic and epigenetic background of immune evasion in colorectal cancer with high microsatellite instability Gastroenterology. S0016-5085(21)03644-1 2021.
- Kawazoe A, Itahashi K, Yamamoto N, Kotani D, Kuboki Y, Taniguchi H, Harano K, Naito Y, Suzuki M, Fukutani M, Higuchi T, Ikeno T, Wakabayashi M, Sato A, Koyama S, Nishikawa H, Shitara K: TAS-116 (Pimitespib), an Oral HSP90 Inhibitor, in Combination with Nivolumab in Patients with Colorectal Cancer and Other Solid Tumors: An Open-Label, Dose-Finding, and Expansion Phase Ib Trial (EPOC1704). Clin Cancer Res. 27(24):6709-6715 2021.
- Kawashima S, Inozume T, Kawazu M, Ueno T, Nagasaki J, Tanji E, Honobe A, Ohnuma T, Kawamura T, Umeda Y, Nakamura Y, Kawasaki T, Kiniwa Y, Yamasaki O, Fukushima S, Ikehara Y, Mano H, Suzuki Y, Nishikawa H, Matsue H, Togashi Y: TIGIT/CD155 axis mediates resistance to immunotherapy in patients with melanoma with the inflamed tumor microenvironment J Immunother Cancer. 9(11):e003134 2021.
- Kobayashi T, Iwama S, Sugiyama D, Yasuda Y, Okuji T, Ito M, Ito S, Sugiyama M, Onoue T, Takagi H, Hagiwara D, Ito Y, Suga H, Banno R, Nishikawa H, Arima H: Anti-pituitary antibodies and susceptible human leukocyte antigen alleles as predictive biomarkers for pituitary dysfunction induced by immune checkpoint inhibitors. J Immunother Cancer. 9(5):e002493 2021.
- Kitahara M, Shigeno Y, Shime M, Matsumoto Y, Nakamura S, Motooka D, Fukuoka S, Nishikawa H, Benno Y: Vescimonas gen. nov., Vescimonas coprocola sp. nov., Vescimonas fastidiosa sp. nov., Pusillimonasgen. nov. and Pusillimonas faecalis sp. nov. isolated from human faeces Int J Syst Evol Microbiol. Nov;71(11) 2021.
- Kelkka T, Savola P, Bhattacharya D, Huuhtanen J, Lönnberg T, Kankainen M, Paalanen K, Tyster M, Lepistö M, Ellonen P, Smolander J, Eldfors S, Yadav B, Khan S, Koivuniemi R, Sjöwall C, Elo LL, Lähdesmäki H, Maeda Y, Nishikawa H, Leirisalo-Repo M, Sokka-Isler T, Mustjoki S.: Adult-onset anti-citrullinated peptide antibody-negative destructive rheumatoid arthritis is characterized by a disease-specific CD8+ T lymphocyte signature. Front Immunol. 12:710831 2021.
- Kashima Y, Togashi Y, Fukuoka S, Kamada T, Irie T, Suzuki A, Nakamura Y, Shitara K, Minamide T, Yoshida T, Taoka N, Kawase T, Wada T, Inaki K, Chihara M, Ebisuno Y, Tsukamoto S, Fujii R, Ohashi A, Suzuki Y, Tsuchihara K, Nishikawa H, Doi T: Potentiality of multiple modalities for single-cell analyses to evaluate the tumor microenvironment in clinical specimens. Sci Rep. 11(1):341 2021.
- Fujioka Y, Sugiyama D, Matsumura I, Minami Y, Miura M, Atsuta Y, Ohtake S, Kiyoi H, Miyazaki Y, Nishikawa H, Takahashi N: Regulatory T Cell as a Biomarker of Treatment-Free Remission in Patients with Chronic Myeloid Leukemia. Cancers. 13(23):5904 2021.
- Nozaki K, Fujioka Y, Sugiyama D, Ishikawa J, Iida M, Shibata M, Kosugi S, Nishikawa H, Shibayama H: Flow cytometry analysis of peripheral Tregs in patients with multiple myeloma under lenalidomide maintenance. Int J Hematol. 113(5):772-774 2021.
- Chen S, Kiguchi T, Nagata Y, Tamai Y, Ikeda T, Kajiya R, Ono T, Sugiyama D, Nishikawa H, Akatsuka Y: A simple method to distinguish residual elotuzumab from monoclonal paraprotein in immunofixation assays for multiple myeloma patients. Int J Hematol. 113(4):473-479 2021.
- Watanabe S, Goto Y, Yasuda H, Kohno T, Motoi N, Ohe Y, Nishikawa H, Kobayashi SS, Kuwano K, Togashi Y.: HSP90 inhibition overcomes EGFR amplification-induced resistance to third-generation EGFR-TKIs. Thorac Cancer. 12(5):631-642 2021.
- Sakamoto Y, Ishida T, Masaki A, Takeshita M, Iwasaki H, Yonekura K, Tashiro Y, Ito A, Kusumoto S, Iida S, Utsunomiya A, Ueda R, Inagaki H: Clinicopathological significance of CD28 overexpression in adult T-cell leukemia/lymphoma. Cancer Sci. 2022 Jan;113(1):349-361. doi: 10.1111/cas.15191. Epub 2021 Nov 29. (2021)
- Sakamoto Y, Ishida T, Masaki A, Murase T, Takeshita M, Muto R, Iwasaki H, Ito A, Kusumoto S, Nakano N, Tokunaga M, Yonekura K, Tashiro Y, Iida S, Utsunomiya A, Ueda R, Inagaki H: Clinical significance of TP53 mutations in adult T-cell leukemia/lymphoma. Br J Haematol. 2021 Nov;195(4):571-584. doi: 10.1111/bjh.17749. Epub 2021 Aug 17. (2021)
- Nosaka K, Kusumoto S, Nakano N, Choi I, Yoshimitsu M, Imaizumi Y, Hidaka M, Sasaki H, Makiyama J, Ohtsuka E, Jo T, Ogata M, Ito A, Yonekura K, Tatetsu H, Kato T, Kawakita T, Suehiro Y, Ishitsuka K, Iida S, Matsutani T, Utsunomiya A, Ueda R, Ishida T: Clinical significance of the immunoglobulin G heavy-chain repertoire in peripheral blood mononuclear cells of adult T-cell leukaemia-lymphoma patients receiving mogamulizumab. Br J Haematol. 2022 Feb;196(3):629-638. doi: 10.1111/bjh.17895. Epub 2021 Oct 10. (2021)
- Kikuchi Y, Tokita S, Hirama T, Kochin V, Nakatsugawa M, Shinkawa T, Hirohashi Y, Tsukahara T, Hata F, Takemasa I, Sato N, Kanaseki T, Torigoe T: CD8+ T-cell Immune Surveillance against a Tumor Antigen Encoded by the Oncogenic Long Noncoding RNA PVT1. Cancer Immunol Res. 2021 Nov;9(11):1342-1353. doi: 10.1158/2326-6066.CIR-20-0964. Epub 2021 Aug 25.
- Yokoyama S, Takahashi A, Kikuchi R, Nishibu S, Lo JA, Hejna M, Moon WM, Kato S, Zhou Y, Hodi FS, Song JS, Sakurai H, Fisher DE, Hayakawa Y: SOX10 Regulates Melanoma Immunogenicity through an IRF4-IRF1 Axis. Cancer Res. 2021 Dec 15;81(24):6131-6141. doi: 10.1158/0008-5472.CAN-21-2078. Epub 2021 Nov 2. (2021)
- Takashima H, Sato Boku A, Miyamoro H, Kato S, Furuno S, Shibuya Y: Perioperative management of von Willebrand patients at the time of implant placement: Case report. Clin Case Rep. 2021 Aug 30;9(9):e04755. doi: 10.1002/ccr3.4755.(2021)
- Allouche J, Rachmin I, Adhikari K, Pardo LM, Lee JH, McConnell AM, Kato S, Fan S, Kawakami A, Suita Y, Wakamatsu K, Igras V, Zhang J, Navarro PP, Lugo CM, Noonan HR, Christie KA, Itin K, Mujahid N, Lo JA, Won CH, Evans CL, Weng QY, Wang H, Osseiran S, Lovas A, Németh I, Cozzio A, Navarini AA, Hsiao JJ, Nguyen N, Kemény LV, Iliopoulos O, Berking C, Ruzicka T, Gonzalez-José R, Bortolini MC, Canizales-Quinteros S, Acuna-Alonso V, Gallo C, Poletti G, Bedoya G, Rothhammer F, Ito S, Schiaffino MV, Chao LH, Kleinstiver BP, Tishkoff S, Zon LI, Nijsten T, Ruiz-Linares A, Fisher DE, Roider E: NNT mediates redox-dependent pigmentation via a UVB- and MITF-independent mechanism. Cell. 2021 Aug 5;184(16):4268-4283.e20. doi: 10.1016/j.cell.2021.06.022. Epub 2021 Jul 6. (2021)
- Kemény LV, Robinson KC, Hermann AL, Walker DM, Regan S, Yew YW, Lai YC, Theodosakis N, Rivera PD, Ding W, Yang L, Beyer T, Loh YE, Lo JA, van der Sande AAJ, Sarnie W, Kotler D, Hsiao JJ, Su MY, Kato S, Kotler J, Bilbo SD, Chopra V, Salomon MP, Shen S, Hoon DSB, Asgari MM, Wakeman SE, Nestler EJ, Fisher: Vitamin D deficiency exacerbates UV/endorphin and opioid addiction. Science Advances. 2021 Jun 11;7(24):eabe4577. doi: 10.1126/sciadv.abe4577 (2021)
- 2020年
- Kumagai S, Togashi Y, Kamada T, Sugiyama E, Nishinakaumra H, Takeuchi Y, Kochin, V, Itahashi K, Maeda Y, Matsui S, Shibahara,T, Yamashita Y, Irie T, Tsuge A, Fukuoka S, Kawazoe A, Udagawa H, Kirita K, Aokage K, Ishii G, Kuwata T, Nakama K, Kawazu M, Ueno T, Yamazaki N, Goto K, Tsuboi M, Mano H, Doi T, Shitara K, Nishikawa H: The PD-1 expression balance between effector and regulatory T cell predicts the clinical efficacy of PD-1 blockade therapies. Nat Immunol. 21(11):1346-1358 2020.
- Kumagai S, Togashi Y, Sakai C, Kawazoe A, Kawazu M, Ueno T, Sato E, Kuwata T, Kinoshita T, Yamamoto M, Nomura S, Tsukamoto T, Mano H, Shitara K, Nishikawa H: An oncogenic alteration creates a tumor microenvironment that promotes tumor progression by conferring a metabolic advantage to regulatory T cells. Immunity. 53(1):187-203.e8 2020.
- Sugiyama E, Togashi Y, Takeuchi Y, Shinya S, Tada, Y, Kataoka K, Tane K, Sato E, Ishii G, Goto K, Shintani Y, Okumura M, Tsuboi M, Nishikawa H.: Blockade of EGFR improves responsiveness to PD1 blockade in EGFR-mutated non-small cell lung cancer. Sci Immunol 5(43). pii: eaav3937 2020.
- Nagasaki J, Togashi Y, Sugawara T, Itami M, Yamauchi N, Yuda J, Sugano M, Ohara Y, Minami Y, Nakamae H, Hino M, Takeuchi M, Nishikawa H: The critical role of CD4+ T cells in PD-1 blockade against MHC-II-expressing tumors such as classic Hodgkin lymphoma. Blood Adv. 4(17):4069-4082 2020.
- Muramatsu T, Noguchi T, Sugiyama D, Kanada Y, Fujimaki K, Ito S, Gotoh M, Nishikawa H: Newly emerged immunogenic neoantigens in established tumors enable hosts to regain immunosurveillance in a T cell-dependent manner. Int Immunol. Jul 30: dxaa049 2020.
- Tanaka A*, Nishikawa H*, Noguchi S* (*equally contributed), Sugiyama D, Morikawa H, Takeuchi Y, Ha D, Shigeta N, Kitawaki T, Maeda Y, Saito T, Shinohara Y, Kameoka Y, Iwaisako K, Monma F, Ohishi K, Karbach J, Jäger E, Sawada K, Katayama N, Takahashi N, Sakaguchi S.: Tyrosine kinase inhibitor imatinib augments tumor immunity by depleting effector regulatory T cells. J Exp Med. 217(2): 2020.
- Umemoto K, Togashi Y, Arai Y, Nakamura H, Takahashi S, Tanegashima T, Kato M, Nishikawa T, Sugiyama D, Kojima M, Gotohda N, Kuwata T, Ikeda M, Shibata T, Nishikawa H.: The potential application of PD-1 blockade therapy for early-stage biliary tract cancer. Int Immunol. 32(4):273-281 2020.
- Kawazoe A, Kuboki Y, Shinozaki E, Hara H, Nishina T, Komatsu Y, Yuki S, Wakabayashi M, Nomura S, Sato A, Kuwata T, Kawazu M, Mano H, Togashi Y, Nishikawa H, Yoshino T: Multicenter phase 1/2 Trial of napabucasin and pembrolizumab in patients with metastatic colorectal cancer (EPOC1503/SCOOP Trial). Clin Cancer Res. 2020 Jul 21:clincanres.1803 2020.
- Fukuoka S, Hara H, Takahashi N, Kojima T, Kawazoe A, Asayama M, Yoshii T, Kotani D, Tamura H, Mikamoto Y, Hirano N, Wakabayashi M, Nomura S, Sato A, Kuwata T, Togashi Y, Nishikawa H, Shitara K: Regorafenib Plus Nivolumab in Patients With Advanced Gastric or Colorectal Cancer: An Open-Label, Dose-Escalation, and Dose-Expansion Phase Ib Trial (REGONIVO, EPOC1603) J Clin Oncol. 38(18):2053-2061 2020.
- Minoura K, Abe K, Maeda Y, Nishikawa H, Shimamura T.: CYBERTRACK2.0: zero-inflated model-based cell clustering and population tracking method for longitudinal mass cytometry data. Bioinformatics. Oct 14:btaa873 2020.
- Abe K, Minoura K, Maeda Y, Nishikawa H, Shimamura T.: Model-based clustering for flow and mass cytometry data with clinical information. BMC Bioinformatics. Sep 17;21(Suppl 13):393 2020.
- Murate K, Maeda K, Nakamura M, Sugiyama D, Wada H, Yamamura T, Sawada T, Mizutani Y, Ishikawa T, Furukawa K, Ohno E, Honda T, Kawashima H, Miyahara R, Ishigami M, Nishikawa H, Fujishiro M.: Endoscopic Activity and Serum TNF-α Level at Baseline Are Associated With Clinical Response to Ustekinumab in Crohn's Disease Patients. Inflamm Bowel Dis. 2020 May 14 2020.
- Bando H, Kotani D, Tsushima T, Hara H, Kadowaki S, Kato K, Chin K, Yamaguchi K, Kageyama SI, Hojo H, Nakamura M, Tachibana H, Wakabayashi M, Fukutani M, Togashi Y, Fuse N, Nishikawa H, Kojima T.: TENERGY: Multicenter Phase II Study of Atezolizumab Monotherapy Following Definitive Chemoradiotherapy With 5-FU Plus Cisplatin in Patients With Unresectable Locally Advanced Esophageal Squamous Cell Carcinoma. BMC Cancer. 20(1):336 2020.
- Sasaki A, Nakamura Y, Togashi Y, Kuno H, Hojo H, Kageyama S, Nakamura N, Takashima K, Kadota T, Yoda Y, Mishima S, Sawada K, Kotani D, Kawazoe A, Kuboki Y, Taniguchi H, Kojima T, Doi T, Yoshino T, Yano T, Kobayashi T, Akimoto T, Nishikawa H, Shitara K.: Enhanced Tumor Response to Radiotherapy After PD-1 Blockade in Metastatic Gastric Cancer. Gastric Cancer. 23(5):893-903.2020.
- Akatsuka Y: TCR-Like CAR-T Cells Targeting MHC-Bound Minor Histocompatibility Antigens.Frontiers in Immunology.28 February 2020.doi:10.3389/fimmu.2020.00257
- Fujii K, Sakamoto Y, Masaki A, Murase T, Tashiro Y, Yonekura K, Utsunomiya A, Ito A, Kusumoto S, Iida S, Ueda R, Ishida T, Inagaki H: Immunohistochemistry for CCR4 C-terminus predicts CCR4 mutations and mogamulizumab efficacy in adult T-cell leukemia/lymphoma. J Pathol Clin Res. 2021 Jan;7(1):52-60. doi: 10.1002/cjp2.180. Epub 2020 Oct 6. (2020)
- Imaizumi Y, Iwanaga M, Nosaka K, Ishitsuka K, Ishizawa K, Ito S, Amano M, Ishida T, Uike N, Utsunomiya A, Ohshima K, Tanaka J, Tokura Y, Tobinai K, Watanabe T, Uchimaru K, Tsukasaki K; for collaborative: Prognosis of patients with adult T-cell leukemia/lymphoma in Japan: A nationwide hospital-based study. Cancer Sci. 2020 Dec;111(12):4567-4580. doi: 10.1111/cas.14658. Epub 2020 Oct 21. (2020)
- Masaki A, Ishida T, Maeda Y, Ito A, Suzuki S, Narita T, Kinoshita S, Yoshida T, Ri M, Kusumoto S, Komatsu H, Inagaki H, Ueda R, Choi I, Suehiro Y, Iida S: Clinical significance of tryptophan catabolism in follicular lymphoma. Hematol Oncol. 2020 Dec;38(5):742-753. doi: 10.1002/hon.2804. Epub 2020 Sep 29. (2020)
- Sakamoto Y, Ishida T, Masaki A, Takeshita M, Iwasaki H, Yonekura K, Tashiro Y, Ito A, Kusumoto S, Utsunomiya A, Iida S, Ueda R, Inagaki H: Clinical significance of CD28 gene-related activating alterations in adult T-cell leukaemia/lymphoma. Br J Haematol. 2021 Jan;192(2):281-291. doi: 10.1111/bjh.17211. Epub 2020 Nov 18. (2020)
- Yonekura K, Kusumoto S, Choi I, Nakano N, Ito A, Suehiro Y, Imaizumi Y, Yoshimitsu M, Nosaka K, Ohtsuka E, Hidaka M, Jo T, Sasaki H, Moriuchi Y, Ogata M, Tatetsu H, Ishitsuka K, Miyazaki Y, Ueda R, Utsunomiya A, Ishida T: Mogamulizumab for adult T-cell leukemia-lymphoma: a multicenter prospective observational study. Blood Adv. 2020 Oct 27;4(20):5133-5145. doi: 10.1182/bloodadvances.2020003053. (2020)
- Totani H, Shinjo K, Suzuki M, Katsushima K, Mase S, Masaki A, Ito A, Ri M, Kusumoto S, Komatsu H, Ishida T, Inagaki H, Iida S, Kondo Y: Autocrine HGF/c-Met signaling pathway confers aggressiveness in lymph node adult T-cell leukemia/lymphoma. Oncogene. 2020 Aug;39(35):5782-5794. doi: 10.1038/s41388-020-01393-x. Epub 2020 Aug 4. (2020)
- Saito M, Ishii T, Urakawa I, Matsumoto A, Masaki A, Ito A, Kusumoto S, Suzuki S, Takahashi T, Morita A, Inagaki H, Iida S, Ishida T: Robust CD8+ T-cell proliferation and diversification after mogamulizumab in patients with adult T-cell leukemia-lymphoma. Blood Adv. 2020 May 26;4(10):2180-2191. doi: 10.1182/bloodadvances.2020001641. (2020)
- Shu S, Wu HJ, Ge JY, Zeid R, Harris IS, Jovanović B, Murphy K, Wang B, Qiu X, Endress JE, Reyes J, Lim K, Font-Tello A, Syamala S, Xiao T, Reddy Chilamakuri CS, Papachristou EK, D'Santos C, Anand J, Hinohara K, Li W, McDonald TO, Luoma A, Modiste RJ, Nguyen QD, Michel B, Cejas P, Kadoch C, Jaffe JD, Wucherpfennig KW, Qi J, Liu XS, Long H, Brown M, Carroll JS, Brugge JS, Bradner J, Michor F, Polyak K: Synthetic Lethal and Resistance Interactions with BET Bromodomain Inhibitors in Triple-Negative Breast Cancer. Mol Cell. 2020 Jun 18;78(6):1096-1113.e8. Epub 2020 May 15. (2020)
- Seo W, Shimizu K, Kojo S, Okeke A, Kohwi-Shigematsu T, Fujii SI, Taniuchi I: Runx-mediated regulation of CCL5 via antagonizing two enhancers influences immune cell function and anti-tumor immunity. Nat Commun. 2020 Mar 26;11(1):1562. doi: 10.1038/s41467-020-15375-w. (2020)
- Kojo S, Ohno-Oishi M, Wada H, Nieke S, Seo W, Muroi S, Taniuchi I: Constitutive CD8 expression drives innate CD8+ T-cell differentiation via induction of iNKT2 cells. Life Sci Alliance. 2020 Jan 24;3(2):e202000642. doi: 10.26508/lsa.202000642. Print 2020 Feb (2020)
- Seo W, Taniuchi I: The Roles of RUNX Family Proteins in Development of Immune Cells. Mol Cells. 2020 Feb 29;43(2):107-113. doi: 10.14348/molcells.2019.0291. (2020)
- Tenno M, Wong AYW, Ikegaya M, Miyauchi E, Seo W, See P, Kato T, Taida T, Ohno-Oishi M, Ohno H, Yoshida H, Ginhoux F, Taniuchi I: Essential functions of Runx/Cbfβ in gut conventional dendritic cells for priming Rorγt + T cells. Life Sci Alliance. 2019 Dec 9;3(1):e201900441. doi: 10.26508/lsa.201900441. Print 2020 Jan. (2020)
- Kato S, Weng QY, Insco ML, Chen KY, Muralidhar S, Poźniak J, Diaz JM Drier Y, Nguyen N, Lo JA, van Rooijen E, Kemeny LV, Zhan Y, Feng Y, Silkworth W, Powell CT, Liau BB, Xiong Y, Jin J, Newton-Bishop J, Zon LI, Bernstein BE, Fisher DE: Gain-of-function genetic alterations of G9a drive oncogenesis. Cancer Discovery. 2020 Jul;10(7):980-997. doi: 10.1158/2159-8290.CD-19-0532. Epub 2020 Apr (2020)
- 2019年
- Tokunaga A, Sugiyama D, Maeda Y, Warner AB, Panageas KS, Ito S, Togashi Y, Sakai C, Wolchok JD, Nishikawa H: Selective inhibition of low-affinity memory CD8+ T cells by corticosteroids. J Exp Med. 216(12):2701-2713 2019.
- Kamada T, Togashi Y, Tay C, Ha D, Sasaki A, Nakamura Y, Sato E, Fukuoka S, Tada Y, Tanaka A, Morikawa H, Kawazoe A, Kinoshita T, Shitara K, Sakaguchi S, Nishikawa H.: PD-1+ regulatory T cells amplified by PD-1 blockade promote hyperprogression of cancer. Proc Natl Acad Sci USA. 116 (20):9999-10008 2019.
- Tanegashima T, Togashi Y, Azuma K, Kawahara A, Ideguchi K, Sugiyama D, Kinoshita F, Akiba J, Kashiwagi E, Takeuchi A, Irie T, Tatsugami K, Hoshino T, Eto M. Nishikawa H.: Immune suppression by PD-L2 against spontaneous and treatment-related antitumor immunity. Clin Cancer Res. 25(15):4808-4819 2019.
- Togashi Y, Shitara K, Nishikawa H.: Regulatory T cells in cancer immunosuppression - Implications for anticancer therapy. Nat Rev Clin Oncol. 16(6):356-371 2019.
- Ohue Y, Nishikawa H.: Regulatory T (Treg) cells in cancer: can Treg cells be a new therapeutic target? Cancer Sci. 110(7):2080-2089 2019.
- Kochin V, Nishikawa H.: Meddling with meddlers: curbing regulatory T cells and augmenting antitumor immunity. Nagoya J Med Sci. 81(1):1-18 2019.
- Datta M, Coussens LM, Nishikawa H, Hodi FS, Jain RK.: R Reprogramming the Tumor Microenvironment to Improve Immunotherapy: Emerging Strategies and Combination Therapies. Am Soc Clin Oncol Educ Book. Jan; 39:165-174 2019.
- Doi T, Muro K, Ishii H, Kato T, Tsushima T, Takenoyama M, Oizumi S, Gemmoto K, Suna H, Enokitani K, Kawakami T, Nishikawa H, Yamamoto N.: A phase 1 study of the anti-CC chemokine receptor 4 antibody, mogamulizumab, in combination with nivolumab in patients with advanced or metastatic solid tumors. Clin Cancer Res. 25(22):6614-6622. 2019.
- Ha D, Tanaka A, Kibayashi T, Tanemura A, Sugiyama D, Wing JB, Lim EL, Teng KWW, Adeegbe D, Newell EW, Katayama I, Nishikawa H, Sakaguchi S.: Differential control of human Treg and effector T cells in tumor immunity by Fc-engineered anti-CTLA-4 antibody. Proc Natl Acad Sci USA. 116(2):609-618 2019.
- Minoura K, Abe K, Maeda Y, Nishikawa H, Shimamura T.: Model-based cell clustering and population tracking for time-series flow cytometry data. BMC Bioinformatics. Dec 27;20(Suppl 23):633 2019
- Inozume T, Yaguchi T, Ariyasu R, Togashi Y, Ohnuma T, Honobe A, Nishikawa H, Kawakami Y, Kawamura T: Analysis of the Tumor Reactivity of Tumor-Infiltrating Lymphocytes in a Metastatic Melanoma Lesion that Lost Major Histocompatibility Complex Class I Expression after Anti-PD-1 Therapy. J Invest Dermatol. 139(7):1490-1496. 2019.
- Kawazoe A, Shitara K, Kuboki Y, Bando H, Kojima T, Yoshino T, Ohtsu A, Ochiai A, Togashi Y, Nishikawa H, Doi T, Kuwata T.: Clinicopathological features of 22C3 PD-L1 expression with mismatch repair, Epstein-Barr virus status, and cancer genome alterations in metastatic gastric cancer. Gastric Cancer. 22(1):69-76 2019.
- Kataoka K, Miyoshi H, Sakata S, Dobashi A, Couronné L, Kogure Y, Sato Y, Nishida K, Gion Y, Shiraishi Y, Tanaka H, Chiba K, Watatani Y, Kakiuchi N, Shiozawa Y, Yoshizato T, Yoshida K, Makishima H, Sanada M, Onozawa M, Teshima T, Yoshiki Y, Ishida T, Suzuki K, Shimada K, Tomita A, Kato M, Ota Y, Izutsu K, Demachi-Okamura A, Akatsuka Y, Miyano S, Yoshino T, Gaulard P, Hermine O, Takeuchi K, Ohshima K, Ogawa S: Frequent structural variations involving programmed death ligands in Epstein-Barr virus-associated lymphomas. Leukemia. 2019 Jul;33(7):1687-1699. doi: 10.1038/s41375-019-0380-5. Epub 2019 Jan 25.
- Akatsuka Y. [Progress in immune checkpoint inhibitor therapies]: Rinsho Ketsueki. 2019;60(9):1341-1350. Japanese. doi: 10.11406/rinketsu.60.1341.
- Yoshida T, Ri M, Fujinami H, Oshima Y, Tachita T, Marumo Y, Sasaki H, Kinoshita S, Totani H, Narita T, Masaki A, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S: Impact of chromosomal abnormalities on the efficacy of lenalidomide plus dexamethasone treatment in patients with relapsed/refractory multiple myeloma. Int J Hematol. 2019 Aug;110(2):228-236. doi: 10.1007/s12185-019-02669-z. Epub 2019 May 22. (2019)
- Sakamoto Y, Fujii K, Murase S, Nakano S, Masaki A, Murase T, Kusumoto S, Iida S, Utsunomiya A, Ueda R, Ishida T, Inagaki H: CCR4 is rarely expressed in CCR4-mutated T/NK-cell lymphomas other than adult T-cell leukemia/lymphoma. Int J Hematol. 2019 Oct;110(4):389-392. doi: 10.1007/s12185-019-02728-5. Epub 2019 Aug 29. (2019)
- Suzuki Y, Saito M, Ishii T, Urakawa I, Matsumoto A, Masaki A, Ito A, Kusumoto S, Suzuki S, Hiura M, Takahashi T, Morita A, Inagaki H, Iida S, Ishida T: Mogamulizumab Treatment Elicits Autoantibodies Attacking the Skin in Patients with Adult T-Cell Leukemia-Lymphoma. Clin Cancer Res. 2019 Jul 15;25(14):4388-4399. doi: 10.1158/1078-0432.CCR-18-2575. Epub 2019 Apr 24 (2019)
- Sasaki H, Mitani S, Kusumoto S, Marumo Y, Asano A, Yoshida T, Narita T, Ito A, Yano H, Ri M, Ishida T, Komatsu H, Iida S: Pre- and post-transplant ponatinib for a patient with acute megakaryoblastic blast phase chronic myeloid leukemia with T315I mutation who underwent allogeneic hematopoietic stem cell transplantation. Int J Hematol. 2019 Jul;110(1):119-123. doi: 10.1007/s12185-019-02628-8. Epub 2019 Mar 16. (2019)
- Ding L, Su Y, Fassl A, Hinohara K, Qiu X, Harper NW, Huh SJ, Bloushtain-Qimron N, Jovanović B, Ekram M, Zi X, Hines WC, Alečković M, Gil Del Alcazar C, Caulfield RJ, Bonal DM, Nguyen QD, Merino VF, Choudhury S, Ethington G, Panos L, Grant M, Herlihy W, Au A, Rosson GD, Argani P, Richardson AL, Dillon D, Allred DC, Babski K, Kim EMH, McDonnell CH 3rd, Wagner J, Rowberry R, Bobolis K, Kleer CG, Hwang ES, Blum JL, Cristea S, Sicinski P, Fan R, Long HW, Sukumar S, Park SY, Garber JE, Bissell M, Yao J, Polyak K: Perturbed myoepithelial cell differentiation in BRCA mutation carriers and in ductal carcinoma in situ. Nat Commun. 2019 Sep 13;10(1):4182. (2019)
- An J, Naruse TK, Hinohara K, Soejima Y, Sawabe M, Nakagawa Y, Kuwahara K, Kimura A: MRTF-A regulates proliferation and survival properties of pro-atherogenic macrophages. J Mol Cell Cardiol. 2019 Aug;133:26-35. Epub 2019 May 22. (2019)
- Hinohara K, Polyak K: Intratumoral Heterogeneity: More Than Just Mutations. Trends Cell Biol. 2019 Jul;29(7):569-579. Epub 2019 Apr 12. (2019)
- Ding L, Shunkwiler LB, Harper NW, Zhao Y, Hinohara K, Huh SJ, Ekram MB, Guz J, Kern MJ, Awgulewitsch A, Shull JD, Smits BMG, Polyak K: Deletion of Cdkn1b in ACI rats leads to increased proliferation and pregnancy-associated changes in the mammary gland due to perturbed systemic endocrine environment. PLoS Genet. 2019 Mar 20;15(3):e1008002. eCollection 2019 Mar. (2019)
- Yamamoto M, Jin C, Hata T, Yasumizu Y, Zhang Y, Hong D, Maeda T, Miyo M, Hiraki M, Suzuki Y, Hinohara K, Rajabi H, Kufe D: MUC1-C Integrates Chromatin Remodeling and PARP1 Activity in the DNA Damage Response of Triple-Negative Breast Cancer Cells. Cancer Res. 2019 Apr 15;79(8):2031-2041. Epub 2019 Mar 1. (2019)
- Hinohara K, Wu HJ, Sébastien Vigneau, McDonald TO, Igarashi KJ, Yamamoto KN, Madsen T, Fassl A, Egri SB, Papanastasiou M, Ding L, Peluffo G, Cohen O, Kales SC, Lal-Nag M, Rai G, Maloney DJ, Jadhav A, Simeonov A, Wagle N, Brown M, Meissner A, Sicinski P, Jaffe JD, Jeselsohn R, Gimelbrant AA, Michor F, Polyak K: KDM5 Histone Demethylase Activity Links Cellular Transcriptomic Heterogeneity to Therapeutic Resistance. Cancer Cell. 2019 Feb 11;35(2):330-332. (2019)
- Seo W, Taniuchi I. Too much can be as bad as too little. Nat Immunol. 2019 Oct;20(10):1262-1264. doi: 10.1038/s41590-019-0498-7. (2019)
- Hongo A, Kanaseki T, Tokita S, Kochin V, Miyamoto S, Hashino Y, Codd A, Kawai N, Nakatsugawa M, Hirohashi Y, Sato N, Torigoe T: Upstream Position of Proline Defines Peptide-HLA Class I Repertoire Formation and CD8+ T Cell Responses. J Immunol. 2019 May 15;202(10):2849-2855. doi: 10.4049/jimmunol.1900029. Epub 2019 Apr 1. (2019)
- Xu X, Eshima S, Kato S, Fisher DE, Sakurai H, Hayakawa Y, Yokoyama S: Rational Combination Therapy for Melanoma with Dinaciclib by Targeting BAK-dependent Cell Death. Mol Cancer Ther. 2020 Feb;19(2):627-636. doi: 10.1158/1535-7163.MCT-19-0451. Epub 2019 Nov 19 (2019)
- 2018年
- Tada Y, Togashi Y, Kotani D, Kuwata T, Sato E, Kawazoe A, Doi T, Wada H, Nishikawa H, Shitara K: Targeting VEGFR2 with Ramucirumab strongly impacts effector/activated regulatory T cells and CD8+ T cells in the tumor microenvironment. J. ImmunoTher Cancer 6(1):106 2018.
- Takeuchi Y, Tanemura A, Tada Y, Katayama I, Kumanogoh A, Nishikawa H.: Clinical response to PD-1 blockade correlates with a sub-fraction of peripheral central memory CD4+ T cells in patients with malignant melanoma. Int Immunol. 30(1):13-22 2018.
- Shitara K, Nishikawa H.: Regulatory T cells: a potential target in cancer immunotherapy. Ann NY Acad Sci. 1417 (1):104-115 2018.
- Ueda T, Aokage K, Mimaki S, Tane K, Miyoshi T, Sugano M, Kojima M, Fujii S, Kuwata T, Ochiai A, Kusumoto M, Suzuki K, Tsuchihara K, Nishikawa H, Goto K, Tsuboi M, Ishii G.: Characterization of the tumor immune-microenvironment of lung adenocarcinoma associated with usual interstitial pneumonia. Lung Cancer. 126:162-169 2018.
- Takahashi N, Nishiwaki K, Nakaseko C, Aotsuka N, Sano K, Ohwada C, Kuroki J, Kimura H, Tokuhira M, Mitani K, Fujikawa K, Iwase O, Ohishi K, Kimura F, Fukuda T, Tanosaki S, Takahashi S, Kameoka Y, Nishikawa H, Wakita H.: Treatment-free remission after two-year consolidation therapy with nilotinib in patients with chronic myeloid leukemia: STAT2 trial in Japan. Haematologica. 103(11):1835-1842. 2018.
- Shitaoka K, Hamana H, Kishi H, Hayakawa Y, Kobayashi E, Sukegawa K, Piao X, Lyu F, Nagata T, Sugiyama D, Nishikawa H, Tanemura A, Katayama I, Murahashi M, Takamatsu Y, Tani K, Ozawa T, Muraguchi A.: Identification of Tumoricidal TCRs from Tumor-Infiltrating Lymphocytes by Single-Cell Analysis. Cancer Immunol Res. 6 (4):378-388 2018.
- Ueda T, Aokage K, Nishikawa H, Neri S, Nakamura H, Sugano M, Tane K, Miyoshi T, Kojima M, Fujii S, Kuwata T, Ochiai A, Kusumoto M, Suzuki K, Tsuboi M, Ishii G.: Clinical response to PD-1 blockade correlates with a sub-fraction ofripheral central memory CD4+ T cells in patients with malignant melanoma. J Cancer Res Clin Oncol. 44 (5):835-844 2018.
- Ohta R, Demachi-Okamura A, Akatsuka Y, Fujiwara H, Kuzushima K: Improving TCR affinity on 293T cells. J Immunol Methods. 2019 Mar;466:1-8. doi: 10.1016/j.jim.2018.11.010. Epub 2018 Nov 22.
- Matsuura H, Akatsuka Y, Matsuno T, Sugiura Y, Arakawa S, Oikawa S, Yoshida J, Kosugi M, Emi N: Comparison of the tube test and column agglutination techniques for anti-A/-B antibody titration in healthy individuals. Vox Sang. 2018 Nov;113(8):787-794. doi: 10.1111/vox.12713. Epub 2018 Sep 24.
- Akahori Y, Wang L, Yoneyama M, Seo N, Okumura S, Miyahara Y, Amaishi Y, Okamoto S, Mineno J, Ikeda H, Maki T, Fujiwara H, Akatsuka Y, Kato T, Shiku H: Antitumor activity of CAR-T cells targeting the intracellular oncoprotein WT1 can be enhanced by vaccination. Blood. 2018 Sep 13;132(11):1134-1145. doi: 10.1182/blood-2017-08-802926. Epub 2018 Jul 25.
- Espinoza JL, Elbadry MI, Chonabayashi K, Yoshida Y, Katagiri T, Harada K, Nakagawa N, Zaimoku Y, Imi T, Takamatsu H, Ozawa T, Maruyama H, Hassanein HA, Khalifa A Noreldin A, Takenaka K, Akashi K, Hamana H, Kishi H, Akatsuka Y, Nakao S: Hematopoiesis by iPSC-derived hematopoietic stem cells of aplastic anemia that escape cytotoxic T-cell attack. Blood Adv. 2018 Feb 27;2(4):390-400. doi: 10.1182/bloodadvances.2017013342.
- Kinoshita S, Ishida T, Ito A, Narita T, Masaki A, Suzuki S, Yoshida T, Ri M, Kusumoto S, Komatsu H, Shimizu N, Inagaki H, Kuroda T, Scholz A, Ueda R, Sanda T, Iida S: Cyclin-dependent kinase 9 as a potential specific molecular target in NK-cell leukemia/lymphoma. Haematologica. 2018 Dec;103(12):2059-2068. doi: 10.3324/haematol.2018.191395. Epub 2018 Aug 3. (2018)
- Sakamoto Y, Ishida T, Masaki A, Murase T, Yonekura K, Tashiro Y, Tokunaga M, Utsunomiya A, Ito A, Kusumoto S, Iida S, Ueda R, Inagaki H: CCR4 mutations associated with superior outcome of adult T-cell leukemia/lymphoma under mogamulizumab treatment. Blood. 2018 Aug 16;132(7):758-761. doi: 10.1182/blood-2018-02-835991. Epub 2018 Jun 21. (2018)
- Ishitsuka K, Utsunomiya A, Ishida T: PD-1 Inhibitor Therapy in Adult T-Cell Leukemia–Lymphoma. N Engl J Med. 2018 Aug 16;379(7):695. doi: 10.1056/NEJMc1807852. (2018)
- Masaki A, Ishida T, Suzuki S, Ito A, Narita T, Kinoshita S, Ri M, Kusumoto S, Komatsu H, Inagaki H, Ueda R, Iida S: Human T-cell lymphotropic/leukemia virus type 1 (HTLV-1) Tax-specific T-cell exhaustion in HTLV-1-infected individuals. Cancer Sci. 2018 Aug;109(8):2383-2390. doi: 10.1111/cas.13654. Epub 2018 Jun 27. (2018)
- Yoshida T, Ri M, Kinoshita S, Narita T, Totani H, Ashour R, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S: Low expression of neural cell adhesion molecule, CD56, is associated with low efficacy of bortezomib plus dexamethasone therapy in multiple myeloma. PLoS One. 2018 May 8;13(5):e0196780. doi: 10.1371/journal.pone.0196780. eCollection 2018. (2018)
- Kinoshita S, Ri M, Kanamori T, Aoki S, Yoshida T, Narita T, Totani H, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S: Potent antitumor effect of combination therapy with sub-optimal doses of Akt inhibitors and pomalidomide plus dexamethasone in multiple myeloma. Oncol Lett. 2018 Jun;15(6):9450-9456. doi: 10.3892/ol.2018.8501. Epub 2018 Apr 16. (2018)
- Kanamori T, Kusumoto S, Okita K, Hagiwara S, Kato C, Nakashima T, Murakami S, Narita T, Ito A, Ri M, Ishida T, Komatsu H, Matsukawa N, Iida S: [Sporadic late-onset nemaline myopathy with monoclonal gammopathy of undetermined significance mimicking POEMS syndrome]. Rinsho Ketsueki. 2018;59(2):161-166. doi: 10.11406/rinketsu.59.161. (2018)
- Ishida T, Jo T, Takemoto S, Suzushima H, Suehiro Y, Choi I, Yoshimitsu M, Saburi Y, Nosaka K, Utsunomiya A, Kobayashi Y, Yamamoto K, Fujiwara H, Ishitsuka K, Yoshida S, Taira N, Imada K, Kato K, Moriuchi Y, Yoshimura K, Takahashi T, Tobinai K, Ueda R: Follow-up of a randomised phase II study of chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: impact on allogeneic haematopoietic stem cell transplantation. Br J Haematol. 2019 Feb;184(3):479-483. doi: 10.1111/bjh.15123. Epub 2018 Feb 7. (2018)
- Yoshida T, Ri M, Kanamori T, Aoki S, Ashour R, Kinoshita S, Narita T, Totani H, Masaki A, Ito A, Kusumoto S, Ishida T, Komatsu H, Kitahata S, Chiba T, Ichikawa S, Iida S: Potent anti-tumor activity of a syringolin analog in multiple myeloma: a dual inhibitor of proteasome activity targeting β2 and β5 subunits. Oncotarget. 2018 Jan 11;9(11):9975-9991. doi: 10.18632/oncotarget.24160. eCollection 2018 Feb 9. (2018)
- Aiki S, Okuyama T, Sugano K, Kubota Y, Imai F, Nishioka M, Ito Y, Iida S, Komatsu H, Ishida T, Kusumoto S, Akechi T: Cognitive dysfunction among newly diagnosed older patients with hematological malignancy: frequency, clinical indicators and predictors. Jpn J Clin Oncol. 2018 Jan 1;48(1):61-67. doi: 10.1093/jjco/hyx159. (2018)
- Xing S, Shao P, Li F, Zhao X, Seo W, Wheat JC, Ramasamy S, Wang J, Li X, Peng W, Yu S, Liu C, Taniuchi I, Sweetser DA, Xue HH: Tle corepressors are differentially partitioned to instruct CD8+ T cell lineage choice and identity. J Exp Med. 2018 Aug 6;215(8):2211-2226. doi: 10.1084/jem.20171514. Epub 2018 Jul 25. (2018)
- Kim KH, Ree JH, Kim Y, Kim S, Kang SY, Seo W: Assessing whether the 2017 Mw 5.4 Pohang earthquake in South Korea was an induced event. Science. 2018 Jun 1;360(6392):1007-1009. doi: 10.1126/science.aat6081. Epub 2018 Apr 26. (2018)
- Sasaki H, Mitani S, Kusumoto S, Marumo Y, Asano A, Yoshida T, Narita T, Ito A, Yano H, Ri M, Ishida T, Komatsu H, Iida S: Pre- and post-transplant ponatinib for a patient with acute megakaryoblastic blast phase chronic myeloid leukemia with T315I mutation who underwent allogeneic hematopoietic stem cell transplantation. Int J Hematol. 2019 Jul;110(1):119-123. doi: 10.1007/s12185-019-02628-8. Epub 2019 Mar 16.
- Ishida T, Jo T, Takemoto S, Suzushima H, Suehiro Y, Choi I, Yoshimitsu M, Saburi Y, Nosaka K, Utsunomiya A, Kobayashi Y, Yamamoto K, Fujiwara H, Ishitsuka K, Yoshida S, Taira N, Imada K, Kato K, Moriuchi Y, Yoshimura K, Takahashi T, Tobinai K, Ueda R: Follow-up of a randomised phase II study of chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: impact on allogeneic haematopoietic stem cell transplantation. Br J Haematol. 2019 Feb;184(3):479-483. doi: 10.1111/bjh.15123. Epub 2018 Feb 7.
- Kinoshita S, Ishida T, Ito A, Narita T, Masaki A, Suzuki S, Yoshida T, Ri M, Kusumoto S, Komatsu H, Shimizu N, Inagaki H, Kuroda T, Scholz A, Ueda R, Sanda T, Iida S: Cyclin-dependent kinase 9 as a potential specific molecular target in NK-cell leukemia/lymphoma. Haematologica. 2018 Dec;103(12):2059-2068. doi: 10.3324/haematol.2018.191395. Epub 2018 Aug 3.
- Sakamoto Y, Ishida T, Masaki A, Murase T, Yonekura K, Tashiro Y, Tokunaga M, Utsunomiya A, Ito A, Kusumoto S, Iida S, Ueda R, Inagaki H: CCR4 mutations associated with superior outcome of adult T-cell leukemia/lymphoma under mogamulizumab treatment. Blood. 2018 Aug 16;132(7):758-761. doi: 10.1182/blood-2018-02-835991. Epub 2018 Jun 21.
- Ishitsuka K, Utsunomiya A, Ishida T: PD-1 Inhibitor Therapy in Adult T-Cell Leukemia–Lymphoma. N Engl J Med. 2018 Aug 16;379(7):695. doi: 10.1056/NEJMc1807852.
- Masaki A, Ishida T, Suzuki S, Ito A, Narita T, Kinoshita S, Ri M, Kusumoto S, Komatsu H, Inagaki H, Ueda R, Iida S: Human T-cell lymphotropic/leukemia virus type 1 (HTLV-1) Tax-specific T-cell exhaustion in HTLV-1-infected individuals. Cancer Sci. 2018 Aug;109(8):2383-2390. doi: 10.1111/cas.13654. Epub 2018 Jun 27.
- Yoshida T, Ri M, Kinoshita S, Narita T, Totani H, Ashour R, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S.: Low expression of neural cell adhesion molecule, CD56, is associated with low efficacy of bortezomib plus dexamethasone therapy in multiple myeloma. PLoS One. 2018 May 8;13(5):e0196780. doi: 10.1371/journal.pone.0196780. eCollection 2018.
- Kinoshita S, Ri M, Kanamori T, Aoki S, Yoshida T, Narita T, Totani H, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S: Potent antitumor effect of combination therapy with sub-optimal doses of Akt inhibitors and pomalidomide plus dexamethasone in multiple myeloma. Oncol Lett. 2018 Jun;15(6):9450-9456. doi: 10.3892/ol.2018.8501. Epub 2018 Apr 16.
- Kanamori T, Kusumoto S, Okita K, Hagiwara S, Kato C, Nakashima T, Murakami S, Narita T, Ito A, Ri M, Ishida T, Komatsu H, Matsukawa N, Iida S.: [Sporadic late-onset nemaline myopathy with monoclonal gammopathy of undetermined significance mimicking POEMS syndrome]. Rinsho Ketsueki. 2018;59(2):161-166. doi: 10.11406/rinketsu.59.161.
- Hinohara K, Wu HJ, Vigneau S, McDonald TO, Igarashi KJ, Yamamoto KN, Madsen T, Fassl A, Egri SB, Papanastasiou M, Ding L, Peluffo G, Cohen O, Kales SC, Lal-Nag M, Rai G, Maloney DJ, Jadhav A, Simeonov A, Wagle N, Brown M, Meissner A, Sicinski P, Jaffe JD, Jeselsohn R, Gimelbrant AA, Michor F, Polyak K: KDM5 Histone Demethylase Activity Links Cellular Transcriptomic Heterogeneity to Therapeutic Resistance. Cancer Cell. 2018 Dec 10;34(6):939-953.e9. Epub 2018 Nov 21. (2018)
- Ben-David U, Siranosian B, Ha G, Tang H, Oren Y, Hinohara K, Strathdee CA, Dempster J, Lyons NJ, Burns R, Nag A, Kugener G, Cimini B, Tsvetkov P, Maruvka YE, O'Rourke R, Garrity A, Tubelli AA, Bandopadhayay P, Tsherniak A, Vazquez F, Wong B, Birger C, Ghandi M, Thorner AR, Bittker JA, Meyerson M, Getz G, Beroukhim R, Golub TR: Genetic and transcriptional evolution alters cancer cell line drug response. Nature. 2018 Aug;560(7718):325-330. Epub 2018 Aug 8. (2018)
- Komura K, Yoshikawa Y, Shimamura T, Chakraborty G, Gerke TA, Hinohara K, Chadalavada K, Jeong SH, Armenia J, Du SY, Mazzu YZ, Taniguchi K, Ibuki N, Meyer CA, Nanjangud GJ, Inamoto T, Lee GM, Mucci LA, Azuma H, Sweeney CJ, Kantoff PW: ATR inhibition controls aggressive prostate tumors deficient in Y-linked histone demethylase KDM5D. J Clin Invest. 2018 Jul 2;128(7):2979-2995. Epub 2018 Jun 4. (2018)
- Miyamoto S, Kochin V, Kanaseki T, Hongo A, Tokita S, Kikuchi Y, Takaya A, Hirohashi Y, Tsukahara T, Terui T, Ishitani K, Hata F, Takemasa I, Miyazaki A, Hiratsuka H, Sato N, Torigoe T: The Antigen ASB4 on Cancer Stem Cells Serves as a Target for CTL Immunotherapy of Colorectal Cancer. Cancer Immunol Res. 2018 Mar;6(3):358-369. doi: 10.1158/2326-6066.CIR-17-0518. Epub 2018 Jan 25. (2018)
- Watanabe K, Yokoyama S, Kaneto N, Hori T, Iwakami Y, Kato S, Hayakawa Y, Sakurai H, Fukuoka J, Saiki I: COPS9 signalosome subunit 5 regulates cancer metastasis by deubiquitinating SNAIL. Oncotarget. 2018 Apr 17;9(29):20670-20680. doi: 10.18632/oncotarget.25060. (2018)
- 2017年
- Togashi Y, Nishikawa H: Suppression from beyond the grave. Nat Immunol. 18(12):1285-1286 2017.
- Nishiwaki S, Sugiura I, Miyata Y, Saito S, Sawa M, Nishida T, Miyamura K, Kuwatsuka Y, Kohno A, Yuge M, Kasai M, Iida H, Kurahashi S, Osaki M, Goto T, Terakura S, Murata M, Nishikawa H and Kiyoi H.: Efficacy and safety of autologous peripheral blood stem cell transplantation for Philadelphia chromosome-positive acute lymphoblastic leukemia: A study protocol for a multicenter exploratory prospective study (Auto-Ph17 study). Medicine Dec;96(52):e9568 2017.
- Enokida T, Nishikawa H.: Regulatory T cells, as a target in anticancer immunotherapy. Immunotherapy. 9(8):623-627 2017.
- Togashi Y, Nishikawa H: Regulatory T Cells: Molecular and Cellular Basis for Immunoregulation. Curr Top Microbiol Immunol. 2017 Sep 7.
- Doki N, Suyama M, Sasajima S, Ota J, Igarashi A, Mimura I, Morita H, Fujioka Y, Sugiyama D, Nishikawa H, Shimazu Y, Suda W, Takeshita K, Atarashi K, Hattori M, Sato E, Watakabe-Inamoto K, Yoshioka K, Najima Y, Kobayashi T, Kakihana K, Takahashi N, Sakamaki H, Honda K, Ohashi K: Clinical impact of pre-transplant gut microbial diversity on outcomes of allogeneic hematopoietic stem cell transplantation. Ann Hematol. 96 (9):1517-1523 2017.
- Nagase H, Takeoka T, Urakawa S, Morimoto-Okazawa A, Kawashima A, Iwahori K, Takiguchi S, Nishikawa H, Sato E, Sakaguchi S, Mori M, Doki Y and Wada H.: ICOS+ Foxp3+TILs in gastric cancer are prognostic markers and effector regulatory T cells associated with Helicobacter pylori. Int J Cancer. 140(3):686-695 2017.
- Takeoka T, Nagase H, Kurose K, Ohue Y, Yamasaki M, Takiguchi S, Sato E, Isobe M, Kanazawa T, Matsumoto M, Iwahori K, Kawashima A, Morimoto-Okazawa A, Nishikawa H, Oka M, Pan L, Venhaus R, Nakayama E, Mori M, Doki Y and Wada H.; NY-ESO-1 Protein Cancer Vaccine With Poly-ICLC and OK-432: Rapid and Strong Induction of NY-ESO-1-specific Immune Responses by Poly-ICLC. J Immunother. Mar 23 2017.
- Hamano Y, Kida H, Ihara S, Murakami A, Yanagawa M, Ueda K, Honda O, Tripathi LP, Arai T, Hirose M, Hamasaki T, Yano Y, Kimura T, Kato Y, Takamatsu H, Otsuka T, Minami T, Hirata H, Inoue K, Nagatomo I, Takeda Y, Mori M, Nishikawa H, Mizuguchi K, Kijima T, Kitaichi M, Tomiyama N, Inoue Y and Kumanogoh A: Classification of idiopathic interstitial pneumonias using anti-myxovirus resistance-protein 1 autoantibody. Sci Rep. 7:43201. 2017.
- 10.\tAbe A, Yamamoto Y, Katsumi A, Okamoto A, Tokuda M, Inaguma Y, Yamamoto K, Yanada M, Kanie T, Tomita A, Akatsuka Y, Okamoto M, Kameyama T, Mayeda A, Emi N: Rearrangement of VPS13B, a causative gene of Cohen syndrome, in a case of RUNX1-RUNX1T1 leukemia with t(8;12;21). Int J Hematol. 2018 Aug;108(2):208-212. doi: 10.1007/s12185-017-2387-x. Epub 2017 Dec 20.
- Harada Y, Nishiwaki S, Sugimoto T, Onodera K, Goto T, Sato T, Kamoshita S, Kawashima N, Seto A, Okuno S, Yamamoto S, Iwasaki T, Ozawa Y, Miyamura K, Akatsuka Y, Sugiura I: Successful treatment with allogeneic stem cell transplantation followed by DLI and TKIs for e6a2 BCR-ABL-positive acute myeloid leukaemia: A case report and literature review. Medicine (Baltimore). 2017 Dec;96(50):e9160. doi: 10.1097/MD.0000000000009160.
- Tawara I, Kageyama S, Miyahara Y, Fujiwara H, Nishida T, Akatsuka Y, Ikeda H, Tanimoto K, Terakura S, Murata M, Inaguma Y, Masuya M, Inoue N, Kidokoro T, Okamoto S, Tomura D, Chono H, Nukaya I, Mineno J, Naoe T, Emi N, Yasukawa M, Katayama N, Shiku H: Safety and persistence of WT1-specific T-cell receptor gene-transduced lymphocytes in patients with AML and MDS. Blood. 2017 Nov 2;130(18):1985-1994. doi: 10.1182/blood-2017-06-791202. Epub 2017 Aug 31.
- Masaki A, Ishida T, Maeda Y, Ito A, Suzuki S, Narita T, Kinoshita S, Takino H, Yoshida T, Ri M, Kusumoto S, Komatsu H, Inagaki H, Ueda R, Choi I, Suehiro Y, Iida S: Clinical significance of tryptophan catabolism in Hodgkin lymphoma. Cancer Sci. 2018 Jan;109(1):74-83. doi: 10.1111/cas.13432. Epub 2017 Nov 29. (2017)
- Yoshimitsu M, Tanosaki R, Kato K, Ishida T, Choi I, Takatsuka Y, Fukuda T, Eto T, Hidaka M, Uchida N, Miyamoto T, Nakashima Y, Moriuchi Y, Nagafuji K, Miyazaki Y, Ichinohe T, Takanashi M, Atsuta Y, Utsunomiya A: ATL Working Group of the Japan Society for Hematopoietic Cell Transplantation.: Risk Assessment in Adult T Cell Leukemia/Lymphoma Treated with Allogeneic Hematopoietic Stem Cell Transplantation. Biol Blood Marrow Transplant. 2018 Apr;24(4):832-839. doi: 10.1016/j.bbmt.2017.11.005. Epub 2017 Nov 16. (2017)
- Nosaka K, Iwanaga M, Imaizumi Y, Ishitsuka K, Ishizawa K, Ishida Y, Amano M, Ishida T, Uike N, Utsunomiya A, Ohshima K, Kawai K, Tanaka J, Tokura Y, Tobinai K, Watanabe T, Uchimaru K, Tsukasaki K. Epidemiological and clinical features of adult T-cell leukemia-lymphoma in Japan, 2010-2011: A nationwide survey. Cancer Sci. 2017 Dec;108(12):2478-2486. doi: 10.1111/cas.13398. Epub 2017 Oct 8. (2017)
- Wong RWJ, Ngoc PCT, Leong WZ, Yam AWY, Zhang T, Asamitsu K, Iida S, Okamoto T, Ueda R, Gray NS, Ishida T, Sanda T: Enhancer profiling identifies critical cancer genes and characterizes cell identity in adult T-cell leukemia. Blood. 2017 Nov 23;130(21):2326-2338. doi: 10.1182/blood-2017-06-792184. Epub 2017 Oct 4. (2017)
- Kharfan-Dabaja MA, Kumar A, Ayala E, Hamadani M, Reimer P, Gisselbrecht C, d'Amore F, Jantunen E, Ishida T, Bazarbachi A, Foss F, Advani R, Fenske TS, Lazarus HM, Friedberg JW, Aljurf M, Sokol L, Tobinai K, Tse E, Burns LJ, Chavez JC, Reddy NM, Suzuki R, Ahmed S, Nademanee A, Mohty M, Gopal AK, Fanale MA, Pro B, Moskowitz AJ, Sureda A, Perales MA, Carpenter PA, Savani BN: Clinical Practice Recommendations on Indication and Timing of Hematopoietic Cell Transplantation in Mature T Cell and NK/T Cell Lymphomas: An International Collaborative Effort on Behalf of the Guidelines Committee of the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2017 Nov;23(11):1826-1838. doi: 10.1016/j.bbmt.2017.07.027. Epub 2017 Aug 7. (2017)
- Maruyama D, Tobinai K, Ogura M, Uchida T, Hatake K, Taniwaki M, Ando K, Tsukasaki K, Ishida T, Kobayashi N, Ishizawa K, Tatsumi Y, Kato K, Kiguchi T, Ikezoe T, Laille E, Ro T, Tamakoshi H, Sakurai S, Ohtsu T: Romidepsin in Japanese patients with relapsed or refractory peripheral T-cell lymphoma: a phase I/II and pharmacokinetics study. Int J Hematol. 2017 Nov;106(5):655-665. doi: 10.1007/s12185-017-2286-1. Epub 2017 Jun 29.
- Ishida T, Utsunomiya A, Jo T, Yamamoto K, Kato K, Yoshida S, Takemoto S, Suzushima H, Kobayashi Y, Imaizumi Y, Yoshimura K, Kawamura K, Takahashi T, Tobinai K, Ueda R: Mogamulizumab for relapsed adult T-cell leukemia-lymphoma: Updated follow-up analysis of phase I and II studies. Cancer Sci. 2017 Oct;108(10):2022-2029. doi: 10.1111/cas.13343. Epub 2017 Aug 28. (2017)
- Yoshida T, Ri M, Kanamori T, Aoki S, Ashour R, Kinoshita S, Narita T, Totani H, Masaki A, Ito A, Kusumoto S, Ishida T, Komatsu H, Kitahata S, Chiba T, Ichikawa S, Iida S: Potent anti-tumor activity of a syringolin analog in multiple myeloma: a dual inhibitor of proteasome activity targeting β2 and β5 subunits. Oncotarget . 2018 Jan 11;9(11):9975-9991. doi: 10.18632/oncotarget.24160. eCollection 2018 Feb 9.
- Aiki S, Okuyama T, Sugano K, Kubota Y, Imai F, Nishioka M, Ito Y, Iida S, Komatsu H, Ishida T, Kusumoto S, Akechi T: Cognitive dysfunction among newly diagnosed older patients with hematological malignancy: frequency, clinical indicators and predictors. Jpn J Clin Oncol. 2018 Jan 1;48(1):61-67. doi: 10.1093/jjco/hyx159.
- Masaki A, Ishida T, Maeda Y, Ito A, Suzuki S, Narita T, Kinoshita S, Takino H, Yoshida T, Ri M, Kusumoto S, Komatsu H, Inagaki H, Ueda R, Choi I, Suehiro Y, Iida S:
- Clinical significance of tryptophan catabolism in Hodgkin lymphoma. Cancer Sci. 2018 Jan;109(1):74-83. doi: 10.1111/cas.13432. Epub 2017 Nov 29.
- Yoshimitsu M, Tanosaki R, Kato K, Ishida T, Choi I, Takatsuka Y, Fukuda T, Eto T, Hidaka M, Uchida N, Miyamoto T, Nakashima Y, Moriuchi Y, Nagafuji K, Miyazaki Y, Ichinohe T, Takanashi M, Atsuta Y, Utsunomiya A, ATL Working Group of the Japan Society for Hematopoietic Cell Transplantation: Risk Assessment in Adult T Cell Leukemia/Lymphoma Treated with Allogeneic Hematopoietic Stem Cell Transplantation Biol Blood Marrow Transplant. 2018 Apr;24(4):832-839. doi: 10.1016/j.bbmt.2017.11.005. Epub 2017 Nov 16.
- Nosaka K, Iwanaga M, Imaizumi Y, Ishitsuka K, Ishizawa K, Ishida Y, Amano M, Ishida T, Uike N, Utsunomiya A, Ohshima K, Kawai K, Tanaka J, Tokura Y, Tobinai K, Watanabe T, Uchimaru K, Tsukasaki K. Epidemiological and clinical features of adult T-cell leukemia-lymphoma in Japan, 2010-2011: A nationwide survey. Cancer Sci. 2017 Dec;108(12):2478-2486. doi: 10.1111/cas.13398. Epub 2017 Oct 8.
- Wong RWJ, Ngoc PCT, Leong WZ, Yam AWY, Zhang T, Asamitsu K, Iida S, Okamoto T, Ueda R, Gray NS, Ishida T, Sanda T: Enhancer profiling identifies critical cancer genes and characterizes cell identity in adult T-cell leukemia. Blood. 2017 Nov 23;130(21):2326-2338. doi: 10.1182/blood-2017-06-792184. Epub 2017 Oct 4.
- Kharfan-Dabaja MA, Kumar A, Ayala E, Hamadani M, Reimer P, Gisselbrecht C, d'Amore F, Jantunen E, Ishida T, Bazarbachi A, Foss F, Advani R, Fenske TS, Lazarus HM, Friedberg JW, Aljurf M, Sokol L, Tobinai K, Tse E, Burns LJ, Chavez JC, Reddy NM, Suzuki R, Ahmed S, Nademanee A, Mohty M, Gopal AK, Fanale MA, Pro B, Moskowitz AJ, Sureda A, Perales MA, Carpenter PA, Savani BN: Clinical Practice Recommendations on Indication and Timing of Hematopoietic Cell Transplantation in Mature T Cell and NK/T Cell Lymphomas: An International Collaborative Effort on Behalf of the Guidelines Committee of the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2017 Nov;23(11):1826-1838. doi: 10.1016/j.bbmt.2017.07.027. Epub 2017 Aug 7.
- Maruyama D, Tobinai K, Ogura M, Uchida T, Hatake K, Taniwaki M, Ando K, Tsukasaki K, Ishida T, Kobayashi N, Ishizawa K, Tatsumi Y, Kato K, Kiguchi T, Ikezoe T, Laille E, Ro T, Tamakoshi H, Sakurai S, Ohtsu T: Romidepsin in Japanese patients with relapsed or refractory peripheral T-cell lymphoma: a phase I/II and pharmacokinetics study. Int J Hematol. 2017 Nov;106(5):655-665. doi: 10.1007/s12185-017-2286-1. Epub 2017 Jun 29.
- Ishida T, Utsunomiya A, Jo T, Yamamoto K, Kato K, Yoshida S, Takemoto S, Suzushima H, Kobayashi Y, Imaizumi Y, Yoshimura K, Kawamura K, Takahashi T, Tobinai K, Ueda R: Mogamulizumab for relapsed adult T-cell leukemia-lymphoma: Updated follow-up analysis of phase I and II studies. Cancer Sci. 2017 Oct;108(10):2022-2029. doi: 10.1111/cas.13343. Epub 2017 Aug 28.
- Maeda T, Hiraki M, Jin C, Rajabi H, Tagde A, Alam M, Bouillez A, Hu X, Suzuki Y, Miyo M, Hata T, Hinohara K, Kufe D: MUC1-C Induces PD-L1 and Immune Evasion in Triple-Negative Breast Cancer. Cancer Res. 2018 Jan 1;78(1):205-215. Epub 2017 Dec 20. (2017)
- Terai H, Kitajima S, Potter DS, Matsui Y, Quiceno LG, Chen T, Kim TJ, Rusan M, Thai TC, Piccioni F, Donovan KA, Kwiatkowski N, Hinohara K, Wei G, Gray NS, Fischer ES, Wong KK, Shimamura T, Letai A, Hammerman PS, Barbie DA: ER Stress Signaling Promotes the Survival of Cancer \"Persister Cells\" Tolerant to EGFR Tyrosine Kinase Inhibitors. Cancer Res. 2018 Feb 15;78(4):1044-1057. Epub 2017 Dec 19. (2017)
- Kojo S, Tanaka H, Endo TA, Muroi S, Liu Y, Seo W, Tenno M, Kakugawa K, Naoe Y, Nair K, Moro K, Katsuragi Y, Kanai A, Inaba T, Egawa T, Venkatesh B, Minoda A, Kominami R, Taniuchi I: Priming of lineage-specifying genes by Bcl11b is required for lineage choice in post-selection thymocytes. Nat Commun. 2017 Sep 26;8(1):702. doi: 10.1038/s41467-017-00768-1. (2017)
- Kakugawa K, Kojo S, Tanaka H, Seo W, Endo TA, Kitagawa Y, Muroi S, Tenno M, Yasmin N, Kohwi Y, Sakaguchi S, Kowhi-Shigematsu T, Taniuchi I: Essential Roles of SATB1 in Specifying T Lymphocyte Subsets. Cell Rep. 2017 May 9;19(6):1176-1188. doi: 10.1016/j.celrep.2017.04.038. (2017)
- Seo W, Taniuchi I: Regulation of hematopoiesis and immune responses by long non-coding RNAs. Int Immunol. 2017 Apr 1;29(4):165-172. doi: 10.1093/intimm/dxx021. (2017)
- Seo W, Muroi S, Akiyama K, Taniuchi I: Distinct requirement of Runx complexes for TCRβ enhancer activation at distinct developmental stages. Sci Rep. 2017 Feb 2;7:41351. doi: 10.1038/srep41351. (2017)
- Ebihara T, Seo W, Taniuchi I: Roles of RUNX Complexes in Immune Cell Development. Adv Exp Med Biol. 2017;962:395-413. doi: 10.1007/978-981-10-3233-2_24. (2017)
- Tanaka T, Kutomi G, Kajiwara T, Kukita K, Kochin V, Kanaseki T, Tsukahara T, Hirohashi Y, Torigoe T, Okamoto Y, Hirata K, Sato N, Tamura Y: Cancer-associated oxidoreductase ERO1-α promotes immune escape through up-regulation of PD-L1 in human breast cancer. Oncotarget. 2017 Apr 11;8(15):24706-24718. doi: 10.18632/oncotarget.14960. (2017)
- Kochin V, Kanaseki T, Tokita S, Miyamoto S, Shionoya Y, Kikuchi Y, Morooka D, Hirohashi Y, Tsukahara T, Watanabe K, Toji S, Kokai Y, Sato N, Torigoe T: HLA-A24 ligandome analysis of colon and lung cancer cells identifies a novel cancer-testis antigen and a neoantigen that elicits specific and strong CTL responses. Oncoimmunology. 2017 Feb 16;6(4):e1293214. doi: 10.1080/2162402X.2017.1293214. (2017)
- Shionoya Y, Kanaseki T, Miyamoto S, Tokita S, Hongo A, Kikuchi Y, Kochin V, Watanabe K, Horibe R, Saijo H, Tsukahara T, Hirohashi Y, Takahashi H, Sato N, Torigoe T: Loss of tapasin in human lung and colon cancer cells and escape from tumor-associated antigen-specific CTL recognition. Oncoimmunology. 2017 Jan 3;6(2):e1274476. doi: 10.1080/2162402X.2016.1274476. (2017)
- 2016年
- Saito T, Nishikawa H, Wada H, Nagano Y, Sugiyama D, Atarashi K, Maeda Y, Hamaguchi M, Ohkura N, Sato E, Nagase H, Nishimura J, Yamamoto H, Takiguchi S, Tanoue T, Suda W, Morita H, Hattori M, Honda K, Mori M, Doki Y and Sakaguchi S.: Two FOXP3+CD4+ T-cell subpopulations distinctly control the prognosis of colorectal cancers. Nat Med. 22(6):679-684 2016.
- Okubo K, Wada H, Tanaka A, Eguchi H, Hamaguchi M, Tomokuni A, Tomimaru Y, Asaoka T, Hama N, Kawamoto K, Kobayashi S, Marubashi S, Nagano H, Sakaguchi N, Nishikawa H, Doki Y, Mori M, Sakaguchi S.: Identification of Novel and Noninvasive Biomarkers of Acute Cellular Rejection After Liver Transplantation by Protein Microarray. Transplant Direct. 2(12):e118. eCollection 2016 Nov 18. 2016
- Kakihana K, Fujioka Y, Suda W, Najima Y, Kuwata G, Sasajima S, Mimura I, Morita H, Sugiyama D, Nishikawa H, Hattori M, Hino Y, Ikegawa S, Yamamoto K, Toya T, Doki N, Koizumi K, Honda K, Ohashi K.: Fecal microbiota transplantation for patients with steroid-resistant/dependent acute graft-versus-host disease of the gut. Blood. 128(16):2083-2088 2016.
- Haseda F, Imagawa A, Nishikawa H, Mitsui S, Tsutsumi C, Fujisawa R, Sano H, Murase-Mishiba Y, Terasaki J, Sakaguchi S, Hanafusa T.: Antibody to CMRF35-Like Molecule 2, CD300e A Novel Biomarker Detected in Patients with Fulminant Type 1 Diabetes. PLoS One. Aug 11;11(8):e0160576 2016.
- Ureshino H, Shindo T, Nishikawa H, Watanabe N, Watanabe E, Satoh N, Kitaura K, Kitamura H, Doi K, Nagase K, Kimura H, Samukawa M, Kusunoki S, Miyahara M, Shin-I T, Suzuki R, Sakaguchi S, Kimura S.: Effector Regulatory T Cells Reflect the Equilibrium between Antitumor Immunity and Autoimmunity in Adult T-cell Leukemia. Cancer Immunol Res. 4(8):644-649 2016.
- Takeuchi Y, Nishikawa H.: Roles of regulatory T cells in cancer immunity. Int Immunol. 2016 28(8):401-409 2016.
- Shimazu Y, Shimazu Y, Hishizawa M, Hamaguchi M, Nagai Y, Sugino N, Fujii S, Kawahara M, Kadowaki N, Nishikawa H, Sakaguchi S, Takaori-Kondo A: Hypomethylation of the Treg-specific demethylated region in FOXP3 is a hallmark of the regulatory T-cell subtype in adult T-cell leukemia. Cancer Immunol Res. 4(2):136-145 2016.
- Hayakawa Y, Kawada M, Nishikawa H, Ochiya T, Saya H, Seimiya H, Yao R, Hayashi M, Kai C, Matsuda A, Naoe T, Ohtsu A, Okazaki T, Saji H, Sata M, Sugimura H, Sugiyama Y, Toi M, Irimura T: Report on the use of non-clinical studies in the regulatory evaluation of oncology drugs. Cancer Sci. 107(2):189-202 2016.
- Kataoka K, Shiraishi Y, Takeda Y, Sakata S, Matsumoto M, Nagano S, Maeda T, Nagata Y, Kitanaka A, Mizuno S, Tanaka H, Chiba K, Ito S, Watatani Y, Kakiuchi N, Suzuki H, Yoshizato T, Yoshida K, Sanada M, Itonaga H, Imaizumi Y, Totoki Y, Munakata W, Nakamura H, Hama N, Shide K, Kubuki Y, Hidaka T, Kameda T, Masuda K, Minato N, Kashiwase K, Izutsu K, Takaori-Kondo A, Miyazaki Y, Takahashi S, Shibata T, Kawamoto H, Akatsuka Y, Shimoda K, Takeuchi K, Seya T, Miyano S, Ogawa S: Aberrant PD-L1 expression through 3'-UTR disruption in multiple cancers. Nature. 2016 Jun 16;534(7607):402-6. doi: 10.1038/nature18294. Epub 2016 May 23.
- Kobayashi S, Ueda Y, Nannya Y, Shibayama H, Tamura H, Ogata K, Akatsuka Y, Usuki K, Ito Y, Okada M, Suzuki T, Hata T, Matsuda A, Tohyama K, Kakumoto K, Koga D, Mitani K, Naoe T, Sugiyama H, Takaku F: Prognostic significance of Wilms tumor 1 mRNA expression levels in peripheral blood and bone marrow in patients with myelodysplastic syndromes. Cancer Biomark. 2016 Mar 31;17(1):21-32. doi: 10.3233/CBM-160612.
- Yanada M, Yamamoto Y, Iba S, Okamoto A, Inaguma Y, Tokuda M, Morishima S, Kanie T, Mizuta S, Akatsuka Y, Okamoto M, Emi N: TP53 mutations in older adults with acute myeloid leukemia. Int J Hematol. 2016 Apr;103(4):429-35. doi: 10.1007/s12185-016-1942-1. Epub 2016 Jan 18.
- Akatsuka Y. [Historical perspectives and future directions of gene-modified T-cell therapy]: Rinsho Ketsueki. 2016;57(10):2241-2249. Japanese. doi: 10.11406/rinketsu.57.2241.
- Ishida T, Fujiwara H, Nosaka K, Taira N, Abe Y, Imaizumi Y, Moriuchi Y, Jo T, Ishizawa K, Tobinai K, Tsukasaki K, Ito S, Yoshimitsu M, Otsuka M, Ogura M, Midorikawa S, Ruiz W, Ohtsu T: Multicenter Phase II Study of Lenalidomide in Relapsed or Recurrent Adult T-Cell Leukemia/Lymphoma: ATLL-002. J Clin Oncol. 2016 Dec;34(34):4086-4093. doi: 10.1200/JCO.2016.67.7732. Epub 2016 Sep 30. (2016)
- Kato J, Masaki A, Fujii K, Takino H, Murase T, Yonekura K, Utsunomiya A, Ishida T, Iida S, Inagaki H: Quantitative PCR for HTLV-1 provirus in adult T-cell leukemia/lymphoma using paraffin tumor sections. Pathol Int. 2016 Nov;66(11):618-621. doi: 10.1111/pin.12462. Epub 2016 Sep 27. (2016)
- Akechi T, Aiki S, Sugano K, Uchida M, Yamada A, Komatsu H, Ishida T, Kusumoto S, Iida S, Okuyama T: Does cognitive decline decrease health utility value in older adult patients with cancer? Psychogeriatrics. 2017 May;17(3):149-154. doi: 10.1111/psyg.12205. Epub 2016 Jul 13. (2016)
- Ogura M, Ishida T, Tsukasaki K, Takahashi T, Utsunomiya A: Effects of first-line chemotherapy on natural killer cells in adult T-cell leukemia-lymphoma and peripheral T-cell lymphoma. Cancer Chemother Pharmacol. 2016 Jul;78(1):199-207. doi: 10.1007/s00280-016-3070-2. Epub 2016 Jun 11. (2016)
- Totani H, Kusumoto S, Tanaka Y, Suzuki N, Hagiwara S, Kinoshita S, Iio E, Ito A, Ri M, Ishida T, Komatsu H, Iida S: The value of serum Wisteria floribunda agglutinin-positive human Mac-2-binding protein as a predictive marker for hepatitis C virus-related complications after systemic chemotherapy. Int J Hematol. 2016 Sep;104(3):384-91. doi: 10.1007/s12185-016-2033-z. Epub 2016 Jun 2. (2016)
- Suzuki S, Ishida T, Yoshikawa K, Ueda R: Current status of immunotherapy. Jpn J Clin Oncol. 2016 Mar;46(3):191-203. doi: 10.1093/jjco/hyv201. Epub 2016 Jan 26. (2016)
- Akane K, Kojima S, Mak TW, Shiku H, Suzuki H: CD8+CD122+CD49dlow regulatory T cells maintain T-cell homeostasis by killing activated T cells via Fas/FasL-mediated cytotoxicity. Proc Natl Acad Sci U S A, 113:2460-2465 2016
- Ito S, Tanaka Y, Oshino R, Okado S, Hori M, Isobe KI: GADD34 suppresses lipopolysaccharide-induced sepsis and tissue injury through the regulation of macrophage activation. Cell Death Dis, 7:e2219 2016
- Liu L, Ito S, Nishio N, Sun Y, Tanaka Y, Isobe K: GADD34 Promotes Tumor Growth by Inducing Myeloid-derived Suppressor Cells. Anticancer Res, 36:4623-4628 2016
- Tanaka Y, Ito S, Isobe K: Vancomycin-sensitive bacteria trigger development of colitis-associated colon cancer by attracting neutrophils. Sci Rep, 6:23920. 2016
- Hirohashi Y, Torigoe T, Tsukahara T, Kanaseki T, Kochin V, Sato N: Immune responses to human cancer stem-like cells/cancer-initiating cells. Cancer Sci, 107:12-17 2016
- Ito N, Kamiguchi K, Nakanishi K, Sokolovskya A, Hirohashi Y, Tamura Y, Murai A, Yamamoto E, Kanaseki T, Tsukahara T, Kochin V, Chiba S, Shimohama S, Sato N, Torigoe T: A novel nuclear DnaJ protein, DNAJC8, can suppress the formation of spinocerebellar ataxia 3 polyglutamine aggregation in a J-domain independent manner. Biochem Biophys Res Commun, 474:626-633. 2016
- Kajiwara T, Tanaka T, Kukita K, Kutomi G, Saito K, Okuya K, Takaya A, Kochin V, Kanaseki T, Tsukahara T, Hirohashi Y, Torigoe T, Hirata K, Sato N, Tamura Y: Hypoxia augments MHC class I antigen presentation via facilitation of ERO1-α-mediated oxidative folding in murine tumor cells. Eur J Immunol, 2016.
- Sasaki T, Kanaseki T, Shionoya Y, Tokita S, Miyamoto S, Saka E, Kochin V, Takasawa A, Hirohashi Y, Tamura Y, Miyazaki A, Torigoe T, Hiratsuka H, Sato N: Microenvironmental stresses induce HLA-E/Qa-1 surface expression and thereby reduce CD8(+) T-cell recognition of stressed cells. Eur J Immunol, 46:929-940. 2016
- Tanaka T, Kutomi G, Kajiwara T, Kukita K, Kochin V, Kanaseki T, Tsukahara T, Hirohashi Y, Torigoe T, Okamoto Y, Hirata K, Sato N, Tamura Y: Cancer-associated oxidoreductase ERO1-α drives the production of VEGF via oxidative protein folding and regulating the mRNA level. Br J Cancer, 114:1227-1234. 2016
- Hiraki M, Suzuki Y, Alam M, Hinohara K, Hasegawa M, Jin C, Kharbanda S, Kufe D: MUC1-C Stabilizes MCL-1 in the Oxidative Stress Response of Triple-Negative Breast Cancer Cells to BCL-2 Inhibitors. Sci Rep. 2016 May 24;6:26643. (2016)
- Komura K, Jeong SH, Hinohara K, Qu F, Wang X, Hiraki M, Azuma H, Lee GS, Kantoff PW, Sweeney CJ: Resistance to docetaxel in prostate cancer is associated with androgen receptor activation and loss of KDM5D expression. Proc Natl Acad Sci U S A. 2016 May 31;113(22):6259-64. Epub 2016 May 16. (2016)
- Seo W, Taniuchi I: Transcriptional regulation of early T-cell development in the thymus. Eur J Immunol. 2016 Mar;46(3):531-8. doi: 10.1002/eji.201545821. Epub 2016 Feb 12. (2016)
- Du Q, Tsuboi N, Shi Y, Ito S, Sugiyama Y, Furuhashi K, Endo N, Kim H, Katsuno T, Akiyama S, Matsuo S, Isobe KI, Maruyama S. Transfusion of CD206+ M2 Macrophages Ameliorates Antibody-Mediated Glomerulonephritis in Mice. Am J Pathol. 2016 Dec;186(12):3176-3188. doi: 10.1016/j.ajpath.2016.08.012. Epub 2016 Nov 14. (2016)
- Kajiwara T, Tanaka T, Kukita K, Kutomi G, Saito K, Okuya K, Takaya A, Kochin V, Kanaseki T, Tsukahara T, Hirohashi Y, Torigoe T, Hirata K, Sato N, Tamura Y: Hypoxia augments MHC class I antigen presentation via facilitation of ERO1-α-mediated oxidative folding in murine tumor cells. Eur J Immu nol. 2016 Dec;46(12):2842-2851. doi: 10.1002/eji.201646525. Epub 2016 Oct 18. (2016)
- Ito N, Kamiguchi K, Nakanishi K, Sokolovskya A, Hirohashi Y, Tamura Y, Murai A, Yamamoto E, Kanaseki T, Tsukahara T, Kochin V, Chiba S, Shimohama S, Sato N, Torigoe T: A novel nuclear DnaJ protein, DNAJC8, can suppress the formation of spinocerebellar ataxia 3 polyglutamine aggregation in a J-domain independent manner. Biochem Biophys Res Commun. 2016 Jun 10;474(4):626-633. doi: 10.1016/j.bbrc.2016.03.152. Epub 2016 Apr 28. (2016)
- Tanaka T, Kutomi G, Kajiwara T, Kukita K, Kochin V, Kanaseki T, Tsukahara T, Hirohashi Y, Torigoe T, Okamoto Y, Hirata K, Sato N, Tamura Y: Cancer-associated oxidoreductase ERO1-α drives the production of VEGF via oxidative protein folding and regulating the mRNA level. Br J Cancer. 2016 May 24;114(11):1227-34. doi: 10.1038/bjc.2016.105. Epub 2016 Apr 21. (2016)
- Sasaki T, Kanaseki T, Shionoya Y, Tokita S, Miyamoto S, Saka E, Kochin V, Takasawa A, Hirohashi Y, Tamura Y, Miyazaki A, Torigoe T, Hiratsuka H, Sato N: Microenvironmental stresses induce HLA-E/Qa-1 surface expression and thereby reduce CD8(+) T-cell recognition of stressed cells. Eur J Immunol. 2016 Apr;46(4):929-40. doi: 10.1002/eji.201545835. Epub 2016 Feb 10. (2016)
- Kato S, Yokoyama S, Hayakawa Y, Li L, Iwakami Y, Sakurai H, Saiki I: p38 pathway as a key downstream signal of CTGF to regulate metastasis potential in NSCLC. Cancer Science. 2016 Oct;107(10):1416-1421. doi: 10.1111/cas.13009. Epub 2016 Sep 1 (2016)
- 2015年
- Nishikawa H. Overview: New Modality for Cancer Treatment. Oncology. Nov;8 9 Suppl 1:33-35 2015.
- Kurose K, Ohue Y, Wada H, Iida S, Takashi Ishida T, Kojima T Doi T, Suzuki S, Isobe M, Funakoshi T, Kakimi K, Nishikawa H, Udono H, Oka M, Ueda R, Nakayama E.; Phase Ia study of FoxP3+CD4 Treg depletion by infusion of a humanized anti-CCR4 antibody, KW-0761, in cancer patients. Clin Cancer Res. 21(19):4327-4336 2015.
- Adeegbe DO, Nishikawa H.; Regulatory T cells in cancer; can they be controlled? Immunotherapy. 7(8):843-846 2015.
- Miyara M, Chader D, Sage E, Sugiyama D, Nishikawa H, Bouvry D, Claër L, Hingorani R, Balderas R, Rohrer J, Warner N, Chapelier A, Valeyre D, Kannagi R, Sakaguchi S, Amoura Z, Gorochov G: Sialyl Lewis x (CD15s) identifies highly differentiated and most suppressive FOXP3high regulatory T cells in humans. Proc. Natl. Acad Sci USA. 112(23):7225-7230 2015.\t
- Abe A, Yamamoto Y, Iba S, Kanie T, Okamoto A, Tokuda M, Inaguma Y, Yanada M, Morishima S, Mizuta S, Akatsuka Y, Okamoto M, Kameyama T, Mayeda A, Emi N: ETV6-LPXN fusion transcript generated by t(11;12)(q12.1;p13) in a patient with relapsing acute myeloid leukemia with NUP98-HOXA9. Genes Chromosomes Cancer. 2016 Mar;55(3):242-50. doi: 10.1002/gcc.22327. Epub 2015 Nov 6.
- Abe A, Yamamoto Y, Iba S, Okamoto A, Tokuda M, Inaguma Y, Yanada M, Morishima S, Kanie T, Tsuzuki M, Akatsuka Y, Mizuta S, Okamoto M, Kameyama T, Mayeda A, Emi N: NUP214-RAC1 and RAC1-COL12A1 Fusion in Complex Variant Translocations Involving Chromosomes 6, 7 and 9 in an Acute Myeloid Leukemia Case with DEK-NUP214. Cytogenet Genome Res. 2015;146(4):279-84. doi: 10.1159/000441464. Epub 2015 Oct 31.
- Okamoto A, Yanada M, Miura H, Inaguma Y, Tokuda M, Morishima S, Kanie T, Yamamoto Y, Mizuta S, Akatsuka Y, Yoshikawa T, Mizoguchi Y, Nakamura S, Okamoto M, Emi N: Prognostic significance of Epstein-Barr virus DNA detection in pretreatment serum in diffuse large B-cell lymphoma. Cancer Sci. 2015 Nov;106(11):1576-81. doi: 10.1111/cas.12812. Epub 2015 Oct 7.
- Sato-Otsubo A, Nannya Y, Kashiwase K, Onizuka M, Azuma F, Akatsuka Y, Ogino Y, Satake M, Sanada M, Chiba S, Saji H, Inoko H, Kennedy GC, Yamamoto K, Morishima S, Morishima Y, Kodera Y, Sasazuki T, Ogawa S; Japan Marrow Donor Program: Genome-wide surveillance of mismatched alleles for graft-versus-host disease in stem cell transplantation. Blood. 2015 Dec 17;126(25):2752-63. doi: 10.1182/blood-2015-03-630707. Epub 2015 Oct 2.
- Inaguma Y, Akatsuka Y, Hosokawa K, Maruyama H, Okamoto A, Katagiri T, Shiraishi K, Murayama Y, Tsuzuki-Iba S, Mizutani Y, Nishii C, Yamamoto N, Demachi-Okamura A, Kuzushima K, Ogawa S, Emi N, Nakao S: Induction of HLA-B*40:02-restricted T cells possessing cytotoxic and suppressive functions against haematopoietic progenitor cells from a patient with severe aplastic anaemia. Br J Haematol. 2016 Jan;172(1):131-4. doi: 10.1111/bjh.13464. Epub 2015 Apr 30.
- Yanada M, Okamoto A, Inaguma Y, Tokuda M, Morishima S, Kanie T, Yamamoto Y, Mizuta S, Akatsuka Y, Okamoto M, Emi N: The fate of patients with acute myeloid leukemia not undergoing induction chemotherapy. Int J Hematol. 2015 Jul;102(1):35-40. doi: 10.1007/s12185-015-1786-0. Epub 2015 Mar 31.
- Zhang R, Liu TY, Senju S, Haruta M, Hirosawa N, Suzuki M, Tatsumi M, Ueda N, Maki H, Nakatsuka R, Matsuoka Y, Sasaki Y, Tsuzuki S, Nakanishi H, Araki R, Abe M, Akatsuka Y, Sakamoto Y, Sonoda Y, Nishimura Y, Kuzushima K, Uemura Y: Generation of mouse pluripotent stem cell-derived proliferating myeloid cells as an unlimited source of functional antigen-presenting cells. Cancer Immunol Res. 2015 Jun;3(6):668-77. doi: 10.1158/2326-6066.CIR-14-0117. Epub 2015 Feb 11.
- Okamoto A, Yanada M, Inaguma Y, Tokuda M, Morishima S, Kanie T, Yamamoto Y, Mizuta S, Akatsuka Y, Yoshikawa T, Mizoguchi Y, Nakamura S, Okamoto M, Emi N: The prognostic significance of EBV DNA load and EBER status in diagnostic specimens from diffuse large B-cell lymphoma patients. Hematol Oncol. 2017 Mar;35(1):87-93. doi: 10.1002/hon.2245. Epub 2015 Jul 14.
- Totani H, Ri M, Kato C, Nakashima T, Suzuki N, Hagiwara S, Kanamori T, Murakami S, Masuda A, Kinoshita S, Yoshida T, Narita T, Ito A, Kusumoto S, Ishida T, Komatsu H, Iida S: Phase I study of once weekly treatment with bortezomib in combination with lenalidomide and dexamethasone for relapsed or refractory multiple myeloma. Int J Hematol. 2016 Mar;103(3):316-21. doi: 10.1007/s12185-015-1925-7. Epub 2015 Dec 29. (2015)
- Okuyama T, Sugano K, Iida S, Ishida T, Kusumoto S, Akechi T: Screening Performance for Frailty Among Older Patients With Cancer: A Cross-Sectional Observational Study of Two Approaches. J Natl Compr Canc Netw. 2015 Dec;13(12):1525-31. doi: 10.6004/jnccn.2015.0180. (2015)
- Suzuki T, Kusumoto S, Yamashita T, Masuda A, Kinoshita S, Yoshida T, Takami-Mori F, Takino H, Ito A, Ri M, Ishida T, Komatsu H, Ueda M, Ando Y, Inagaki H, Iida S: Labial salivary gland biopsy for diagnosing immunoglobulin light chain amyloidosis: a retrospective analysis. Ann Hematol. 2016 Jan;95(2):279-85. doi: 10.1007/s00277-015-2549-y. Epub 2015 Nov 10. (2015)
- Masaki A, Ishida T, Maeda Y, Suzuki S, Ito A, Takino H, Totani H, Yoshida T, Kinoshita S, Ogura H, Narita T, Ri M, Kusumoto S, Inagaki A, Komatsu H, Niimi A, Ueda R, Utsunomiya A, Inagaki H, Iida S: [Prognostic significance of tryptophan catabolism in adult T-cell leukemia/lymphoma]. Rinsho Ketsueki. 2015 Nov;56(11):2295-304. doi: 10.11406/rinketsu.56.2295. (2015)
- Ishitsuka K, Utsunomiya A, Katsuya H, Takeuchi S, Takatsuka Y, Hidaka M, Sakai T, Yoshimitsu M, Ishida T, Tamura K: A phase II study of bortezomib in patients with relapsed or refractory aggressive adult T-cell leukemia/lymphoma. Cancer Sci. 2015 Sep;106(9):1219-23. doi: 10.1111/cas.12735. (2015)
- Takada K, Van Laethem F, Xing Y, Akane K, Suzuki H, Murata S, Tanaka K, Jameson SC, Singer A, Takahama Y: TCR affinity for thymoproteasome-dependent positively selecting peptides conditions antigen responsiveness in CD8(+) T cells. Nat Immunol, 2015;16:1069-1076.
- Ito S, Tanaka Y, Oshino R, Aiba K, Thanasegaran S, Nishio N, Isobe K: GADD34 inhibits activation-induced apoptosis of macrophages through enhancement of autophagy. Sci Rep, 2015;5:8327.
- Tanaka Y, Ito S, Oshino R, Chen N, Nishio N, Isobe K: Effects of growth arrest and DNA damage-inducible protein 34 (GADD34) on inflammation-induced colon cancer in mice. Br J Cancer, 2015;113:669-679.
- Sun Y, Ito S, Nishio N, Tanaka Y, Chen N, Liu L, Isobe K: Enhancement of the acrolein-induced production of reactive oxygen species and lung injury by GADD34. Oxid Med Cell Longev, 2015;2015:170309.
- Liu L, Ito S, Nishio N, Sun Y, Chen N, Tanaka Y, Isobe K: GADD34 Facilitates Cell Death Resulting from Proteasome Inhibition. Anticancer Res, 2015;35:5317-5324.
- Okabe M, Ito S, Nishio N, Tanaka Y, Isobe K: Thymic Epithelial Cells Induced from Pluripotent Stem Cells by a Three-Dimensional Spheroid Culture System Regenerates Functional T Cells in Nude Mice. Cell Reprogram, 2015;17:368-375.
- Thanasegaran S, Ito S, Nishio N, Uddin MN, Sun Y, Isobe K: Recruitment of Gr1(+)CD11b (+)F4/80 (+) population in the bone marrow and spleen by irradiation-induced pulmonary damage. Inflammation, 2015;38:465-475.
- Chen N, Nishio N, Ito S, Tanaka Y, Sun Y, Isobe K: Growth arrest and DNA damage-inducible protein (GADD34) enhanced liver inflammation and tumorigenesis in a diethylnitrosamine (DEN)-treated murine model. Cancer Immunol Immunother, 2015;64:777-789.
- Himeno T, Kamiya H, Naruse K, Cheng Z, Ito S, Shibata T, Kondo M, Kato J, Okawa T, Fujiya A, Suzuki H, Kito T, Hamada Y, Oiso Y, Isobe K, Nakamura J: Angioblast Derived from ES Cells Construct Blood Vessels and Ameliorate Diabetic Polyneuropathy in Mice. J Diabetes Res, 2015;2015:257230.
- Thanasegaran S, Ito S, Nishio N, Uddin MN, Sun Y, Isobe KI. Erratum to: Recruitment of Gr1(+)CD11b(+)F4/80(+)Population in the Bone Marrow and Spleen by Irradiation-Induced Pulmonary Damage. Inflammation. 2016 Feb;39(1):499-500. doi: 10.1007/s10753-015-0216-z. Erratum for: Inflammation. 2015 Apr;38(2):465-75.
- Hirohashi Y, Torigoe T, Tsukahara T, Kanaseki T, Kochin V, Sato N: Immune responses to human cancer stem-like cells/cancer-initiating cells. Cancer Sci. 2016 Jan;107(1):12-7. doi: 10.1111/cas.12830. Epub 2015 Nov 12. (2015)
- Toge M, Yokoyama S, Kato S, Sakurai H, Senda K, Doki Y, Hayakawa Y, Yoshimura N, Saiki I: Critical contribution of MCL-1 in EMT-associated chemo-resistance in A549 non-small cell lung cancer, Int J Oncol., 46;1844-1848 (2015)
- 2014年
- Maeda Y, Nishikawa H, Sugiyama D, Ha D, Hamaguchi M, Saito T, Nishioka M, Wing JB, Adeegbe D, Katayama I and Sakaguchi S; Detection of self-reactive CD8+ T cells with an anergic phenotype in healthy individuals. Science. 346(6216):1536-1540 2014
- Matsumoto M, Baba A, Yokota T, Nishikawa H, Ohkawa Y, Kayama H, Kallies A, Nutt SL, Sakaguchi S, Takeda K, Kurosaki T and Baba Y.; Interleukin-10-Producing Plasmablasts Exert Regulatory Function in Autoimmune Inflammation. Immunity. 41(6):1040-1051 2014
- Nishikawa H, Sakaguchi S; Regulatory T cells in cancer immunotherapy. Curr Opin Immunol. Jan 9;27:1-7 2014.
- Ito Y, Hashimoto M, Hirota K, Ohkura N, Morikawa H, Nishikawa H, Tanaka A, Furu M, Ito H, Fujii T, Nomura T, Yamazaki S, Morita A, Vignali DAA, Kappler JW, Matsuda S, Mimori T, Sakaguchi N and Shimon S.; Detection of T-cell responses to a ubiquitous cellular protein in autoimmune disease. Science. 346(6207):363-368 2014
- Saito T, Wada H, Yamasaki M, Miyata H, Nishikawa H, Sato E, Kageyama S, Shiku H, Mori M, Doki Y.; High expression of MAGE-A4 and MHC class I antigens in tumor cells and induction of MAGE-A4 immune responses are prognostic markers of CHP-MAGE-A4 cancer vaccine. Vaccine. 32(45):5901-5907 2014
- Wada H, Isobe M, Kakimi K, Mizote Y, Eikawa S, Sato E, Takigawa N, Kiura K, Tsuji K, Iwatsuki K, Yamasaki M, Miyata H, Matsushita H, Udono H, Seto Y, Yamada K, Nishikawa H, Pan L, Venhaus R, Oka M, Doki Y, Nakayama E.; Vaccination With NY-ESO-1 Overlapping Peptides Mixed With Picibanil OK-432 and Montanide ISA-51 in Patients With Cancers Expressing the NY-ESO-1 Antigen. J Immunother. Feb-Mar;37(2):84-92 2014.
- Morishima A, Hirano T, Nishikawa H, Nakai K, Sakaguchi S, Kumanogoh A.; Comprehensive exploration of autoantibody in Behçet's disease: A novel autoantibody to claudin-1, an essential protein for tight junctions, is identified. Joint Bone Spine. 2014 Apr 29. pii: S1297-319X(14)00083-9.
- Okamoto A, Abe A, Okamoto M, Kobayashi T, Inaguma Y, Tokuda M, Yanada M, Morishima S, Kanie T, Yamamoto Y, Tsuzuki M, Mizuta S, Akatsuka Y, Yatsuya H, Yoshikawa T, Emi N: A varicella outbreak in B-cell lymphoma patients receiving rituximab-containing chemotherapy. J Infect Chemother. 2014 Dec;20(12):774-7. doi: 10.1016/j.jiac.2014.08.006. Epub 2014 Aug 30.
- Nishio N, Ito S, Isobe K: Loss of GADD34 induces early age-dependent deviation to the myeloid lineage. Immunol Cell Biol, 2014;92:170-180.
- Liu L, Nishio N, Ito S, Tanaka Y, Isobe K: Negative regulation of GADD34 on myofibroblasts during cutaneous wound healing. Biomed Res Int, 2014;2014:137049.
- Isobe K, Cheng Z, Nishio N, Suganya T, Tanaka Y, Ito S: iPSCs, aging and age-related diseases. N Biotechnol, 2014;31:411-421.
- Ito T, Yamada S, Tanaka C, Ito S, Murai T, Kobayashi D, Fujii T, Nakayama G, Sugimoto H, Koike M, Nomoto S, Fujiwara M, Kodera Y: Overexpression of L1CAM is associated with tumor progression and prognosis via ERK signaling in gastric cancer. Ann Surg Oncol, 2014;21:560-568.
- Kochin V, Shimi T, Torvaldson E, Adam SA, Goldman A, Pack CG, Melo-Cardenas J, Imanishi SY, Goldman RD, Eriksson JE: Interphase phosphorylation of lamin A. J Cell Sci, 2014;127:2683-2696.
- de Thonel A, Hazoumé A, Kochin V, Isoniemi K, Jego G, Fourmaux E, Hammann A, Mjahed H, Filhol O, Micheau O, Rocchi P, Mezger V, Eriksson JE, Rangnekar VM, Garrido C: Regulation of the proapoptotic functions of prostate apoptosis response-4 (Par-4) by casein kinase 2 in prostate cancer cells. Cell Death Dis, 2014;5:e1016.
- Morita R, Nishizawa S, Torigoe T, Takahashi A, Tamura Y, Tsukahara T, Kanaseki T, Sokolovskaya A, Kochin V, Kondo T, Hashino S, Asaka M, Hara I, Hirohashi Y, Sato N: Heat shock protein DNAJB8 is a novel target for immunotherapy of colon cancer-initiating cells. Cancer Sci, 2014;105:389-395.
- Tsukahara T, Emori M, Murata K, Hirano T, Muroi N, Kyono M, Toji S, Watanabe K, Torigoe T, Kochin V, Asanuma H, Matsumiya H, Yamashita K, Himi T, Ichimiya S, Wada T, Yamashita T, Hasegawa T, Sato N: Specific targeting of a naturally presented osteosarcoma antigen, papillomavirus binding factor peptide, using an artificial monoclonal antibody. J Biol Chem, 2014;289:22035-22047.
- Kato S, Hayakawa Y, Sakurai H, Saiki I, Yokoyama S: Mesenchymal-transitioned cancer cells instigate the invasion of epithelial cancer cells through secretion of WNT3 and WNT5B., Cancer Science, 105; 281-289 (2014)
- Kaneto N, Yokoyama S, Hayakawa Y, Kato S, Sakurai H, Saiki I: RAC1 inhibition as a therapeutic target for gefitinib-resistant non-small cell lung cancer. Cancer Science, 105; 788-794 (2014)
- Kohsaka S, Hinohara K, Wang L, Nishimura T, Urushido M, Yachi K, Tsuda M, Tanino M, Kimura T, Nishihara H, Gotoh N, Tanaka S: Epiregulin enhances tumorigenicity by activating the ERK/MAPK pathway in glioblastoma. Neuro Oncol. 2014 Jul;16(7):960-70. (2014)
- Kobayashi M, Shelley WC, Seo W, Vemula S, Lin Y, Liu Y, Kapur R, Taniuchi I, Yoshimoto M: Functional B-1 progenitor cells are present in the hematopoietic stem cell-deficient embryo and depend on Cbfβ for their development. Proc Natl Acad Sci U S A. 2014 Aug 19;111(33):12151-6. doi: 10.1073/pnas.1407370111. (2014)
- 2013年
- Sugiyama D, Nishikawa H, Maeda Y, Nishioka M, Tanemura A, Katayama I, Ezoe S, Kanakura Y, Sato E, Fukumori Y, Karbach J, Jäger E, Sakaguchi S: Anti-CCR4 mAb selectively depletes effector-type FoxP3+CD4+ regulatory T cells, evoking antitumor immune responses in humans. Proc Natl Acad Sci U S A, 2013;110:17945-17950.
- Atarashi K, Tanoue T, Suda W, Oshima K, Nagano Y, Nishikawa H, Fukuda S, Saito T, Narushima S, Hase K, Kim S, Fritz JV, Wilmes P, Ueha S, Matsushima K, Ohno H, Olle B, Sakaguchi S Taniguchi T, Morita H, Hattori M and Honda K: Treg induction by a rationally selected Clostridia cocktail from the human microbiota. Nature. 500 (7461):232-236 2013
- Hirayama M*, Nishikawa H*, Nagata Y, Tsuji T, Kato T, Kageyama S, Ueda S, Sugiyama D, Hori S, Sakaguchi S, Ritter G, Old LJ, Gnjatic S, and Shiku H: Overcoming regulatory T-cell suppression by a lyophilized preparation of Streptococcus pyogenes. Eur J Immunol. 43 (4):989-1000 2013
- Adeegbe DO, Nishikawa H: Natural and induced T regulatory cells in cancer. Front Immunol, 2013;4:190.
- Noguchi T, Ritter G, Nishikawa H: Antibody-based therapy in colorectal cancer. Immunotherapy. 5 (5):533-545 2013
- Muraoka D, Nishikawa H, Noguchi T, Wang L, Harada N, Sato E, Luescher I, Nakayama E, Kato T, Shiku H: Establishment of animal models to analyze the kinetics and distribution of human tumor antigen-specific CD8+ T cells. Vaccine. 31(17):2110-2118 2013
- Gupta A, Nuber N, Esslinger C, Wittenbrink M, Treder M, Landshammer A, Noguchi T, Kelly M, Gnjatic S, Ritter E, von Boehmer L, Nishikawa H, Shiku H, Old LJ, Ritter G, Knuth A, and van den Broek M: A novel human-derived monoclonal antibody against NY-ESO-1 improves the efficacy of chemotherapy. Cancer Immun. Jan;13:E3 2013.
- Fujiwara S, Wada H, Kawada J, Kawabata R, Takahashi T, Fujita J, Hirao T, Shibata K, Makari Y, Iijima S, Nishikawa H, Jungbluth A, Nakamura Y, Kurokawa Y, Yamasaki M, Miyata H, Nakajima K, Takiguchi S, Nakayama E, Mori M, and Doki Y: NY-ESO-1 antibody as a novel tumor marker of gastric cancer. Br J Cancer 108 (5):1119-1125 2013.
- Liu B, Ohishi K, Orito Y, Nakamori Y, Nishikawa H, Ino K, Suzuki K, Matsumoto T, Masuya M, Hamada H, Mineno J, Ono R, Nosaka T, Shiku H, Katayama N: Manipulation of human early T lymphopoiesis by coculture on human bone marrow stromal cells: Potential utility for adoptive immunotherapy. Exp Hematol. 41(4):367-376 2013.
- Eikawa S, Kakimi K, Isobe M, Kuzushima K, Luescher I, Ohue Y, Ikeuchi K, Uenaka A, Nishikawa H, Udono H, Oka M, Nakayama E: Induction of CD8 T-cell responses restricted to multiple HLA class I alleles in a cancer patient by immunization with a 20-mer NY-ESO-1f (NY-ESO-1 91-110) peptide. Int J Cancer. 2013 132(2):345-354.
- Okuno Y, Murakoshi A, Negita M, Akane K, Kojima S, Suzuki H: CD8+ CD122+ regulatory T cells contain clonally expanded cells with identical CDR3 sequences of the T-cell receptor β-chain. Immunology, 2013;139:309-317.
- Shozib HB, Suzuki H, Iino S, Nakayama S: Acceleration of ileal pacemaker activity in mice lacking interleukin 10. Inflamm Bowel Dis, 2013;19:1577-1585.
- Ito S, Tanaka Y, Nishio N, Thanasegaran S, Isobe K: Establishment of self-renewable GM-CSF-dependent immature macrophages in vitro from murine bone marrow. PLoS One, 2013;8:e76943.
- Cheng Z, Ito S, Nishio N, Thanasegaran S, Fang H, Isobe K: Characteristics of cardiac aging in C57BL/6 mice. Exp Gerontol, 2013;48:341-348.
- Thanasegaran S, Cheng Z, Ito S, Nishio N, Isobe K: No immunogenicity of IPS cells in syngeneic host studied by in vivo injection and 3D scaffold experiments. Biomed Res Int, 2013;2013:378207.
- Himeno T, Kamiya H, Naruse K, Cheng Z, Ito S, Kondo M, Okawa T, Fujiya A, Kato J, Suzuki H, Kito T, Hamada Y, Oiso Y, Isobe K, Nakamura J: Mesenchymal stem cell-like cells derived from mouse induced pluripotent stem cells ameliorate diabetic polyneuropathy in mice. Biomed Res Int, 2013;2013:259187.
- Kito T, Shibata R, Ishii M, Suzuki H, Himeno T, Kataoka Y, Yamamura Y, Yamamoto T, Nishio N, Ito S, Numaguchi Y, Tanigawa T, Yamashita JK, Ouchi N, Honda H, Isobe K, Murohara T: iPS cell sheets created by a novel magnetite tissue engineering method for reparative angiogenesis. Sci Rep, 2013;3:1418.
- Okawa T, Kamiya H, Himeno T, Kato J, Seino Y, Fujiya A, Kondo M, Tsunekawa S, Naruse K, Hamada Y, Ozaki N, Cheng Z, Kito T, Suzuki H, Ito S, Oiso Y, Nakamura J, Isobe K: Transplantation of neural crest-like cells derived from induced pluripotent stem cells improves diabetic polyneuropathy in mice. Cell Transplant, 2013;22:1767-1783.
- Emori M, Tsukahara T, Murase M, Kano M, Murata K, Takahashi A, Kubo T, Asanuma H, Yasuda K, Kochin V, Kaya M, Nagoya S, Nishio J, Iwasaki H, Sonoda T, Hasegawa T, Torigoe T, Wada T, Yamashita T, Sato N: High expression of CD109 antigen regulates the phenotype of cancer stem-like cells/cancer-initiating cells in the novel epithelioid sarcoma cell line ESX and is related to poor prognosis of soft tissue sarcoma. PLoS One, 2013;8:e84187.
- Saijo H, Hirohashi Y, Torigoe T, Kochin V, Takahashi H, Sato N: Cytotoxic T lymphocytes: the future of cancer stem cell eradication? Immunotherapy, 2013;5:549-551.
- Takahashi A, Hirohashi Y, Torigoe T, Tamura Y, Tsukahara T, Kanaseki T, Kochin V, Saijo H, Kubo T, Nakatsugawa M, Asanuma H, Hasegawa T, Kondo T, Sato N: Ectopically expressed variant form of sperm mitochondria-associated cysteine-rich protein augments tumorigenicity of the stem cell population of lung adenocarcinoma cells. PLoS One, 2013;8:e69095.
- Yasuda K, Torigoe T, Morita R, Kuroda T, Takahashi A, Matsuzaki J, Kochin V, Asanuma H, Hasegawa T, Saito T, Hirohashi Y, Sato N: Ovarian cancer stem cells are enriched in side population and aldehyde dehydrogenase bright overlapping population. PLoS One, 2013;8:e68187.
- Kin R, Kato S, Kaneto N, Sakurai H, Hayakawa Y, Li F, Tanaka K, Saiki I, Yokoyama S: Procyanidin C1 from Cinnamomi Cortex inhibits TGF-β-induced epithelial-to-mesenchymal transition in the A549 lung cancer cell line, Int J Oncol., 43; 1901-1906 (2013)
- Pinós T, Fuku N, Cámara Y, Arai Y, Abe Y, Rodríguez-Romo G, Garatachea N, Santos-Lozano A, Miro-Casas E, Ruiz-Meana M, Otaegui I, Murakami H, Miyachi M, Garcia-Dorado D, Hinohara K, Andreu AL, Kimura A, Hirose N, Lucia A: The rs1333049 polymorphism on locus 9p21.3 and extreme longevity in Spanish and Japanese cohorts. Age (Dordr). 2014 Apr;36(2):933-43. Epub 2013 Oct 28. (2013)
- Tomokuni A, Eguchi H, Hoshino H, Dewi DL, Nishikawa S, Kano Y, Miyoshi N, Tojo A, Kobayashi S, Gotoh N, Hinohara K, Fusaki N, Saito T, Suemizu H, Wada H, Kobayashi S, Marubashi S, Tanemura M, Doki Y, Mori M, Ishii H, Nagano H: Effect of in vivo administration of reprogramming factors in the mouse liver. Oncol Lett. 2013 Aug;6(2):323-328. Epub 2013 Jun 20. (2013)
- Kano Y, Tsuchiya K, Zheng X, Horita N, Fukushima K, Hibiya S, Yamauchi Y, Nishimura T, Hinohara K, Gotoh N, Suzuki S, Okamoto R, Nakamura T, Watanabe M: The acquisition of malignant potential in colon cancer is regulated by the stabilization of Atonal homolog 1 protein. Biochem Biophys Res Commun. 2013 Mar 1;432(1):175-81. Epub 2013 Jan 16. (2013)
- Kano Y, Tsuchiya K, Zheng X, Horita N, Fukushima K, Hibiya S, Yamauchi Y, Nishimura T, Hinohara K, Gotoh N, Suzuki S, Okamoto R, Nakamura T, Watanabe M: The acquisition of malignant potential in colon cancer is regulated by the stabilization of Atonal homolog 1 protein. Biochem Biophys Res Commun. 2013 Mar 1;432(1):175-81. doi: 10.1016/j.bbrc.2013.01.034. Epub 2013 Jan 16. (2013)
- Tanaka H, Naito T, Muroi S, Seo W, Chihara R, Miyamoto C, Kominami R, Taniuchi I: Epigenetic Thpok silencing limits the time window to choose CD4(+) helper-lineage fate in the thymus. EMBO J. 2013 Apr 17;32(8):1183-94. doi: 10.1038/emboj.2013.47. Epub 2013 Mar 12. (2013)
- 2012年
- Nishikawa H, Maeda Y, Ishida T, Gnjatic S, Sato E, Mori F, Sugiyama D, Ito A, Fukumori Y, Utsunomiya A, Inagaki H, Old LJ, Ueda R and Sakaguchi S: Cancer/testis antigens are novel targets of immunotherapy for adult T-cell leukemia/lymphoma. Blood. 119:3097-3104 2012
- Noguchi T, Kato T, Wang L, Maeda Y, Ikeda H, Sato E, Knuth A, Gnjatic S, Ritter G, Sakaguchi S, Old LJ, Shiku H, and Nishikawa H: Intracellular tumor-associated antigens represent effective targets for passive immunotherapy. Cancer Res. 72:1672-1682 2012
- Nakamori Y, Liu B, Ohishi K, Suzuki K, Ino K, Matsumoto T, Masuya M, Nishikawa H, Shiku H, Hamada H, Katayama N: Human bone marrow stromal cells simultaneously support B and T/NK lineage development from human haematopoietic progenitors: a principal role for flt3 ligand in lymphopoiesis. Br J Haematol. 157(6):674-686 2012
- Fujiwara S, Wada H, Miyata H, Kawada J, Kawabata R, Nishikawa H, Gnjatic S, Sedrak C, Sato E, Nakamura Y, Sakakibara M, Kanto T, Shimosegawa E, Hatazawa J, Takahashi T, Kurokawa Y, Yamasaki M, Nakajima K, Takiguchi S, Nakayama E, Mori M, Doki Y: Clinical Trial of the Intratumoral Administration of Labeled DC Combined With Systemic Chemotherapy for Esophageal Cancer. J. Immunother. 35(6):513-521 2012.
- Suzuki S, Masaki A, Ishida T, Ito A, Mori F, Sato F, Narita T, Ri M, Kusumoto S, Komatsu H, Fukumori Y, Nishikawa H, Tanaka Y, Niimi A, Inagaki H, Iida S, Ueda R: Tax is a potential molecular target for immunotherapy of adult T-cell leukemia/lymphoma. Cancer Sci. 103(10):1764-1773 2012.
- Iwami K, Shimato S, Ohno M, Okada H, Nakahara N, Sato Y, Yoshida J, Suzuki S, Nishikawa H, Shiku H, Natsume A, Wakabayashi T: Peptide-pulsed dendritic cell vaccination targeting interleukin-13 receptor α2 chain in recurrent malignant glioma patients with HLA-A*24/A*02 allele. Cytotherapy. 14 (6):733-742 2012.
- Kawada J, Wada H, Isobe M, Gnjatic S, Nishikawa H, Jungbluth AA, Okazaki N, Uenaka A, Nakamura Y, Fujiwara S, Mizuno N, Saika T, Ritter E, Yamasaki M, Miyata M, Ritter G, Murphy R, Hoffman EW, Pan L, Old LJ, Doki Y, Nakayama E: Heteroclitic serological response in esophageal and prostate cancer patients after NY-ESO-1 protein vaccination. Int J Cancer. 130:584-592 2012.
- Ito S, Nishio N, Isobe K: Analysis of b-amyloid peptide-binding proteins in microglial cells. The Open geriatric medicine journal, 2012; 5: 1-6.
- Isobe K, Cheng Z, Ito S, Nishio N: Aging in the mouse and perspectives of rejuvenation through induced pluripotent stem cells (iPSCs). Results Probl Cell Differ, 2012;55:413-427.
- Suzuki H, Shibata R, Kito T, Yamamoto T, Ishii M, Nishio N, Ito S, Isobe K, Murohara T: Comparative angiogenic activities of induced pluripotent stem cells derived from young and old mice. PLoS One, 2012;7:e39562.
- Uddin MN, Nishio N, Ito S, Suzuki H, Isobe K: Autophagic activity in thymus and liver during aging. Age (Dordr), 2012;34:75-85.
- Hirohashi Y, Torigoe T, Inoda S, Morita R, Kochin V, Sato N: Cytotoxic T lymphocytes: Sniping cancer stem cells. Oncoimmunology, 2012;1:123-125.
- Mori T, Nishizawa S, Hirohashi Y, Torigoe T, Tamura Y, Takahashi A, Kochin V, Fujii R, Kondo T, Greene MI, Hara I, Sato N: Efficiency of G2/M-related tumor-associated antigen-targeting cancer immunotherapy depends on antigen expression in the cancer stem-like population. Exp Mol Pathol, 2012;92:27-32.
- Koizumi K, Kato S, Sakurai H, Hashimoto I, Yasumoto K, Saiki I: Therapeutic target of CXCR4 and its downstream in peritoneal carcinomatosis of gastric cancer, Front Biosci (Schol Ed.), 4; 269-276 (2012)
- Hinohara K, Kobayashi S, Kanauchi H, Shimizu S, Nishioka K, Tsuji E, Tada K, Umezawa K, Mori M, Ogawa T, Inoue J, Tojo A, Gotoh N: ErbB receptor tyrosine kinase/NF-κB signaling controls mammosphere formation in human breast cancer. Proc Natl Acad Sci U S A. 2012 Apr 24;109(17):6584-9. Epub 2012 Apr 5. (2012)
- Seo W, Ikawa T, Kawamoto H, Taniuchi I: Runx1-Cbfβ facilitates early B lymphocyte development by regulating expression of Ebf1. J Exp Med. 2012 Jul 2;209(7):1255-62. doi: 10.1084/jem.20112745. Epub 2012 Jun 4. (2012)
- Seo W, Tanaka H, Miyamoto C, Levanon D, Groner Y, Taniuchi I: Roles of VWRPY motif-mediated gene repression by Runx proteins during T-cell development. Immunol Cell Biol. 2012 Sep;90(8):827-30. doi: 10.1038/icb.2012.6. Epub 2012 Feb 28. (2012)
- 2011年
- Toda M, Wang L, Ogura S, Torii M, Kurachi M, Kakimi K, Nishikawa H, Matsushima K, Shiku H, Kuribayashi K, Kato T: UV irradiation of immunized mice induces type 1 regulatory T cells that suppress tumor antigen specific CTL responses. Int J Cancer. 129:1126-1136 2011.
- Endharti AT, Okuno Y, Shi Z, Misawa N, Toyokuni S, Ito M, Isobe K, Suzuki H: CD8+CD122+ regulatory T cells (Tregs) and CD4+ Tregs cooperatively prevent and cure CD4+ cell-induced colitis. J Immunol, 2011;186:41-52.
- Hayakawa A, Suzuki H, Kamei Y, Tanuma S, Magae J: Cladribine enhances apoptotic cell death in lung carcinoma cells over-expressing DNase γ. Biol Pharm Bull, 2011;34:1001-1004.
- Cheng Z, Ito S, Nishio N, Xiao H, Zhang R, Suzuki H, Okawa Y, Murohara T, Isobe K: Establishment of induced pluripotent stem cells from aged mice using bone marrow-derived myeloid cells. J Mol Cell Biol, 2011;3:91-98.
- Zhang R, Ito S, Nishio N, Cheng Z, Suzuki H, Isobe KI: Dextran sulphate sodium increases splenic Gr1(+)CD11b(+) cells which accelerate recovery from colitis following intravenous transplantation. Clin Exp Immunol, 2011;164:417-427.
- Zhang R, Ito S, Nishio N, Cheng Z, Suzuki H, Isobe K: Up-regulation of Gr1+CD11b+ population in spleen of dextran sulfate sodium administered mice works to repair colitis. Inflamm Allergy Drug Targets, 2011;10:39-46.
- Uddin MN, Ito S, Nishio N, Suganya T, Isobe K: Gadd34 induces autophagy through the suppression of the mTOR pathway during starvation. Biochem Biophys Res Commun, 2011;407:692-698.
- Inami Y, Yoshikai T, Ito S, Nishio N, Suzuki H, Sakurai H, Isobe K: Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol, 2011;89:314-321.
- 2010年
- Muraoka D, Kato T, Wang L, Maeda Y, Noguchi T, Harada N, Takeda K, Yagita H, Guillaume P, Luescher I, Old LJ, Shiku H and Nishikawa H: Peptide vaccine induces enhanced tumor growth associated with apoptosis induction in CD8+ T cells. J Immunol. 185:3768-3776 2010
- Mitsui J, Nishikawa H, Muraoka D, Wang L, Noguchi T, Sato E, Kondo S, Allison JP, Sakaguchi S, Old LJ, Kato T and Shiku H: Two distinct mechanisms of augmented anti-tumor activity by modulation of immuno-stimulatory/ inhibitory signals. Clin Cancer Res. 6:2781-2791 2010
- Nishikawa H and Sakaguchi S: Regulatory T cells in Tumor Immunity. Int J Cancer. 127:759-767 2010
- Gnjatic S, Cao Y, Reichelt U. Yekebas EF, Nölker C, Marx A, Erbersdobler A, Nishikawa H, Hildebrandt Y, Bartels K, Horn C, Stahl T, Gout I, Filonenko V, Ling K-L, Cerundolo V, Luetkens T, Ritter G, Friedrichs K, Leuwer R, Hegewisch-Becker S, Jakob R. Izbicki JR, Bokemeyer C, Old LJ, Atanackovic D: NY-CO-58/KIF2C is overexpressed in a variety of solid tumors and induces frequent T cell responses in patients with colorectal cancer. Int J Cancer. 127:381-393 2010.
- Burckhart T, Thiel M, Nishikawa H, Wüest T, Müller D, Zippelius A, Ritter G, Old L, Shiku H, Renner C: Tumor-specific crosslinking of GITR as costimulation for immunotherapy. J Immunother. 33:925-934 2010.
- Wakita D, Sumida K, Iwakura Y, Nishikawa H, Ohkuri T, Chamoto K, Kitamura H, Nishimura T: Tumor-infiltrating IL-17-producing γδ cells support the progression of tumor by promoting angiogenesis. Eur J Immunol. 40:1927-1937 2010.
- Torii M, Wang L, Ma N, Saito K, Hori T, Sato-Ueshima M, Koyama Y, Nishikawa H, Katayama N, Mizoguchi A, Shiku H, Yodoi J, Kuribayashi K, Kato T.; Thioredoxin suppresses airway inflammation independently of systemic Th1/Th2 immune modulation. Eur J Immunol. 40:787-796 2010.
- Wadle A, Mischo A, Strahl S, Nishikawa H, Held G, Neumann F, Wullner B, Fischer E, Kleber S, Karbach J, Jager E, Shiku H, Odunsi K, Shrikant PA, Knuth A, Cerundolo V, Renner C: NY-ESO-1 ptotein glycosylated by yeast induces enhanced immune responses. Yeast. 11:919-931 2010.
- Tanaka C, Ito S, Nishio S, Kodera Y, Sakurai H, Suzuki H, Nakao A, Isobe K: GADD34 suppresses wound healing by upregulating expression of myosin IIA Transgenic research 2010 Aug;19(4):637-45.
- Nishio N, Ito S, Suzuki H, Okawa Y and Isobe K: Effect of Aging on Auto-Antibodies to Wounded Tissues. The Open Geriatric Medicine Journal. 2010; 3;17-24.
- Suzuki H, Shibata R, Kito T, Ishii M, Li P, Yoshikai T, Nishio N, Ito S, Numaguchi Y, Yamashita JK, Murohara T, Isobe K: Therapeutic angiogenesis by transplantation of induced pluripotent stem cell-derived Flk-1 positive cells.BMC Cell Biol. 2010 Sep 22;11:72.
- de Thonel A, Ferraris SE, Pallari HM, Imanishi SY, Kochin V, Hosokawa T, Hisanaga S, Sahlgren C, Eriksson JE: Protein kinase Czeta regulates Cdk5/p25 signaling during myogenesis. Mol Biol Cell, 2010;21:1423-1434.
- Kato S, Koizumi K, Yamada M, Inujima A, Takeno N, Nakanishi T, Sakurai H, Nakagawa S, Saiki I: A phagocytic inducer from herbal constituent, pentagalloylglucose enhances lipoplex-mediated gene transfection in dendritic cells, Biol Pharm Bull, 33; 1878-1885 (2010)
- Hinohara K, Gotoh N: Inflammatory signaling pathways in self-renewing breast cancer stem cells. Curr Opin Pharmacol. 2010 Dec;10(6):650-4. (2010)
- Chen Z, Nakajima T, Tanabe N, Hinohara K, Sakao S, Kasahara Y, Tatsumi K, Inoue Y, Kimura A: Susceptibility to chronic thromboembolic pulmonary hypertension may be conferred by miR-759 via its targeted interaction with polymorphic fibrinogen alpha gene. Hum Genet. 2010 Oct;128(4):443-52. Epub 2010 Jul 31. (2010)
- 2009年
- Aoki M, Ueda S, Nishikawa H, Kitano S, Hirayama M, Ikeda H, Toyoda H, Tanaka K, Kanai M, Takabayashi A, Imai H, Shiraishi T, Sato E, Wada H, Nakayama E, Takei Y, Katayama N, Shiku H, Kageyama S: Antibody responses against NY-ESO-1 and HER2 antigens in patients vaccinated with combinations of cholesteryl pullulan (CHP)-NY-ESO-1 and CHP-HER2 with OK-432. Vaccine. 27:6854-61 2009.
- Tahara H, Sato M, Thurin M, Wang E, Butterfield LH, Disis ML, Fox BA, Lee PP, Khleif SN, Wigginton JM, Ambs S, Akutsu Y, Chaussabel D, Doki Y, Eremin O, Fridman WH, Hirohashi Y, Imai K, Jacobson J, Jinushi M, Kanamoto A, Kashani-Sabet M, Kato K, Kawakami Y, Kirkwood JM, Kleen TO, Lehmann PV, Liotta L, Lotze MT, Maio M, Malyguine A, Masucci G, Matsubara H, Mayrand-Chung S, Nakamura K, Nishikawa H, Palucka AK, Petricoin EF, Pos Z, Ribas A, Rivoltini L, Sato N, Shiku H, Slingluff CA, Streicher H, Stroncek DF, Takeuchi H, Toyota M, Wada H, Wu X, Wulfkuhle J, Yaguchi T, Zeskind B, Zhao Y, Zocca MB, Marincola FM: Emerging concepts in biomarker discovery; The US-Japan workshop on immunological molecular markers in oncology. J Transl Med. 7:45 2009.
- Wakita D, Chamoto K, Ohkuri T, Narita Y, Ashino S, Sumida K, Nishikawa H, Shiku H, Togashi Y, Kitamura H, Nishimura T: IFN--dependent type 1 immunity is crucial for immunosurveillance against squamous cell carcinoma in a novel mouse carcinogenesis model. Carcinogenesis. 8:1408-1415 2009.
- Imai N, Ikeda H, Tawara I, Wang L, Wang L, Nishikawa H, Kato T, Shiku H: Glucocorticoid-induced tumor necrosis factor receptor stimulation enhances the multifunctionality of adoptively transferred tumor antigen-specific CD8+ T cells with tumor regression. Cancer Sci. 100:1317-1325 2009.
- Hiasa A, Nishikawa H, Hirayama M, Kitano S, Okamoto S, Chono H, Yu SS, Mineno J, Tanaka Y, Minato N, Kato I, Shiku H: Rapid αβ TCR-mediated responses in γδ T cells transduced with cancer-specific TCR genes. Gene Ther. 16:620-628 2009.
- Isikawa H, Ito S, Nishio N, Yuzawa Y, Matsuo S, Isobe K.Injection of bleomycin in newborn mice induces autoimmune sialitis that is transferred by CD4 T cells.Immunol Cell Biol. 2009 May-Jun:87(4) 351-358
- Nishio N, Ito S, Suzuki H, Isobe K: Antibodies to wounded tissue enhance cutaneous wound healing. Immunology. 2009 Nov128 (3)369-380
- Kaunisto A, Kochin V, Asaoka T, Mikhailov A, Poukkula M, Meinander A, Eriksson JE: PKC-mediated phosphorylation regulates c-FLIP ubiquitylation and stability. Cell Death Differ, 2009;16:1215-1226.
- Hinohara K, Ohtani H, Nakajima T, Sasaoka T, Sawabe M, Lee BS, Ban J, Park JE, Izumi T, Kimura A: Validation of eight genetic risk factors in East Asian populations replicated the association of BRAP with coronary artery disease. J Hum Genet. 2009 Nov;54(11):642-6. Epub 2009 Aug 28. (2009)
- Hinohara K, Nakajima T, Sasaoka T, Sawabe M, Lee BS, Ban JM, Park JE, Izumi T, Kimura A: Validation of the association between AGTRL1 polymorphism and coronary artery disease in the Japanese and Korean populations. J Hum Genet. 2009 Sep;54(9):554-6. Epub 2009 Aug 14. (2009)
- Hinohara K, Nakajima T, Yasunami M, Houda S, Sasaoka T, Yamamoto K, Lee BS, Shibata H, Tanaka-Takahashi Y, Takahashi M, Arimura T, Sato A, Naruse T, Ban J, Inoko H, Yamada Y, Sawabe M, Park JE, Izumi T, Kimura A: Megakaryoblastic leukemia factor-1 gene in the susceptibility to coronary artery disease. Hum Genet. 2009 Oct;126(4):539-47. Epub 2009 Jun 10. (2009)
- Seo W, Ziltener HJ: CD43 processing and nuclear translocation of CD43 cytoplasmic tail are required for cell homeostasis. Blood. 2009 Oct 22;114(17):3567-77. doi: 10.1182/blood-2009-06-228791. Epub 2009 Aug 20. (2009)
- Carlow DA, Gossens K, Naus S, Veerman KM, Seo W, Ziltener HJ: PSGL-1 function in immunity and steady state homeostasis. Immunol Rev. 2009 Jul;230(1):75-96. doi: 10.1111/j.1600-065X.2009.00797.x. (2009)
- 2008年
- Nishikawa H, Kato T, Hirayama M, Orito Y, Sato E, Harada N, Gnjatic S, Old LJ, Shiku H: Regulatory T cell-resistant CD8+ T cells induced by glucocorticoid-induced tumor necrosis factor receptor signaling. Cancer Res, 2008;68:5948-5954.
- Hiasa A, Hirayama M, Nishikawa H, Kitano S, Nukaya I, Yu SS, Mineno J, Kato I Shiku H: Long-term phenotypic, functional and genetic stability of cancer-specific T cell receptor (TCR) αβ genes transduced to CD8+ T cells. Gene Ther. 15:695-699 2008.
- Nishikawa H, Tsuji T, Jäger E, Briones G, Ritter G, Old LJ, Galán JE, Shiku H, Gnjatic S: Induction of regulatory T cell-resistant helper CD4+ T cells by bacterial vector. Blood, 2008;111:1404-1412.
- Hinohara K, Nakajima T, Takahashi M, Hohda S, Sasaoka T, Nakahara KI, Chida K, Sawabe M, Arimura T, Sato A, Lee BS, Ban JM, Yasunami M, Park JE, Izumi T, Kimura A: Replication of the association between a chromosome 9p21 polymorphism and coronary artery disease in Japanese and Korean populations. J Hum Genet. 2008;53(4):357-359. Epub 2008 Feb 9. (2008)
- Kimura K, Ito S, Nagino M, Isobe K: Inhibition of reactive oxygen species down-regulates protein synthesis in RAW 264.7.Biochem Biophys Res Commun. 2008, Jul 18;372(1):272-275.
- Sasaki S, Ishida Y, Nishio N, Ito S, Isobe K: Thymic involution correlates with severe ulcerative colitis induced by oral administration of dextran sulphate sodium in C57BL/6 mice but not in BALB/c mice. Inflammation 2008 Oct 31(5):319-328
- 2007年
- Arimura T, Matsumoto Y, Okazaki O, Hayashi T, Takahashi M, Inagaki N, Hinohara K, Ashizawa N, Yano K, Kimura A: Structural analysis of obscurin gene in hypertrophic cardiomyopathy. Biochem Biophys Res Commun. 2007 Oct 19;362(2):281-7. Epub 2007 Aug 13. (2007)
- Arimura T, Hayashi T, Matsumoto Y, Shibata H, Hiroi S, Nakamura T, Inagaki N, Hinohara K, Takahashi M, Manatsu SI, Sasaoka T, Izumi T, Bonne G, Schwartz K, Kimura A: Structural analysis of four and half LIM protein-2 in dilated cardiomyopathy. Biochem Biophys Res Commun. 2007 May 25;357(1):162-7. Epub 2007 Mar 30. (2007)
- Tanaka-Takahashi Y, Yasunami M, Naruse T, Hinohara K, Matano T, Mori K, Miyazawa M, Honda M, Yasutomi Y, Nagai Y, Kimura A: Reference strand-mediated conformation analysis-based typing of multiple alleles in the rhesus macaque MHC class I Mamu-A and Mamu-B loci. Electrophoresis. 2007 Mar;28(6):918-24. (2007)
- Robart AR, Seo W, Zimmerly S: Insertion of group II intron retroelements after intrinsic transcriptional terminators. Proc Natl Acad Sci U S A. 2007 Apr 17;104(16):6620-5. doi: 10.1073/pnas.0700561104. Epub 2007 Apr 9. (2007)
- Ito S, Kimura K, Haneda M, Ishida Y, Sawada M, Isobe K: Induction of matrix metalloproteinases (MMP3, MMP12 and MMP13) expression in the microglia by amyloid-beta stimulation via the PI3K/Akt pathway.Exp Gerontol. 2007, June;42(6):532-537.
- Ishida Y, Okawa Y, Ito S, Shirokawa T, Isobe K: Age-dependent changes in dopaminergic projections from the substantia nigra pars compacta to the neostriatum. Neurosci Lett. 2007, May;418(3):257-261.
- 2006年
- Nishikawa H, Sato E, Briones G, Chen LM, Matsuo M, Nagata Y, Ritter G, Jager E, Nomura H, Kondo S, Tawara I, Kato T, Shiku H, Old LJ, Galan JE, Gnjatic S: In vivo antigen delivery by a Salmonella typhimurium type III secretion system for therapeutic cancer vaccines. J Clin Invest. 116:1946-1954 2006.
- Nishikawa H, Qian F, Tsuji T, Ritter G, Old LJ, Gnjatic S., Odunsi K: Influence of CD4+CD25+ regulatory T cells on low/high-avidity CD4+ T cells following peptide vaccination. J Immunol. 176: 6340-6346 2006.
- Gnjatic S, Nishikawa H, Jungbluth AA, Gure AO, Ritter G, Jager E, Knuth A, Chen YT, Old LJ. NY-ESO-1: Review of an immunogenic tumor antigen. Adv Cancer Res. 95: 1-30 2006.
- Ogawa S, Tawara I, Ueno S, Kimura M, Miyazaki K, Nishikawa H, Yamaguchi M, Kobayashi T, Shiku H: De novo CD5-positive diffuse large B-cell lymphoma of the temporal bone presenting with an external auditory canal tumor. Intern Med. 45:733-737 2006.
- Ito S, Sawada M, Haneda M, Ishida Y, Isobe K: Amyloid-beta peptides induce several chemokine mRNA expressions in the primary microglia and Ra2 cell line via the PI3K/Akt and/or ERK pathway.Neurosci Res. 2006 Nov;56(3):294-299.
- Isobe K, Ito S, Haneda M, Ishida Y.Cellular and systemic defense system against age-promoting stimuli.Nagoya J Med Sci. 2006 Jan;68(1-2):9-18.
- Du Y, Hirose N, Ping J, Ishida Y, Kojima T, Arai Y, Inagaki H, GondoY, Sakaki Y, Haneda M, Ito S, Isobe K: Analysis of growth hormone receptor polymorphism in Japanese semisuper centenarians.Geriatr Gerontol Int. 2006 June; 6(2):82-86.
- Kochin V, Imanishi SY, Eriksson JE: Fast track to a phosphoprotein sketch - MALDI-TOF characterization of TLC-based tryptic phosphopeptide maps at femtomolar detection sensitivity. Proteomics, 2006;6:5676-5682.
- 2005年
- Sato E, Olson SH, Ahn J, Bundy B, Nishikawa H, Qian F, Jungbluth AA, Frosina D, Gnjatic S, Ambrosone C, Kepner J, Odunsi T, Ritter G, Lele S, Chen YT, Ohtani H, Old LJ, Odunsi K: Intraepithelial CD8+ tumor-infiltrating lymphocytes and a high CD8+/regulatory T cell ratio are associated with favorable prognosis in ovarian cancer. Proc Natl Acad Sci USA. 102:18538-18543 2005.
- Nishikawa H, Jäger E, Ritter G, Old LJ, Gnjatic S: CD4+ CD25+ regulatory T cells control the induction of antigen-specific CD4+ helper T cell responses in cancer patients. Blood, 2005;106:1008-1011.
- Nishikawa H, Kato T, Tawara I, Ikeda H, Kuribayashi K, Allen PM, Schreiber RD, Old LJ, Shiku H: Interferon-γ controls the generation/activation of CD4+ CD25+ regulatory T cells in anti-tumor immune response. J Immunol. 175: 4433-4440 2005.
- Nishikawa H, Kato T, Tawara I, Takemitsu T, Saito K, Wang L, Ikarashi Y, Wakasugi H, Nakayama T, Taniguchi M, Kuribayashi K, Old LJ, Shiku H: Accelerated chemically induced tumor development mediated by CD4+CD25+ regulatory T cells in wild-type hosts. Proc Natl Acad Sci U S A, 2005;102:9253-9257.
- Nishikawa H, Kato T, Tawara I, Saito K, Ikeda H, Kuribayashi K, Allen PM, Schreiber RD, Sakaguchi S, Old LJ, Shiku H: Definition of target antigens for naturally occurring CD4(+) CD25(+) regulatory T cells. J Exp Med, 2005;201:681-686.
- Drew E, Merzaban JS, Seo W, Ziltener HJ, McNagny KM: CD34 and CD43 inhibit mast cell adhesion and are required for optimal mast cell reconstitution. Immunity. 2005 Jan;22(1):43-57. doi: 10.1016/j.immuni.2004.11.014. (2005)
- Ito S, Sawada M, Haneda M, Fujii S, Oh-Hashi K, Kiuchi K, Takahashi M, Isobe K: Amyloid-beta peptides induce cell proliferation and macrophage colony-stimulating factor expression via the PI3-kinase/Akt pathway in cultured Ra2 microglial cells. FEBS Lett. 2005 Mar 28;579(9):1995-2000.
ムーンショット型研究開発事業[目標7]慢性炎症の制御によるがん発症ゼロ社会の実現
大学院生募集案内
私たちの研究室は、さまざまなバックグラウンドを持った人たちが集まっています。異なる分野の人たちが私たちの研究に加わることで、これまで想像もつかなかった画期的なアイデアが生まれると確信しています。
あなたもその一人となって、世界を驚かす研究を目指してみませんか?
大学院生活、就職、進学等で知りたいことがあれば気軽に相談してください。また大学院入学後も困ったことがあれば全力でサポートします。
研究に熱意のある方、大歓迎です!!