研究室紹介Laboratories
- Back
- Top > 研究室紹介 > 高次神経統御学(協力) > 免疫代謝学
高次神経統御学(協力)免疫代謝学
研究室概要
ライフスタイルの欧米化に伴って、我が国においても肥満が増加し、メタボリックシンドロームや様々な生活習慣病の誘因となっています。生活習慣病は遺伝素因と環境因子の相互作用により発症する代表的な多因子疾患であり、我々を取り巻く環境の変化と生体のストレス応答が大きく関わっています。当研究室では、1つの分子や1つの細胞に注目するだけでなく、各臓器を構成する多彩な細胞の相互作用や臓器間ネットワークを理解することにより、生活習慣病の分子メカニズムを明らかにしたいと考えています。
生活習慣病を解くキーワードとして、私たちは"慢性炎症"に注目しています。近年、様々な慢性疾患に共通の病態基盤として"慢性炎症"が注目されており、 実際に、肥満の脂肪組織にマクロファージ等の炎症細胞が浸潤することにより、メタボリックシンドロームを発症することが明らかになってきました。一方、過栄養や栄養飢餓といった栄養の"量"の変化に加えて、動物性の飽和脂肪酸や魚油に多く含まれるω-3多価不飽和脂肪酸等の栄養の"質"の変化が炎症免疫系 を制御することも知られています。このように、生活習慣病は"炎症免疫学"と"栄養代謝学"の両面から捉える必要があります。当研究室は、基礎研究と臨床 研究を繋ぐ立ち位置で、生活習慣病の病態解明や新しい治療法の開発に貢献したいと考えています。
研究プロジェクト
1. 生活習慣病の基盤病態“慢性炎症”の分子機構の解明と医学応用
近年、種々の慢性疾患に共通の基盤病態として“慢性炎症”が注目されています。従来、動脈硬化や自己免疫性疾患などにおいて慢性炎症の分子メカニズムや病態生理的意義が精力的に研究されてきましたが、最近では、肥満や癌、神経変性疾患なども慢性炎症性疾患の一面を有することが明らかになってきました。従って、慢性炎症の分子機構の解明は、数多くの慢性疾患の治療法や予防法の開発に応用できる可能性があります。しかしながら、慢性炎症の実態は未だ不明の点が多く、慢性炎症を標的とする治療法も確立していません。
慢性炎症の特徴として、“組織リモデリング”が挙げられます。全ての臓器は、その臓器を特徴付ける“実質細胞”とそれ以外の“間質細胞”から構成されています。間質細胞には、血管構成細胞、免疫担当細胞、組織幹細胞、線維芽細胞など多彩な細胞が含まれ、臓器や病態に特徴的なプロフィールを有しています。このような実質細胞と間質細胞が相互作用することにより、臓器の恒常性が維持されています。慢性的にストレスが加わると、このバランスが破綻し、構成細胞の数や種類が大きく変化して、多くの場合、間質線維化を呈して臓器機能不全に至ります。私たちは、脂肪組織や肝臓に注目して、過栄養により誘導される“代謝性組織リモデリング”の分子機構の解明と医学応用に関する研究に取り組んでいます。
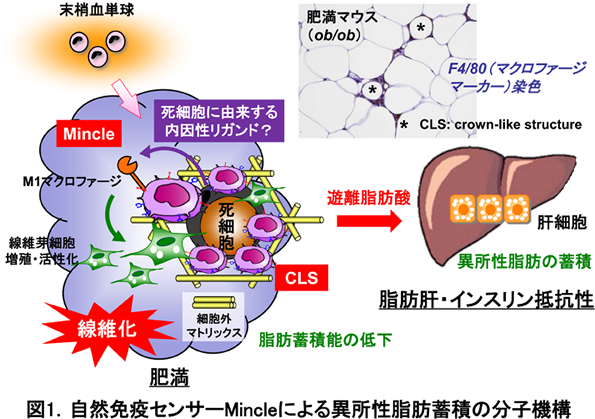
1−1. 自然免疫センサーMincleによる脂肪組織線維化と異所性脂肪蓄積の分子機構の解明
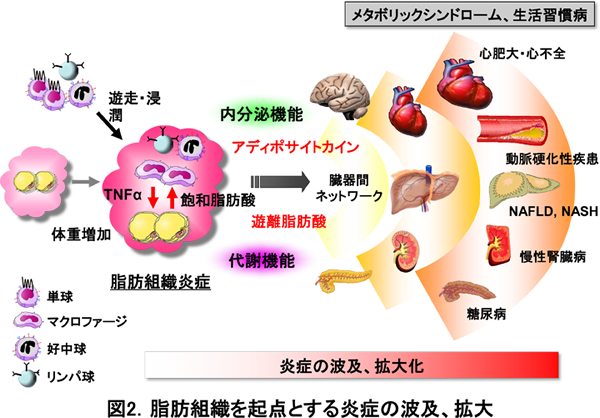
慢性炎症の結果、多くの臓器は間質線維化を呈しますが、脂肪組織も例外ではありません。肥満における脂肪組織線維化は、脂肪肝に代表される異所性脂肪蓄積を誘導しますが、その分子機構は不明でした。本研究では、肥満の脂肪組織に高発現する新規自然免疫センサーMincleが間質線維化を誘導し、異所性脂肪蓄積をもたらすことを明らかにしました(図1)。従来、Mincleは病原体センサーとして、結核菌の構成成分を認識して生体の感染防御に働くことが知られていました。肥満の脂肪組織にはcrown-like structure(CLS, 王冠様構造)と呼ばれる特徴的な組織像が存在します。これは、肥満の過程で様々な代謝ストレスにより細胞死に陥った脂肪細胞をマクロファージが取り囲んで、貪食・処理する構造です。私たちは、MincleがCLSを構成するマクロファージに限局して高発現すること、死細胞に由来する内因性リガンドを認識してMincleが活性化すると、間質線維化を誘導し、異所性脂肪蓄積が増加することを見出しました。本研究により、脂肪組織炎症がアディポサイトカインの産生調節(内分泌機能)のみならず、脂肪蓄積能(代謝機能)を制御することが明らかになりました(図2)。
1−2. Hepatic CLSを起点とするNASH発症の分子機構の解明
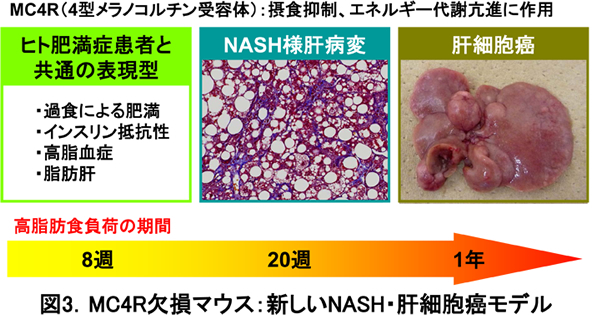
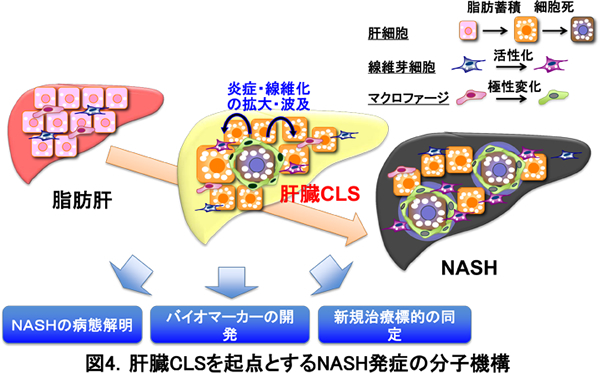
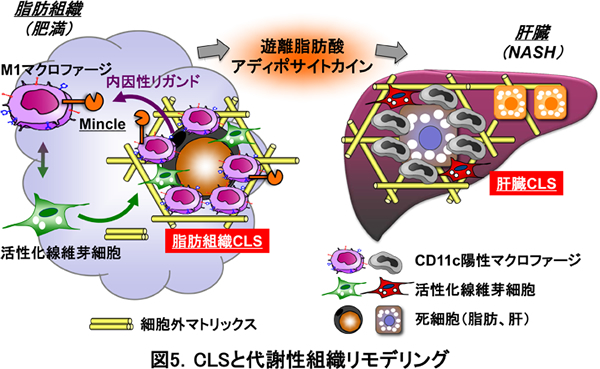
最近、私たちは、CLSを起点とする間質線維化の分子メカニズムが、非アルコール性脂肪肝炎(NASH)においても認められることを明らかにしました。NASHは予後良好の単純性脂肪肝と異なり、一定の割合で肝硬変や肝細胞癌に進行するため、その対策は喫緊の課題です。最近、私たちは、ヒトNASHの病態を反映するNASH動物モデルの開発に成功しました(図3)。即ち、中枢性に摂食を制御するメラノコルチン4型受容体欠損(MC4R KO)マウスに高脂肪食を負荷することにより、肥満やインスリン抵抗性を背景として、脂肪肝、NASH、肝細胞癌を経時的にほぼ100%の確率で発症することを見出しました。さらに、NASH動物モデルやヒトNASHの病理組織像を詳細に解析することにより、肥満の脂肪組織で認められるCLSと非常に類似した組織像に気付きました(図4)。興味深いことに、肝臓CLSはウイルス性肝障害では全く認められず、代謝性肝障害に特徴的な所見でした。肝臓CLSは、NASHの発症に先行して形成され、間質線維化の起点となります。従って、肝臓CLSの詳細を明らかにすることにより、NASHの病態解明や、疾患特異的なバイオマーカーおよび新しい創薬ターゲットの同定が可能になると期待されます。このように、脂肪組織と肝臓のCLSは、実質細胞と間質細胞の相互作用の場であり、代謝性に誘導される組織リモデリングの駆動エンジンとして働くことが明らかになりました(図5)。
2. “栄養”に対する生体応答の分子機構の解明と医学応用
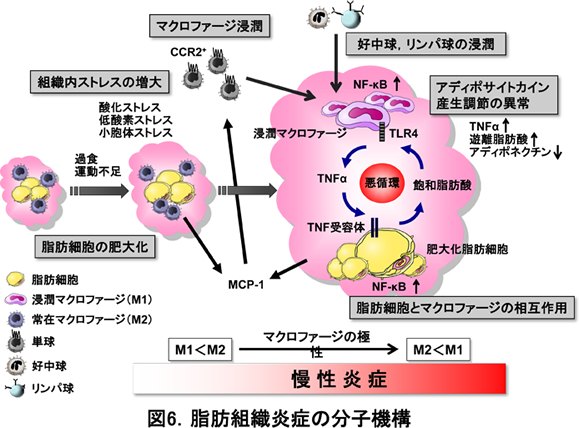
近年、過栄養により誘導される慢性炎症がメタボリックシンドロームの基盤病態であることが明らかになり、栄養と炎症の関連が注目されています。私たちは、脂肪細胞に過剰に蓄積した脂肪酸、特に動物性脂肪に多く含まれる飽和脂肪酸が脂肪組織炎症の鍵となることを見出しました(図6)。即ち、脂肪細胞に由来する飽和脂肪酸は、グラム陰性桿菌に対する病原体センサーTLR4を介してマクロファージを活性化し、脂肪細胞とマクロファージが液性因子を介して相互作用することにより“悪循環”を形成して、持続的な炎症反応が惹起されます。これに対して、魚油に多く含まれるEPAなどのω-3多価不飽和脂肪酸は、飽和脂肪酸に拮抗的に作用して炎症抑制性に働きます。このような“栄養”による炎症制御の分子メカニズムは、未だ研究の端緒についたばかりです。特に、リンパ球やマクロファージなどの免疫担当細胞の機能が細胞内代謝により制御されていることが明らかになり、栄養・代謝と炎症・免疫のクロストークに象徴される“Immunometabolism”と呼ばれる学問領域が注目されています。
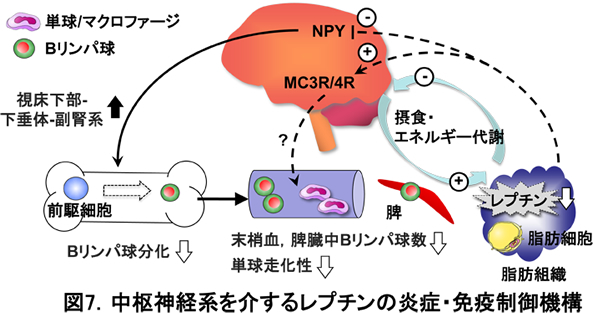
レプチンは代表的なアディポサイトカイン(脂肪組織に由来する生理活性物質)であり、生体の栄養状態を感知して、エネルギー代謝の恒常性を維持する“栄養センサー”の役割を担っています。即ち、レプチンは、体脂肪量に比例して脂肪細胞より産生され、視床下部のレプチン受容体を介して摂食抑制やエネルギー消費の亢進に働きます。従来、栄養飢餓状態が免疫不全をもたらすことが知られていましたが、その分子メカニズムは十分に理解されていません。私たちは、レプチンが中枢神経系を介して末梢の炎症・免疫系を制御することを見出しました(図7)。飢餓状態では、血中レプチン濃度が低下することにより、骨髄のリンパ球分化や単球の遊走が障害されます。一方、レプチンを欠損するマウスは、肥満や高血糖など過栄養状態であるにもかかわらず、リンパ球や単球の障害が認められました。このような栄養・代謝と炎症・免疫系の関連は、肥満やメタボリックシンドロームなど過栄養の状態に加えて、若い女性の「痩せ過ぎ」、加齢によるフレイル、悪性腫瘍や慢性炎症性疾患による全身消耗状態など様々な病態に関与すると考えられます。
3. “医工連携”による生活習慣病に対する新しい治療戦略の開発
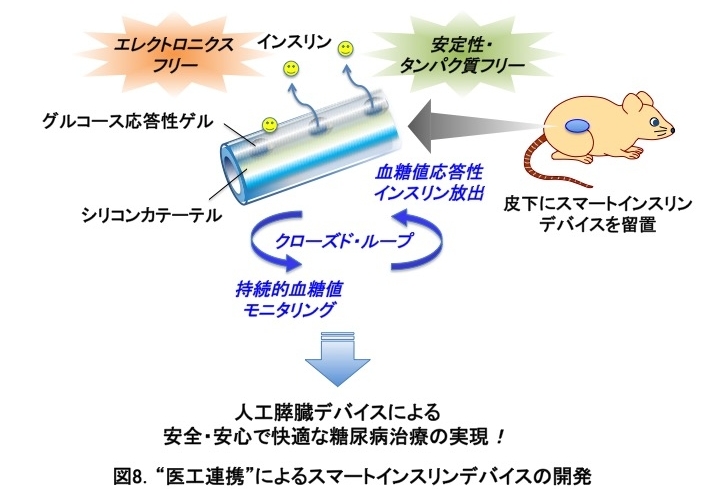
近年、糖尿病に対するインスリン治療においてインスリンポンプの普及が進んでいますが、患者に及ぼす身体的・心理的負担や機械特有の補正・メンテナンスの必要性、医療経済上の問題など多くの課題があります。このため、エレクトロニクス(機械や電気)駆動を必要としない、自律型のインスリンポンプである「人工膵臓」の創出が強く求められています。従来、グルコースオキシダーゼやレクチン等のタンパク質を基材とする試みがなされてきましたが、生体由来材料の限界として、タンパク質変性に伴う不安定性や毒性が不可避であり、未だ実用化には至っていません。
この問題を解決するために、私たちは、東京医科歯科大学生体材料工学研究所・松元亮博士の研究グループと協力して、タンパク質を一切使用しない、完全合成材料のみによるアプローチを考案しました(図8)。グルコースと可逆的に結合するボロン酸を高分子ゲルに化学的に組み込み、さらにこれを一本のカテーテルに搭載することで、皮下挿入が容易で、かつ「人工膵臓」機能を発揮する自律型のインスリン供給デバイス(スマートインスリンデバイス)の開発に成功しました。実際、健常および糖尿病モデルマウスの皮下に本デバイスを留置することにより、「クローズド・ループ型」のインスリン供給を達成しました。即ち、連続的な血糖値検知と血糖値変動に応答した拡散制御からなるフィードバック機構によりインスリン供給が調整されます。その結果、1型糖尿病(インスリン欠乏状態)および2型糖尿病(インスリン抵抗性状態)のいずれの病態においても、本デバイスが3週間以上の持続性を持って、糖代謝を良好に制御することを実証しました。
本研究は、世界初の「エレクトロニクスフリー」かつ「タンパク質フリー」なアプローチによるスマートインスリンデバイスの糖尿病治療機能を高いレベルで実証したものです。糖尿病におけるアンメットメディカルニーズ(低血糖の回避、血糖値スパイクの改善、患者負担の軽減)の解決に加え、「機械型」のものと比べて極めて安価かつ使用負担が軽減されるため、発展途上国、高齢者、要介護者等これまで普及が困難であった患者に対しても新たな治療オプションを提供する可能性を秘めています。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 菅波 孝祥 | 教授 | 免疫代謝学 |
| 田中 都 | 講師 | 免疫代謝学 |
| 伊藤 綾香 | 講師 | 免疫代謝学 |
研究実績
- 2018年
- T. Goto, M. Itoh, T. Suganami, S. Kanai, I. Shirakawa, T. Sakai, M. Asakawa,T. Yoneyama, T. Kai, Y. Ogawa. Obeticholic acid protects against hepatocyte death and liver fibrosis in a murine model of nonalcoholic steatohepatitis. Sci. Rep. in press, 2018.
- M. Tanaka, M. Itoh, Y. Ogawa, T. Suganami. Molecular mechanism of obesity-induced “metabolic” tissue remodeling. J. Diabetes Investig. 9: 256-261, 2018. (review)
- 2017年
- M. Itoh, T. Suganami, H. Kato, S. Kanai, I. Shirakawa, T. Sakai, T. Goto, M. Asakawa, I. Hidaka, H. Sakugawa, K. Ohnishi, Y. Komohara, K. Asano, I. Sakaida, M. Tanaka, Y. Ogawa. CD11c-positive resident macrophages drive hepatocyte death-triggered liver fibrosis in a murine model of non-alcoholic steatohepatitis. JCI Insight 2: e92902, 2017.
- A. Matsumoto, M. Tanaka, H. Matsumoto, K. Ochi, Y. Moro-oka, H. Kuwata, H. Yamada, I. Shirakawa, T. Miyazawa, H. Ishii, K. Kataoka, Y. Ogawa, Y. Miyahara, T. Suganami. Synthetic “smart-gel” provides glucose-responsive insulin delivery in diabetic mice. Sci. Adv. 3: eaaq0723, 2017. (cover picture of the issue)
- C. Komiya, M. Tanaka, K. Tsuchiya, N. Shimazu, K. Mori, S. Furuke, Y. Miyachi, K. Shiba, S. Yamaguchi, K. Ikeda, K. Ochi, K. Nakabayashi, K. Hata, M. Itoh, T. Suganami, Y. Ogawa. Antifibrotic effect of pirfenidone in a mouse model of human nonalcoholic steatohepatitis. Sci. Rep. 7: 44754, 2017.
- M.Tanaka, T. Suganami. Molecular mechanism underlying nutritional control of inflammatory responses. J. Phys. Fitness Sports Med. 6: 227-231, 2017.
- 2016年
- R. Hachiya, T. Shiihashi, I. Shirakawa, Y. Iwasaki, Y. Matsumura, Y. Oishi, Y. Nakayama, Y. Miyamoto, I. Manabe, K. Ochi, M. Tanaka, N. Goda, J. Sakai, T. Suganami, Y. Ogawa. The H3K9 methyltransferase Setdb1 regulates TLR4-mediated inflammatory responses in macrophages. Sci. Rep. 6: 28845, 2016.
- T. Suganami, M. Tanaka, Y. Ogawa. Molecular mechanisms underlying obesity-induced chronic inflammation. Chronic Inflammation: Mechanisms and Regulation. Springer Japan, 291-298, 2016.
- 2015年
- K. Konuma, M. Itoh, T. Suganami, S. Kanai, N. Nakagawa, T. Sakai, H. Kawano, M. Hara, S. Kojima, Y. Izumi, Y. Ogawa. Eicosapentaenoic acid ameliorates non-alcoholic steatohepatitis in a novel mouse model using Melanocortin 4 receptor-deficient mice. PLoS ONE 10: e0121528, 2015.
- T. Ehara, Y. Kamei, X. Yuan, M. Takahashi, S. Kanai, K. Tsujimoto, T. Tamiya, Y. Nakagawa, H. Shimano, T. Takai-Igarashi, I. Hatada, T. Suganami, K. Hashimoto, Y. Ogawa. Ligand-activated PPARα-dependent DNA demethylation regulates the fatty acid β-oxidation genes in the postnatal liver. Diabetes 64: 775-784, 2015.
- 2014年
- M. Tanaka, K. Ikeda, T. Suganami, C. Komiya, K. Ochi, I. Shirakawa, M. Hamaguchi, S. Nishimura, I. Manabe, T. Matsuda, K. Kimura, H. Inoue, Y. Inagaki, S. Aoe, S. Yamasaki, Y. Ogawa. Macrophage-inducible C-type lectin underlies obesity-induced adipose tissue fibrosis. Nat. Commun. 5: 4982, 2014.
- Y. Iwasaki, T. Suganami, R. Hachiya, I. Shirakawa, M. Kim-Saijo, M. Tanaka, M. Hamaguchi, T. Takai-Igarashi, M. Nakai, Y. Miyamoto, Y. Ogawa. Activating transcription factor 4 links metabolic stress to interleukin-6 expression in macrophages. Diabetes 63: 152-161, 2014.
- 2013年
- M. Itoh, H. Kato, T. Suganami, K. Konuma, Y. Marumoto, S. Terai, H. Sakugawa, S. Kanai, M. Hamaguchi, T. Fukaishi, S. Aoe, K. Akiyoshi, Y. Komohara, M. Takeya, I. Sakaida, Y. Ogawa. Hepatic crown-like structure: a unique histological feature in non-alcoholic steatohepatitis in mice and humans. PLoS ONE 8: e82163, 2013.
- 2012年
- T. Ehara, Y. Kamei, M. Takahashi, X. Yuan, S. Kanai, E. Tamura, M. Tanaka, T. Yamazaki, S. Miura, O. Ezaki, T. Suganami, M. Okano, Y. Ogawa. Role of DNA methylation in the regulation of lipogenic glycerol-3-phosphate acyltransferase 1 gene expression in the mouse neonatal liver. Diabetes 61: 2442-2450, 2012.
- N. Satoh-Asahara, A. Shimatsu, Y. Sasaki, H. Nakaoka, A. Himeno, M. Tochiya, S. Kono, T. Takaya, K. Ono, H. Wada, T. Suganami, K. Hasegawa, Y. Ogawa. Highly purified eicosapentaenoic acid increases interleukin-10 levels of peripheral blood monocytes in obese patients with dyslipidemia. Diabetes Care 35: 2631-2639, 2012.
- 2011年
- M. Ichioka, T. Suganami, N. Tsuda, I. Shirakawa, Y. Hirata, N. Satoh-Asahara, Y. Shimoda, M. Tanaka, M. Kim-Saijo, Y. Miyamoto, Y. Kamei, M. Sata, Y. Ogawa. Increased expression of macrophage-inducible C-type lectin in adipose tissue of obese mice and humans. Diabetes 60: 819-826, 2011.
- M. Tanaka, T. Suganami, M. Kim-Saijo, C. Toda, M. Tsuiji, K. Ochi, Y. Kamei, Y. Minokoshi, Y. Ogawa. Role of central leptin signaling in the starvation-induced alteration of B cell development. J. Neurosci. 31: 8373-8380, 2011.
- M. Itoh, T. Suganami, N. Nakagawa, M. Tanaka, Y. Yamamoto, Y. Kamei, S. Terai, I. Sakaida, Y. Ogawa. Melanocortin-4 receptor-deficient mice as a novel mouse model of non-alcoholic steatohepatitis. Am. J. Pathol. 179: 2454-2463, 2011.
研究キーワード
慢性炎症、生活習慣病、肥満、栄養、臓器連関、医工連携
大学院生募集
分子代謝医学分野では大学院生(博士課程・修士課程)を募集しています。医学部・歯学部・農学部・薬学部・理学部・工学部系の大学卒業または卒業見込みの方、修士課程修了または修了見込みの方、博士課程終了後に日本学術振興会特別研究員に応募予定の方で、私たちの研究テーマに興味をお持ちの意欲的な方を歓迎します。一緒に"夢"のある研究をしましょう!