研究室紹介Laboratories
- Back
- Top > 研究室紹介 > がん先端診断・治療開発学(連携) > 標的探索・治療学(愛知県がんセンター)
がん先端診断・治療開発学(連携)標的探索・治療学(愛知県がんセンター)
概要
当講座では、がんを細胞の恒常性維持メカニズムの破綻として捉え、その分子機序について研究しています。元来正常細胞には、その恒常性を維持し、分化・増殖・運動などを厳密に制御する様々な仕組みが備わっています。しかし様々な遺伝子変異やエピジェネティックな異常の蓄積、あるいは環境変化によって細胞の分化・増殖を司るシグナル伝達分子の機能異常が引き起こされる結果、無秩序な増殖や浸潤・転移に至ります。がんの治療を困難にしている理由の一つは、その原因が多様かつ複合的であることです。私たちはがん形質に直接対応している細胞恒常性の分子機序からのアプローチにより、がん細胞において破綻している恒常性維持機構を解明し、薬剤等でそこに働きかけることによりがん形質を抑制してがん細胞を正常細胞に近い状態へと導く可能性を探求しています。そこで、最初に同定されたがん遺伝子で細胞膜直下に存在するシグナル分子Srcを起点として、恒常性破綻のメカニズムに立脚した新たな分子標的を探索し、得られた成果を診断・治療シーズへと結実させ、がんの先進医療に貢献したいと考えています。
研究プロジェクト
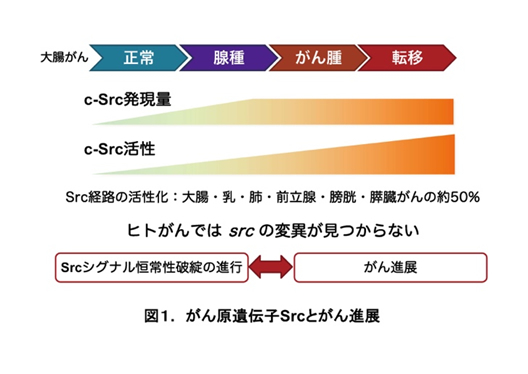
ラウス肉腫ウイルスのSrc遺伝子(v-src)は、最初に発見されたがん遺伝子であり、その産物はチロシンキナーゼとして初めて同定された蛋白質です。v-srcの相同遺伝子として正常細胞に見出されたc-srcは、代表的ながん原遺伝子とされ、大腸がんや乳がん、肺がんなど多くのヒトがん細胞で発現及び活性の亢進が見られるため、がん形質との関わりが強く示唆されています(図1)。またc-Srcを含むSFK(Src family kinases) の異常は、80%の大腸がんに見られ、5-10倍の活性上昇が見られるとの報告もあります。そのため、SFKはがんの治療標的として注目され、いくつかの低分子阻害剤が臨床試験されています。しかしsrcは他のがん原遺伝子と異なり、ヒトの腫瘍において遺伝子変異はほとんど見いだされず正常型として発現しています。このことから、c-Srcの活性制御系や発現調節系の何らかの破綻が他のがん関連遺伝子の変異と協調し、Srcを強力に活性化することでがん形質の発現・増強に至っていると考えられ、その詳細なメカニズムの解明は重要な課題となっています。
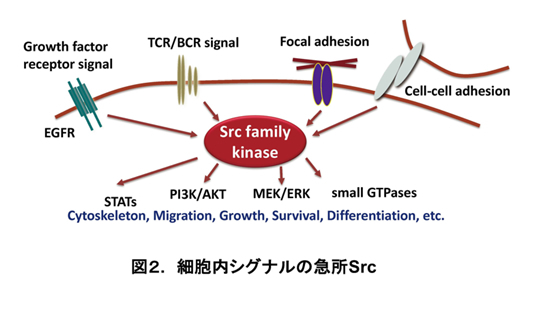
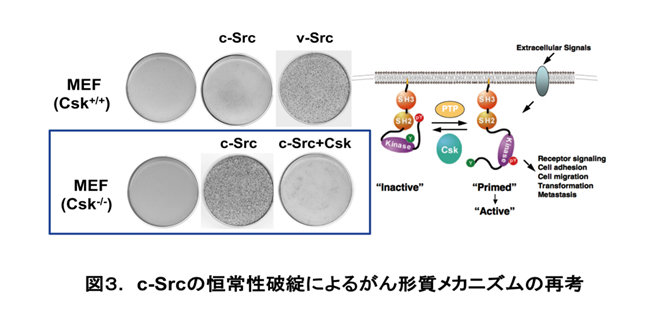
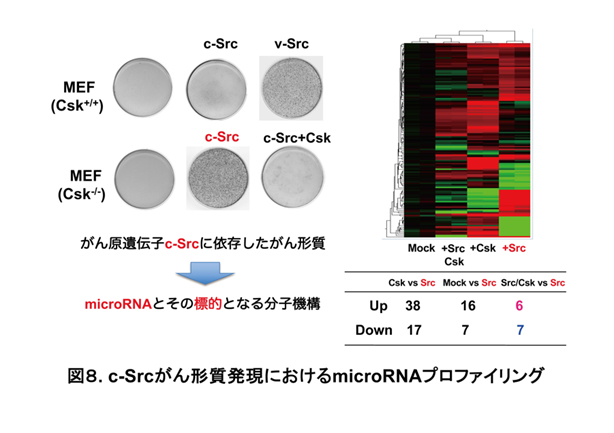
一方、Srcは増殖因子やインテグリンからの細胞外シグナルを様々な下流の細胞内シグナル経路に伝達する中継点であり(図2)、正常細胞において、増殖・生存・細胞骨格構築、細胞外マトリックスとの相互作用、遊走など幅広い生理機能に関与しています。これらの機能を果たしつつ、がん化に繋がりかねないSrcを正しく制御するため、細胞にはその活性を抑制する種々の機構が備わっています。実際、c-Srcを正常細胞に過剰発現しても、その活性は抑制されがん化を誘起できません。そこで従来の研究では、v-Srcや恒常活性型のSrc変異体が用いられてきました。しかしこれらは異常な細胞内蛋白質のリン酸化亢進を示すことから、実際のc-Srcの作用を反映しているのか疑問があり、c-Srcによるがん形質モデル系の創出が望まれていました。私たちは、Srcを負に制御するCsk(C-terminal Src kinase)を欠損したマウス線維芽細胞が、c-Srcを発現させることによってがん化することを見出しました(図3参照:Oneyama et al, Genes Cells, 2008)。CskはSrcの負の制御部位であるTyr527をリン酸化するキナーゼであり、その欠損によりSrcの活性が閾値を超えるとがん形質に至ります。この系は、細胞内蛋白質のリン酸化亢進が極めて限定的であるにも関わらず、頻用されてきた活性型Srcと同等のがん形質を示します。すなわちがん化に最小限必要なSrc基質やシグナル伝達経路を見出す点で優れた性質を有していると考えられます。
これまで私たちは、このモデル系を活用してc-Srcによるがん形質発現の分子機構を再考してきました。その中で明らかにしてきたこと、および現在取り組んでいるテーマについて以下に記します。
1. 細胞外膜小胞エクソソームの形成・分泌メカニズムの解明
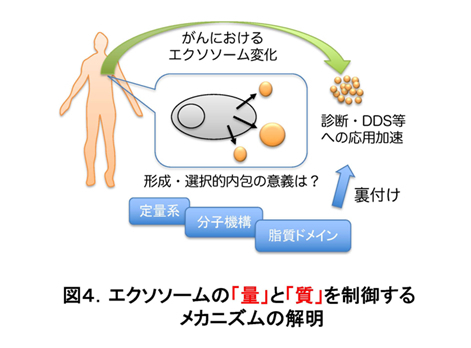
がんの組織は、がん細胞とその周辺細胞から成り立っています。これらの細胞同士の細胞間コミュニケーションは、がんの悪性化や細胞の恒常性維持を担っていると考えられ、がんの本態解明とがん診断・治療に向けて研究が盛んとなっています。近年、エクソソームとよばれる直径100nm程度の細胞外膜小胞を介した細胞間コミュニケーションが注目され、エクソソームに内包されるmicroRNAに基づくがん診断や、内包分子の役割解明に向けての研究が多くなされています。エクソソームの潜在的な医学・生物学上の重要性は極めて高いと考えられますが、そもそも何故がんにおいてエクソソームの「量」が変化するのか、ある内包分子「質」が選択されるのか、といった基礎的な面では、未だ不明な点が多く残されています(図4)。我々は、後述の細胞内Srcシグナルの制御機構とがんのメカニズムの研究を元に、最近、Srcシグナルの活性化がエクソソームの分泌や内包物の選択に大きく関わっていることを見出しました (図5参照:Hikita, Kuwahara et al, Sci Rep, 2019)。また、これまで定量の難しかったエクソソームを簡便かつ高精度に定量できる発行定量法を構築し、定量だけでない応用法について報告した (Hikita et al, Sci Rep, 2018)。この定量法を用いて効率的にエクソソームの形成・分泌メカニズムの詳細を明らかにすることにより、エクソソーム形成・分泌過程に関わる分子を標的とした、新たながん診断・治療法の開発を目指しています。
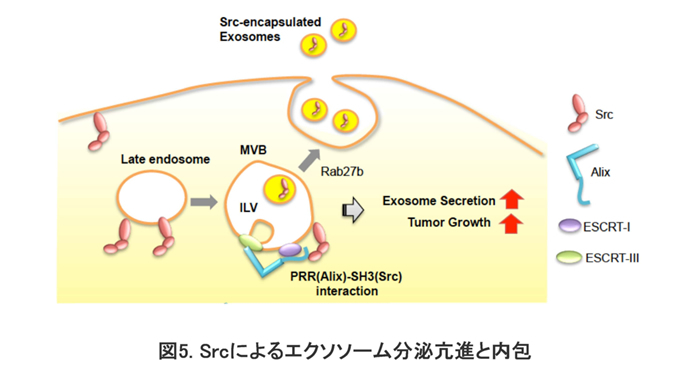
2. 脂質ラフトによるがんシグナルの空間的制御
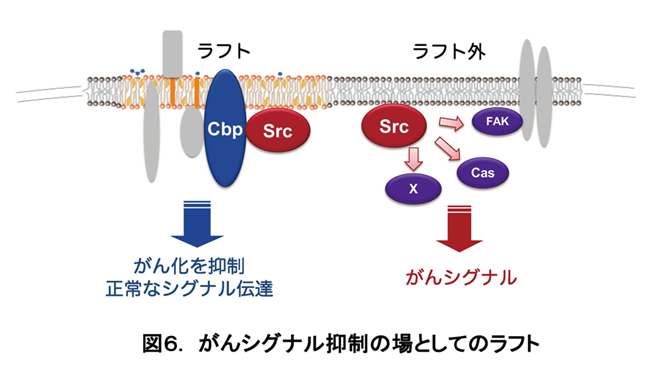
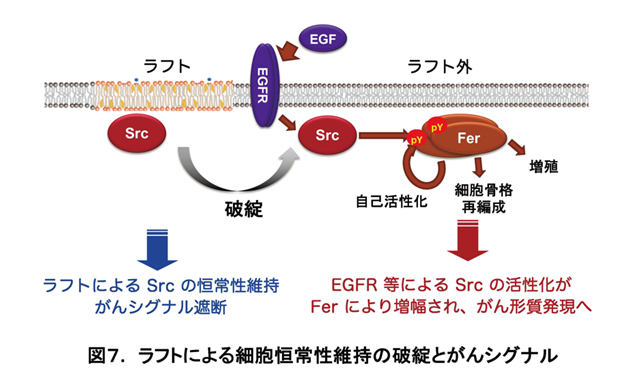
細胞の生存・増殖を調整する役割を担うキナーゼ等のシグナル伝達分子は、その発現や活性が様々なレベルで制御され、その仕組みは細胞の恒常性維持に重要です。がん原遺伝子産物c-Srcは代表的なチロシンキナーゼであり、様々なヒトがんにおいて発現・活性の亢進が認められ、その制御破綻が発がん及び悪性化と深く関わっていると想定されてきました。しかしその一方で、Srcは自身の遺伝子変異を伴わない場合が多く、制御破綻に関わる分子機構については不明な点が残されています。我々はSrcの制御機構として新たに細胞膜ミクロドメインであるラフトの関与を明らかにし、コレステロールや脂質代謝酵素のがん形質への関与を見出してきました (図6参照: Oneyama et al, Mol Cell, 2008., Oneyama et al, Mol Cell Biol, 2009., Kajiwara et al, Biochem J, 2014)。ラフトはシグナル分子を膜上で空間的に制御して、細胞接着斑から発信されるがんシグナルを遮断する機能を担っていました。またこの発見に基づき、ラフト依存的がんシグナルに関与する分子を探索し、FerキナーゼがSrcがんシグナル経路の鍵分子であることを見出し、新たながん治療標的としての可能性を示しました (図7参照: Oneyama et al, Oncogene, 2016)。この発見をもとに、現在Ferを標的とする薬剤の開発も目指しています。
3. マイクロRNAを介したシグナルネットワークの破綻とがん進展
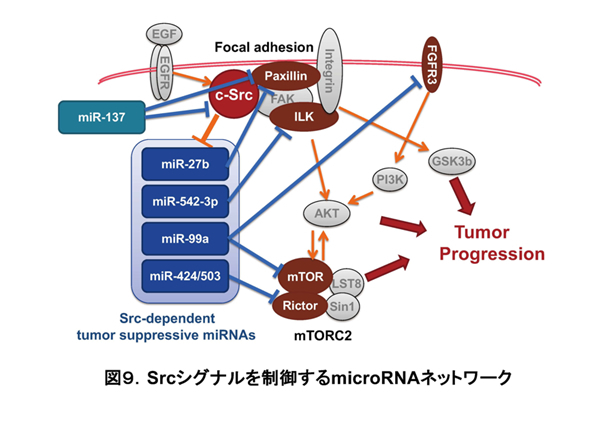
近年、microRNA(miRNA)による遺伝子の発現制御が細胞の恒常性維持に果たす役割が次々に明らかとなっています。1つのmiRNAは複数の標的遺伝子の発現を制御し、またそれぞれの遺伝子は複数のmiRNAによる制御を受けています。我々はシグナル異常によるがん形質と密接に関連するmiRNAを探索し(図8参照:Oneyama et al, Oncogene, 2011)、その標的遺伝子を明らかにしてきました (図9参照: Oneyama, J Biochem, 2015; Review)。その結果様々なシグナル分子の発現がmiRNAによる制御を受けており、従来研究されてきたシグナル分子同士の直接的な相互作用の背後に、miRNAを介したシグナルネットワークが存在していることがわかってきました。
例えば、Srcがんシグナルによって制御されるmiR-99a及びmiR-424/503が、それぞれmTOR複合体2の構成因子であるmTORとRictorを制御していることを見出しています (Oneyama et al, Oncogene, 2011., Oneyama et al, Oncogene, 2012., Oneyama et al, PLoS One, 2013)。またSrc自身もmiR-137によって制御されていることがわかりました (Kokuda et al, Genes Cells, 2018)。miRNAを切り口に、新たなシグナル分子間の関連性を見出すことは、代替シグナル経路の活性化により薬剤耐性を獲得したがんに対する新たな治療標的の提案などに応用できると考えています。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 小根山 千歳 | 連携教授 | 標的探索・治療学 |
研究実績
- 2019年
- Hikita T, Kuwahara A, Watanabe R, Miyata M, Oneyama C.: Src in endosomal membranes promotes exosome secretion and tumor progression. Sci Rep, 9: 3265, 2019.
- 2018年
- Kokuda R, Watanabe R, Okuzaki D, Akamatsu H, Oneyama C.: MicroRNA-137-mediated Src oncogenic signaling promotes cancer progression. Genes Cells, 23(8): 688-701, 2018.
- Hikita T, Miyata M, Watanabe R, Oneyama C.: Sensitive and rapid quantification of exosomes by fusing luciferase to exosome marker proteins. Sci Rep, 8: 14035, 2018.
- 2016年
- Oneyama C, Yoshikawa Y, Ninomiya Y, Iino T, Tsukita S, Okada M.: Fer tyrosine kinase oligomer mediates and amplifies Src-induced tumor progression. Oncogene, 35(4): 501-512, 2016.
- Matsuyama R, Okuzaki D, Okada M, Oneyama C. miR-27b suppresses tumor progression by regulating ARFGEF1 and the focal adhesion signaling. Cancer Science, 107(1): 28-35, 2016.
- 2015年
- Kakumoto, K., Ikeda, J., Okada, M., Morii, E. and Oneyama, C.: mLST8 promotes mTOR-mediated tumor progression. PLoS One, 10(4): e0119015, 2015.
- 2014年
- Kajiwara K, Yamada T, Bamba T, Fukusaki E, Imamoto F, Okada M, Oneyama C.: c-Src-induced activation of ceramide metabolism impairs membrane microdomains and promotes malignant progression by facilitating the translocation of c-Src to focal adhesions. Biochem J, 458(1): 81-93, 2014.
- 2013年
- Oneyama C, Kito Y, Asai R, Ikeda J, Yoshida T, Okuzaki D, Kokuda R, Kakumoto K, Takayama K, Inoue S, Morii E, Okada M.: MiR-424/503-mediated Rictor upregulation promotes tumor progression. PLoS One, 8(11): e80300, 2013.
- 2012年
- Oneyama C, Morii E, Okuzaki D, Takahashi Y, Ikeda J, Wakabayashi N, Akamatsu H, Tsujimoto M, Nishida T, Aozasa K, Okada M.: MicroRNA-mediated upregulation of integrin-linked kinase is crucial for Src-induced tumor progression. Oncogene, 31(13), 1623-1635, 2012.
- 2011年
- Oneyama C, Ikeda J, Okuzaki D, Suzuki K, Kanou T, Shintani Y, Morii E, Okumura M, Aozasa K, Okada M.: MicroRNA-mediated downregulation of mTOR/FGFR3 controls tumor growth induced by Src-related oncogenic pathways. Oncogene, 30(32): 3489-3501, 2011.
- Kuroiwa M, Oneyama C, Nada S, Okada M.: The guanine nucleotide exchange factor Arhgef5 plays crucial roles in c-Src-induced podosome formation. J Cell Sci, 124: 1726-1738, 2011.
- Suzuki K, Oneyama C, Kimura H, Tajima S, Okada M.: Downregulation of the tumor suppressor Cbp/PAG1 is mediated by epigenetic histone modifications via the MAPK/PI3K pathway. J Biol Chem, 286(18): 15698-15706, 2011.
- Kanou T, Oneyama C, Kawahara K, Okimura A, Ohta M, Ikeda N, Shintani Y, Okumura M, Okada M.: The transmembrane adaptor Cbp/PAG1 controls the malignant potential of human non-small cell lung cancers that have c-src upregulation. Mol Cancer Res, 9(1): 103-114, 2011.
- 2010年
- Hikita T, Oneyama C, Okada M.: Purvalanol A, a CDK inhibitor, effectively suppresses Src-mediated transformation by inhibiting both CDKs and c-Src. Genes Cells, 15(10): 1051-1062, 2010.
- 2009年
- Oneyama C, Iino T, Saito K, Suzuki K, Ogawa A, Okada M.: Transforming potential of Src family kinases is limited by the cholesterol-enriched membrane microdomain. Mol Cell Biol, 29(24): 6462-6472, 2009.
- Inoue K, Sone T, Oneyama C, Nishiumi F, Kishine H, Sasaki Y, Andoh T, Okada M, Chesnut JD, Imamoto F.: A versatile nonviral vector system for tetracycline-dependent one-step conditional induction of transgene expression. Gene Therapy, 16(12): 1383-1394, 2009.
- 2008年
- Oneyama C, Hikita T, Enya K, Dobenecker MW, Saito K, Nada S, Tarakhovsky A, Okada M. : The lipid raft-anchored adaptor protein Cbp controls the oncogenic potential of c-Src. Mol Cell, 30(4): 426-436, 2008.
- Saito K, Enya K, Oneyama C, Hikita T, Okada M.: Proteomic identification of ZO-1/2 as a novel scaffold for Src/Csk regulatory circuit. Biochem Biophys Res Commun, 366(4): 969-975, 2008.
- Oneyama C, Hikita T, Nada S, Okada M.: Functional dissection of transformation by c-Src and v-Src. Genes Cells, 13(1): 1-12, 2008.
- 2007年
- Yagi R, Waguri S, Sumikawa Y, Nada S, Oneyama C, Itami S, Schmedt C, Uchiyama Y, Okada M.: C-terminal Src kinase controls development and maintenance of mouse squamous epithelia. EMBO J, 26(5): 1234-1244, 2007
- 2005年
- Sukezane T, Oneyama C, Kakumoto K, Shibutani K, Hanafusa H and Akagi T.: Human diploid fibroblasts are resistant to MEK/ERK-mediated disruption of the actin cytoskeleton and invasiveness stimulated by Ras. Oncogene, 24: 5648-5655, 2005.
- 2003年
- Oneyama C, Agatsuma T, Kanda Y, Nakano H, Sharma SV, Nakano H, Narazaki F and Tatsuta K.: Synthetic Inhibitors of Proline-Rich Ligand-Mediated Protein-Protein Interaction: Potent Analogs of UCS15A. Chemistry & Biology, 10: 443-451, 2003.
- 2002年
- Oneyama C, Nakano H and Sharma SV.: UCS15A, a novel small molecule, SH3 domain-mediated protein-protein interaction blocking drug. Oncogene, 21: 2037-2050, 2002.
- 2001年
- Sharma SV, Oneyama C, Yamashita Y, Nakano H, Sugawara K, Hamada M, Kosaka N and Tamaoki T.: UCS15A, a non-kinase inhibitor of Src signal transduction. Oncogene, 20: 2068-2079, 2001.
研究キーワード
がん、シグナル伝達、がん遺伝子産物、エクソソーム、脂質ラフト、マイクロRNA
総説
- 小根山千歳:「がんシグナルとmicroRNA」生体の科学、67(1): 81-85, 羊土社 (2016)
- 小根山千歳ら:「脂質ラフトによるSrcの空間的制御とがん進展」実験医学増刊号「知る・見る・活かす!シグナリング研究2015」33(10):82-87, 羊土社 (2015)
- Oneyama C. et al. : MicroRNAs as the fine-tuners of Src oncogenic signaling. J Biochem, 157(6): 431-438, 2015. (PMID: 25862810)
- 小根山千歳:「Srcがん形質におけるmicroRNA異常とmTORシグナル」次世代がん戦略研究update がん基盤生物学−革新的シーズ育成に向けて−, 248-253, 南山堂 (2013)
- 小根山千歳ら:「細胞膜ミクロドメイン”ラフト”を介するSrcがん化シグナル制御機構」蛋白質核酸酵素、54(3): 201-211, 共立出版 (2009)
- 小根山千歳ら:「チロシンキナーゼシグナルとがん形質発現」実験医学増刊号「シグナル伝達2008-2009」26(15): 41-48, 羊土社 (2008)
その他
一緒に研究して頂ける大学院生を募集しております。日々の一つ一つの実験が新しい発見への一歩になることを一緒に体験して、その喜びを分かち合うことができればと思います。
ご興味のある方はぜひお問い合わせください。