研究室紹介Laboratories
- Back
- Top > 研究室紹介 > がん先端診断・治療開発学(連携) > 細胞腫瘍学(愛知県がんセンター)
がん先端診断・治療開発学(連携)細胞腫瘍学講座
研究室概要
当研究室ではがんに対する免疫療法、特に体外でがん抗原を認識するT細胞を準備して患者さんに輸注することで治療を行う「養子免疫療法」を中心に研究を行っています。この治療法ではキメラ抗原受容体 (chimeric antigen receptor: CAR)導入T細胞療法が近年高い臨床効果を示したことから注目されていますが、実際に適用できるがんの種類は未だ限定的であり、さらに治療効果や安全性、汎用性を高める必要があります。これらを達成するための人工的な遺伝子・細胞システムの開発に加え、T細胞の遺伝子・エピジェネティック機構の理解に基づいた機能を高めるための遺伝子改変方法の開発を目指しています。
一方では実用面だけにとらわれず、より基礎的なT cell biology、すなわち メモリーT細胞の形成やエフェクターT細胞への分化、T細胞の機能低下(疲弊)といった現象に着目してこれらに関わる分子メカニズムの解明を目指した研究も行っております。
研究プロジェクト
養子免疫療法は、がん細胞で発現する抗原 (がん抗原)を特異的に認識する抗腫瘍T細胞を体外で準備・増殖させた上で患者に輸注して、がん細胞を特異的に攻撃させる治療法です。この治療法は当初、腫瘍組織内に浸潤するリンパ球 (tumor infiltrating lymphocyte: TIL)を増殖させて輸注する「TIL療法」として行われましたが、近年では遺伝子工学技術の発達により、末梢血由来のT細胞にがん抗原特異的なT細胞受容体 (T cell receptor: TCR)やキメラ抗原受容体 (chimeric antigen receptor: CAR)を導入することで、末梢血中にある本来雑多な集団であるT細胞をそのまま抗腫瘍T細胞に改変し、治療に用いることができるようになりました (遺伝子改変T細胞療法; 図1)。特に近年の臨床試験で、B細胞で発現する抗原CD19を標的としたCAR-T細胞療法が再発・難治性のB細胞性腫瘍(急性リンパ性白血病、悪性リンパ腫)に著効したことから急速に注目を集めました(Maude et al. N Engl J Med 2018; Locke et al. Lancet Oncol 2019; Schuster et al. N Engl J Med 2019)。これらの結果に基づき、CD19に対するCAR-T細胞療法は日本でも2019年に保険適用が承認されています。しかし他の悪性腫瘍、特に固形腫瘍に対するCAR-T細胞療法ではいずれも治療効果が弱く、またCD19に対するCAR-T細胞治療においても、例えば慢性リンパ性白血病に対しては完全寛解が得られるのは20%程度と、不十分な成績です (Li et al. J Hematol Oncol 2018; Fraietta et al. Nat Med 2018)。これとは別に、治療に伴う副作用やコストも臨床へ応用していく上で重要な課題です。当研究室ではこれら諸課題を克服するために、以下に挙げるような研究を行っています。
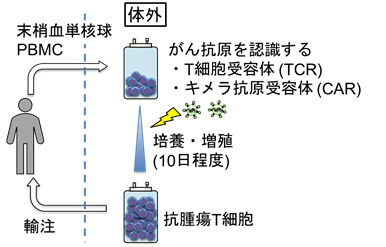
図1. 遺伝子改変T細胞療法の概要。遺伝子導入を行うことで抗腫瘍T細胞を人工的に作製する
1. T細胞の長期生存能・エフェクター効果を高めるための改変
抗腫瘍T細胞による治療効果を高めるためには、T細胞の長期生存能とエフェクター機能の両方が重要になります。長期生存能にはメモリーT細胞の分化、エフェクター機能にはT細胞の疲弊が密接に関わります (図2)。従来、T細胞による免疫療法では細胞傷害活性が重視されがちですが、実際には輸注されたT細胞が体内で長期間存続するか、という視点がより重要であることがわかってきました。米国NCIの研究グループは、メモリーT細胞の“分化階層構造”に着目して、T細胞の培養段階でいかに未分化なメモリーT細胞の割合を維持するか=エフェクター細胞への分化を抑えることが輸注後の長期生存 (persistence)、治療効果と密接に関わることを示しました (Gattinoni et al. J Clin Invest 2005; Gattinoni et al. Nat Med 2011)。メモリーT細胞の分化は通常、増殖に伴い不可逆的に進みますが、特定のシグナルを修飾することで自己複製能を高め、分化を抑制することができます。私たちはin vitroでT細胞を増殖させるための刺激シグナルを極力短くすること、及びエフェクター細胞への分化に関わるエピジェネティック因子をコントロールすることで、T細胞の未分化性を維持できることを報告しております (Kagoya et al. J Clin Invest 2016; Kagoya et al. JCI Insight 2017)。
一方、エフェクター機能低下に関わる概念がT細胞の疲弊 (exhaustion)です。これは持続的に抗原刺激を受けたT細胞の増殖能やサイトカイン分泌能などが低下する現象として定義され、抑制シグナルを担う代表的な分子であるPD-1に対する阻害抗体が、悪性黒色腫をはじめとする様々な悪性腫瘍の一部の症例で有効であることは既に確立されています。しかし疲弊を誘導する機構は本来何のために備わっているか、という視点で考えると、持続的な抗原刺激に曝露されたT細胞が生きながらえるための仕組みという捉え方もできます。実際、PD-1やその制御因子であるTOXを抑制することが必ずしもがんや慢性感染症における治療効果を改善させるとは限らないことが報告されています (Odorizzi et al. J Exp Med 2015; Scott et al. Nature 2019)。また完全な疲弊に至ったT細胞は、メモリー/エフェクターT細胞とは全く異なるエピジェネティックプロファイルを獲得しており、PD-1阻害抗体では機能が回復しないこともわかってきました (Pauken et al. Science 2016)。
これらのことから、T細胞の分化、疲弊形成のいずれもエピジェネティックプロファイル、これに伴う転写因子群の活性変化によるゲノムワイドなT細胞の性質変化が背景にあることが推測されます。私たちはT細胞の状態を個別の遺伝子、シグナル伝達経路、代謝産物レベルで明らかにし、その知見に基づいて改変を加えることにより、持続的な治療効果を高めた抗腫瘍T細胞を開発することを目指しています。近年の遺伝子工学技術の進歩により、ウイルスなどによる遺伝子導入に加えて、CRISPR/Cas9により目的遺伝子をノックアウトすることがヒトT細胞においても自在にできるようになりました。T細胞の「質」そのものの改変は、標的抗原を問わずに応用可能なものであり、あらゆるがんに対する養子免疫療法に適用することができると考えています。
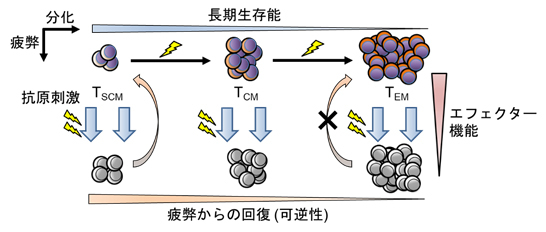
図2. 長期生存能に関わるメモリーT細胞の分化(横軸)と、エフェクター機能に関わるT細胞の疲弊(縦軸)。TSCM: stem cell-like memory T cell; TCM: central memory T cell; TEM: effector memory T cell.
2. サイトカイン放出症候群などの副作用の制御
養子免疫療法に伴う副作用は発症機序により様々なものがありますが、特に頻度が高いものとして、サイトカイン放出症候群 (cytokine release syndrome)や神経毒性といった、全身の免疫反応に伴う重篤な副作用が挙げられます (図3)。これらはIL-6やIL-1βといったサイトカインにより主に引き起こされますが、T細胞そのものがサイトカインを分泌するわけではなく、T細胞による活性化を受けた、体内のマクロファージから放出されることがわかっており、より複雑な免疫細胞間の相互作用を理解する必要があります (Norelli et al. Nat Med 2018; Giavridis et al. Nat Med 2018)。また治療効果と比例して発症リスクが高まるため、上述のT細胞機能を高めるためのT細胞改変と並行して、副作用の制御に目を向ける必要があります。私たちは現在、T細胞そのものにサイトカイン放出症候群を予防・低減する仕組みを構築するための開発を進めています。
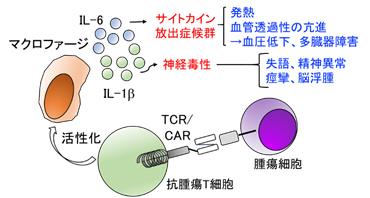
図3. 抗腫瘍T細胞によるIFN-γなどのサイトカイン分泌を介して、体内のマクロファージが活性化される。活性化マクロファージが分泌するIL-6、IL-1βなどが、サイトカイン放出症候群、神経毒性発症の原因となる。
3. 細胞療法の汎用化に向けて
CAR-T細胞療法の治療効果は輸注されるT細胞の質に大きく依存していることがわかっております。現在の養子免疫療法では、ほとんどの場合患者さん自身のT細胞を治療に用いるため、全く同じ工程で製造していても治療効果がばらつく原因になります。またそれぞれの患者さんの治療ごとに抗腫瘍T細胞を個別に準備する必要があるため、治療コストが必然的に大きくなります。根本的な解決には人工的な大量生産が可能な薬剤に細胞と同様の機能を持たせることが必要です。CARと類似したコンセプトで、抗CD3抗体と抗CD19抗体を連結して内在性T細胞に抗腫瘍効果を誘導するBiTE (Bispecific T-cell Engager)という抗体医薬が実用化されていますが、CAR-T細胞と比較すると、治療効果が弱いのが現状です。私たちの研究室ではこの問題を解決するため、T細胞の機能を再構築した汎用性のある人工物質を開発することを目指しています。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 鍋倉 宰 | 連携教授 | 細胞腫瘍学 |
研究実績
- 2020年
- Kagoya Y, Guo T, Yeung B, Saso K, Anczurowski M, Wang CH, Murata K, Sugata K, Saijo H, Matsunaga Y, Ohashi Y, Butler MO, Hirano N. Genetic ablation of HLA class I, class II, and the T-cell receptor enables allogeneic T cells to be used for adoptive T-cell therapy. Cancer Immunol Res, 2020; 8: 926-936.
- Murata K, Nakatsugawa M, Rahman MA, Nguyen LT, Millar DG, Mulder DT, Sugata K, Saijo H, Matsunaga Y, Kagoya Y, Guo T, Anczurowski M, Wang CH, Burt BD, Ly D, Saso K, Easson A, Goldstein DP, Reedijk M, Ghazarian D, Pugh TJ, Butler MO, Mak TW, Ohashi PS, Hirano N. Landscape mapping of shared antigenic epitopes and their cognate TCRs of tumor-infiltrating T lymphocytes in melanoma. Elife, 2020; 9: e53244.
- 2019年
- Anczurowski M, Sugata K, Matsunaga Y, Yamashita Y, Wang CH, Guo T, Murata K, Saijo H, Kagoya Y, Saso K, Butler MO, Hirano N. Chaperones of the class I peptide-loading complex facilitate the constitutive presentation of endogenous antigens on HLA-DP84GGPM87. J Autoimmun, 2019; 102: 114-125.
- Kagoya Y, Saijo H, Matsunaga Y, Guo T, Saso K, Anczurowski M, Wang CH, Sugata K, Murata K, Butler MO, Arrowsmith CH, Hirano N. Arginine methylation of FOXP3 is crucial for the suppressive function of regulatory T cells. J Autoimmun, 2019; 97: 10-21.
- 2018年
- Kagoya Y, Nakatsugawa M, Saso K, Guo T, Anczurowski M, Wang CH, Butler MO, Arrowsmith CH, Hirano N. DOT1L inhibition attenuates graft-versus-host disease by allogeneic T cells in adoptive immunotherapy models. Nat Commun, 2018; 9:1915.
- Kagoya Y, Tanaka S, Guo T, Anczurowski M, Wang CH, Saso K, Butler MO, Minden MD, Hirano N. A novel chimeric antigen receptor containing a JAK-STAT signaling domain mediates superior antitumor effects. Nat Med, 2018; 24:352-359.
- Guo T, Koo MY, Kagoya Y, Anczurowski M, Wang CH, Saso K, Butler MO, Hirano N. A Subset of Human Autoreactive CD1c-Restricted T Cells Preferentially Expresses TRBV4-1+ TCRs. J Immunol, 2018; 200: 500-511.
- 2017年
- Yamashita Y, Anczurowski M, Nakatsugawa M, Tanaka M, Kagoya Y, Sinha A, Chamoto K, Ochi T, Guo T, Saso K, Butler MO, Minden MD, Kislinger T, Hirano N. HLA-DP84Gly constitutively presents endogenous peptides generated by the class I antigen processing pathway. Nat Commun, 2017; 8: 15244.
- Kagoya Y, Nakatsugawa M, Ochi T, Cen Y, Guo T, Anczurowski M, Saso K, Butler MO, Hirano N. Transient stimulation expands superior antitumor T cells for adoptive therapy. JCI Insight, 2017; 2: e89580.
- Chamoto K, Guo T, Scally SW, Kagoya Y, Ancruzowski M, Wang CH, Rahman MA, Saso K, Butler MO, Chiu PP, Julien JP, Hirano N. Key residues at third CDR3β position impact structure and antigen recognition of human invariant NK TCRs. J Immunol, 2017; 198: 1056-1065.
- 2016年
- Kagoya Y, Nakatsugawa M, Yamashita Y, Ochi T, Guo T, Anczurowski M, Saso K, Butler MO, Arrowsmith CH, Hirano N. BET bromodomain inhibition enhances T cell persistence and function in adoptive immunotherapy models. J Clin Invest, 2016; 126: 3479-3494.
- Nakatsugawa M, Rahman MA, Yamashita Y, Ochi T, Wnuk P, Tanaka S, Chamoto K, Kagoya Y, Saso K, Guo T, Anczurowski M, Butler MO, Hirano N. CD4(+) and CD8(+) TCRβ repertoires possess different potentials to generate extraordinarily high-avidity T cells. Sci Rep, 2016; 6: 23821.
- 2015年
- Morita K, Masamoto Y, Kataoka K, Koya J, Kagoya Y, Yashiroda H, Sato T, Murata S, Kurokawa M. BAALC potentiates oncogenic ERK pathway through interactions with MEKK1 and KLF4. Leukemia, 2015; 29: 2248-2256.
- Iizuka H, Kagoya Y, Kataoka K, Yoshimi A, Miyauchi M, Taoka K, Kumano K, Yamamoto T, Hotta A, Arai S, Kurokawa M. Targeted gene correction of RUNX1 in induced pluripotent stem cells derived from familial platelet disorder with propensity to myeloid malignancy restores normal megakaryopoiesis. Exp Hematol, 2015; 43: 849-57.
- 2014年
- Nishikawa S, Arai S, Masamoto Y, Kagoya Y, Toya T, Watanabe-Okochi N, Kurokawa M. Thrombopoietin/MPL signaling confers growth and survival capacity to CD41-positive cells in a mouse model of Evi1 leukemia. Blood, 2014; 124: 3587-3596.
- Kagoya Y, Yoshimi A, Tsuruta-Kishino T, Arai S, Satoh T, Akira S, Kurokawa M. JAK2V617F+ myeloproliferative neoplasm clones evoke paracrine DNA damage to adjacent normal cells through secretion of lipocalin-2. Blood, 2014; 124: 2996-3006.
- Kagoya Y, Nannya Y, Nakamura F, Kurokawa M. Gene expression profiles of central nervous system lymphoma predict poor survival in patients with diffuse large B cell lymphoma. Br J Haematol. 2014; 166: 794-797.
- Sato T, Goyama S, Kataoka K, Dr. Nasu R, Tsuruta-Kishino T, Kagoya Y, Nukina A, Kumagai K, Kubota N, Nakagawa M, Arai S, Yoshimi A, Honda H, Kadowaki T, Kruokawa M. Evi1 defines leukemia-initiating capacity and tyrosine kinase inhibitor resistance in chronic myeloid leukemia. Oncogene, 2014; 33: 5028-5038.
- Ueda K, Yoshimi A, Kagoya Y, Nishikawa S, Marquez VE, Nakagawa M, Kurokawa M. Inhibition of histone methyltransferase EZH2 depletes leukemia stem cell of mixed lineage leukemia fusion leukemia through upregulation of p16. Cancer Sci, 2014; 105: 512-519.
- Nukina A, Kagoya Y, Watanabe-Okochi N, Arai S, Ueda K, Yoshimi A, Nannya Y, Kurokawa M. Single-cell gene expression analysis reveals clonal architecture of blast-phase chronic myeloid leukaemia. Br J Haematol, 2014; 165: 414-416.
- Kagoya Y, Yoshimi A, Kataoka K, Nakagawa M, Kumano K, Arai S, Kobayashi H, Saito T, Iwakura Y, Kurokawa M. Positive feedback between NF-κB and TNF-α promotes leukemia-initiating cell capacity. J Clin Invest, 2014; 124: 528-542.
研究キーワード
がん免疫療法、養子免疫療法、キメラ抗原受容体、T細胞受容体、メモリーT細胞、T細胞疲弊 、エピジェネティクス
がん免疫の基礎研究・臨床応用に興味を持つ大学院生を歓迎致します。研究に失敗はつきものですが、着実な成果を出せることにコミットします。興味のある方は是非ご相談ください。詳細については愛知県がんセンターホームページ内のサイトもご参照ください。
https://www.pref.aichi.jp/cancer-center/ri/01bumon/05shuyo_meneki/index.html