研究室紹介Laboratories
- Back
- Top > 研究室紹介 > がん先端診断・治療開発学(連携) > がん免疫ゲノム学(愛知県がんセンター)
がん先端診断・治療開発学(連携)がん免疫ゲノム学(愛知県がんセンター)
概要
近年、がん治療の中で免疫チェックポイント阻害剤等のがん免疫療法がたいへん注目されていますが、その効果はまだまだ限定的です。治療効果をさらに引きあげるためには、最も基本的ながんと免疫系の相互作用、つまりがんの免疫編集のメカニズムをさらに詳しく明らかにしていく必要があります。私たちの分野では、手術や生検を受けた患者さんの腫瘍組織、血液、そして臨床情報を使用し、がんの免疫編集のメカニズムをがん抗原(特にネオアンチゲン)とそれを認識するT細胞のレベルで明らかにしていきます。そして、得られた知見を、新たながん免疫療法に応用することを基本姿勢としてトランスレーショナルリサーチを実践しています。
研究プロジェクト
体の中に発生したがん細胞を免疫系が認識し排除できるかどうか、すなわちがんの免疫監視機構(cancer immunosurveillance)が存在するか否かの議論は約100年にわたって続いてきました。2001年、Robert Schreiberらの報告により、がんの免疫監視の存在が受け入れられるようになり、 “がんの免疫監視”をさらに発展させた “がんの免疫編集(cancer immunoediting)”という新しい仮説が生まれました。がんの免疫編集は排除相、平衡相、逃避相の三つの相からなります。がんの免疫監視・編集機構において、その根底にあるがん抗原とそれを認識するT細胞に着目し、ヒトの検体を用いてそのメカニズムを明らかにしていきます。
1.T細胞認識がん抗原の同定
T細胞に認識されるがん抗原には腫瘍に特異性の高い遺伝子変異由来の新生抗原(ネオアンチゲン)、ウイルス抗原、がん・精巣抗原、特異性の低い分化抗原、過剰発現抗原等があります。私たちは前者に着目してヒトの肺がん、頭頸部がん、子宮頸がん等の臨床検体からがん抗原の同定を試みています。
i)ネオアンチゲン
がん化の過程でがん細胞に蓄積していく遺伝子変異の中には、がんの発生・悪性化に関与するいわゆるドライバー変異と、関与しないパッセンジャー変異があります。それらの変異由来のタンパクはいずれもがん特異的なネオアンチゲンとなり免疫系の標的となります。ネオアンチゲンはそのほとんどが患者個々に発現した固有抗原であるため、これまで、その同定は非常に困難でした。次世代シーケンサー(NGS)の進歩により、個々の患者のがんにおける特異的な遺伝子変異が同定され、変異から生じるネオアンチゲン候補の網羅的な解析が可能になりました(図1)。このような進歩に伴い、患者固有のパッセンジャー変異が同定可能になり、がん免疫療法の標的を見つけるチャンスが拡大しました。私たちはこのパッセンジャー変異由来ネオアンチゲンの同定とそれを認識するT細胞の検出を試みています。また、ドライバー変異由来のネオアンチゲンに対するT細胞の検出も行います。特に肺がんにおいてはp53、K-ras等のドライバー変異を認識するT細胞に着目しています。これらは共通抗原として治療標的になり得るものです。
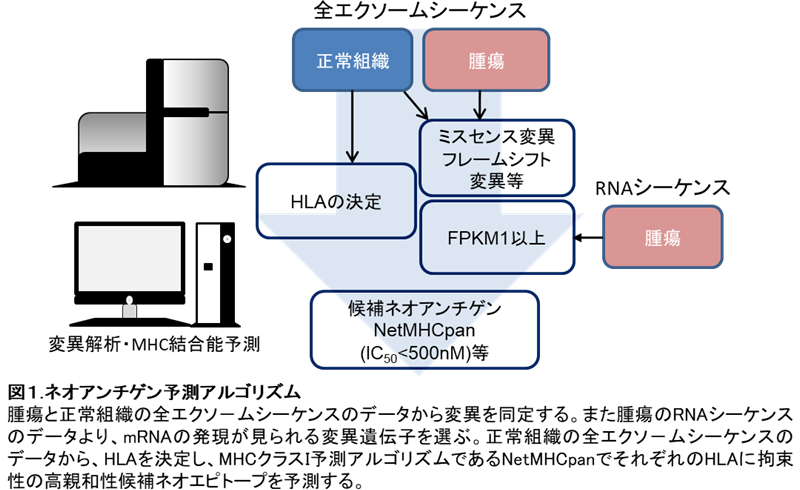
ii)がん精巣抗原
正常組織では精巣および胎盤のみに発現し、多様な癌種の腫瘍組織で発現が認められ、患者間で発現が共有される共通抗原です。精巣にはHLAクラス Iの発現がなくCTLの標的として認識されないため、実質的には腫瘍特異的に発現する抗原と考えられます。肺がんにおいてはNY-ESO-1, XAGE1, KK-LC-1等に着目して研究をすすめています。
iii)ウイルス抗原
ウイルスの中には発癌に関わるものがあり、約20%の癌の発生に寄与しているとされ、ウイルス由来の遺伝子産物が腫瘍抗原ペプチドとしてはたらくことがあります。ヒトパピローマウィルス (HPV)は子宮頸がんや頭頸部がん(中咽頭がん)の発生原因となり、HPVウイルスタンパク (E6, E7)が発現し、CTLの標的抗原となり得ます。中咽頭がん、子宮頸がんの臨床検体を使用して、E6、E7等に対するT細胞の検出を試みています。
2.抗原特異的T細胞受容体の高親和性化の検討
がん組織に浸潤するT細胞(TIL)の中で、高親和性のT細胞はAICD (activation-induced cell death)等によりすでに消失している可能性があります。また、T細胞ががん抗原に暴露され続けていることによる疲弊や不応状態になっている可能性があり、TILからの高親和性T細胞を単離することは困難かもしれません。そこで、1で同定された、がん抗原特異的CTLのT細胞受容体(TCR)を治療で効果が期待できるレベルの高親和性型TCRに改変することを試みています(図2)。これは、将来のTCR導入T細胞療法に向けた取り組みで、特に上述のドライバー変異由来抗原、HPV由来抗原のT細胞について検討を行っています。腫瘍特異性が高く、なおかつ共通抗原性をもつ抗原に対する高親和性TCRを取得することで、off-the-shelf型のTCR導入T細胞療法の開発につながると考えています。
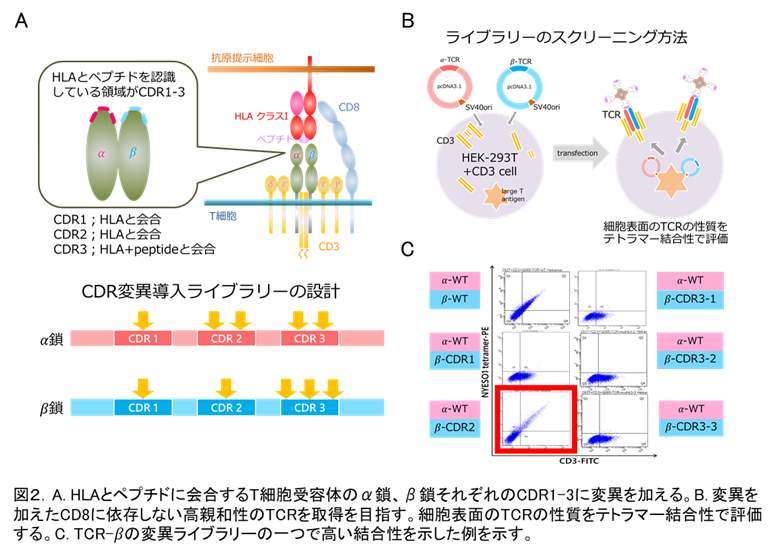
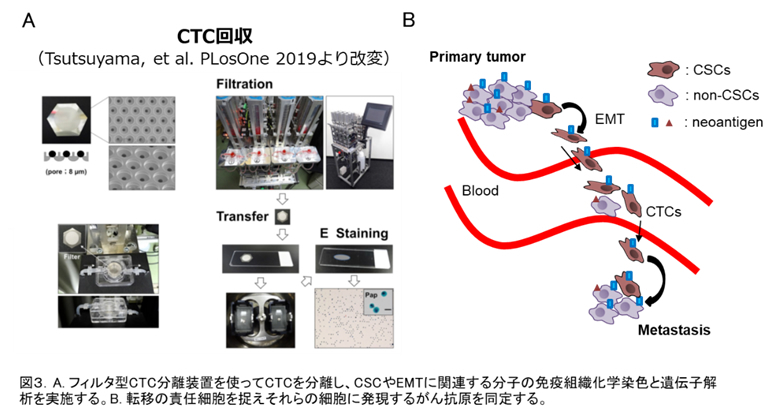
3.肺がん循環腫瘍細胞の同定と治療標的としての検討
がんの死因の多くは原発巣から他臓器への転移によるものです。がんが転移する機序として血中循環腫瘍細胞(Circulating Tumor Cell; CTC)の関与が考えられていますが、肺がんCTCの臨床病理学的意義は十分に解明されていません。CTCは、epithelial-to-mesenchymal transition (EMT)を起こした転移能をもつcancer stem cell(CSC)を含むと考えられています(図3)。そこで、肺がん患者の肺静脈および末梢血から、フィルタ型CTC分離装置を使ってCTCを分離し、CSCやEMTに関連する分子の免疫組織化学染色と遺伝子解析を実施します。肺がん転移の病態解明に加え、がんワクチンの治療標的を見出すことが目的です。転移の責任細胞を捉えそれらの細胞に発現するがん抗原を同定することで、再発予防ワクチン開発に繋がる可能性があります。肺がんにおいて、術後の遠隔転移は予後決定因子であることから、術後の転移を予防できるがんワクチンが開発できれば、肺がん治療の治療成績の向上に貢献できます。
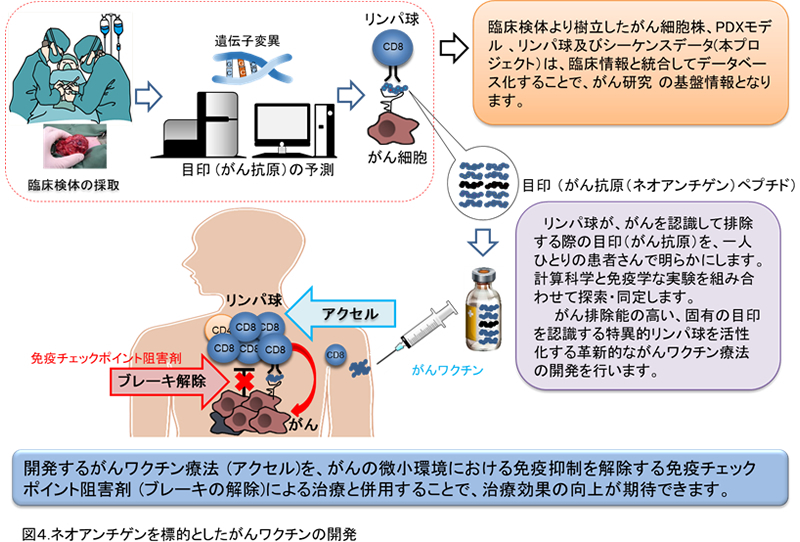
4.ネオアンチゲンを標的としたがん免疫療法の開発
2017年、ネオアンチゲンを標的としたペプチドおよびRNAワクチン治療の臨床試験の結果が報告されました。最大20個のネオアンチゲンを標的としており、抗腫瘍効果とともに、転移が抑えられたことが報告されています。これは、ヘテロジニアスな腫瘍に対して、複数の抗原を標的とすることで免疫選択による腫瘍の逃避を防いだ結果と考えられます。このうち、ある症例ではワクチンのみでは再発をきたしたが、その後、免疫チェックポイント阻害剤治療を行うことで、病勢のコントロールが得られたことが示されています。さらに、ワクチンとして用いたネオアンチゲンに対する特異的T細胞の反応が増強していたことも確認されました。このことから、ワクチンであらかじめネオアンチゲン特異的T細胞を誘導し、その上でチェックポイント阻害剤を投与することで、臨床効果が得られたと考えられます。
このような治療を行う上で、あらかじめ効果が認められそうな患者を予測することも重要となってきます。治療前後の患者の免疫状態と臨床効果のデータを蓄積することにより、患者個人に対する最適な治療法を選択できるようになってくると考えらます。今後、これらのがんワクチンの臨床試験が土台となって、さらにネオアンチゲンを標的とした免疫療法は発展していくものと思われます。これからの課題は、ワクチンを行う症例選択、前述のネオアンチゲン同定のアルゴリズムと、ネオアンチゲンを検出するアッセイ系の改良です。私たちは、適切な患者さんに、適切ながんワクチン療法を実施できるように体制を整備し、がんの治療効果の向上に貢献していきます(図4)。
研究実績
- 2019年
- Ohue Y, Kurose K, Karasaki T, Isobe M, Yamaoka T, Futami J, Irei I, Masuda T, Fukuda M, Kinoshita A, Matsushita H, Shimizu K, Nakata M, Hattori N, Yamaguchi H, Fukuda M, Nozawa R, Kakimi K, Oka M. Serum Antibody against NY-ESO-1 and XAGE1 Antigens Potentially Predicts Clinical Responses to Anti-PD-1 Therapy in Non-Small-Cell Lung Cancer. J Thorac Oncol., 2019
- Takahashi Y, Kuroda H, Oya Y, Matsutani N, Matsushita H, Kawamura M. Challenges for real-time intraoperative diagnosis of high risk histology in lung adenocarcinoma: A necessity for sublobar resection. Thorac Cancer, 2019;10(8):1663-1668.
- Nejo T, Matsushita H, Karasaki T, Nomura M, Saito K, Tanaka S, Takayanagi S, Hana T, Takahashi S, Kitagawa Y, Koike T, Kobayashi Y, Nagae G, Yamamoto S, Ueda H, Tatsuno K, Narita Y, Nagane M, Ueki K, Nishikawa R, Aburatani H, Mukasa A, Saito N, Kakimi K. Reduced Neoantigen Expression Revealed by Longitudinal Multiomics as a Possible Immune Evasion Mechanism in Glioma. Cancer Immunol Res., 2019; 7(7):1148-1161.
- 2018年
- Imai Y, Hasegawa K, Matsushita H, Fujieda N, Sato S, Miyagi E, Kakimi K, Fujiwara K. Expression of multiple immune checkpoint molecules on T cells in malignant ascites from epithelial ovarian carcinoma. Oncol Lett., 2018; 15(5):6457-6468.
- Yamamoto M, Nomura S, Hosoi A, Nagaoka K, Iino T, Yasuda T, Saito T, Matsushita H, Uchida E, Seto Y, Goldenring JR, Kakimi K, Tatematsu M, Tsukamoto T. Established gastric cancer cell lines transplantable into C57BL/6 mice demonstrate FGFR4 promotion of tumor growth. Cancer Sci., 2018; 109(5):1480-1492.
- Nagaoka K, Hosoi A, Iino T, Morishita Y, Matsushita H, Kakimi K. Dendritic cell vaccine induces antigen-specific CD8+ T cells that are metabolically distinct from those of peptide vaccine and is well-combined with PD-1 checkpoint blockade. Oncoimmunology, 2017; 7(3): e1395124.
- Hosoi A, Takeda K, Nagaoka K, Iino T, Matsushita H, Ueha S, Aoki S, Matsushima K, Kubo M, Morikawa T, Kitaura K, Suzuki R, Kakimi K. Increased diversity with reduced \"diversity evenness\" of tumor infiltrating T-cells for the successful cancer immunotherapy. Sci Rep., 2018; 8(1):1058.
- Hoshikawa M, Aoki T, Matsushita H, Karasaki T, Hosoi A, Odaira K, Fujieda N, Kobayashi Y, Kambara K, Ohara O, Arita J, Hasegawa K, Kakimi K, Kokudo N.NK cell and IFN signatures are positive prognostic biomarkers for resectable pancreatic cancer. Biochem Biophys Res Commun., 2018; 495(2):2058-2065.
- 2017年
- Matsushita H, Hasegawa K, Oda K, Yamamoto S, Nishijima A, Imai Y, Asada K, Ikeda Y, Karasaki T, Fujiwara K, Aburatani H, Kakimi K. The frequency of neoantigens per somatic mutation rather than overall mutational load or number of predicted neoantigens per se is a prognostic factor in ovarian clear cell carcinoma. Oncoimmunology, 2017; 16;6(8):e1338996.
- Aoki T, Matsushita H, Hoshikawa M, Hasegawa K, Kokudo N, Kakimi K. Adjuvant combination therapy with gemcitabine and autologous γδ T-cell transfer in patients with curatively resected pancreatic cancer. Cytotherapy, 2017; 19(4):473-485.
- Karasaki T, Nagayama K, Kuwano H, Nitadori JI, Sato M, Anraku M, Hosoi A, Matsushita H, Morishita Y, Kashiwabara K, Takazawa M, Ohara O, Kakimi K, Nakajima J. An Immunogram for the Cancer-Immunity Cycle: Towards Personalized Immunotherapy of Lung Cancer. J Thorac Oncol., 2017;12(5):791-803.
- Karasaki T, Nagayama K, Kuwano H, Nitadori JI, Sato M, Anraku M, Hosoi A, Matsushita H, Takazawa M, Ohara O, Nakajima J, Kakimi K. Prediction and prioritization of neoantigens: integration of RNA sequencing data with whole-exome sequencing. Cancer Sci., 2017;108(2):170-177.
- 2016年
- Odaira K, Kimura SN, Fujieda N, Kobayashi Y, Kambara K, Takahashi T, Izumi T, Matsushita H, Kakimi K. CD27(-)CD45(+) γδ T cells can be divided into two populations, CD27(-)CD45(int) and CD27(-)CD45(hi) with little proliferation potential. Biochem Biophys Res Commun., 2016;478(3):1298-303.
- Matsushita H, Sato Y, Karasaki T, Nakagawa T, Kume H, Ogawa S, Homma Y, Kakimi K. Neoantigen load, antigen presentation machinery, and immune signatures determine prognosis in clear cell renal cell carcinoma. Cancer Immunol Res., 2016; 4(5): 463-71.
- 2015年
- Karasaki T, Nagayama K, Kawashima M, Hiyama N, Murayama T, Kuwano H, Nitadori JI, Anraku M, Sato M, Miyai M, Hosoi A, Matsushita H, Kikugawa S, Matoba R, Ohara O, Kakimi K, Nakajima J. Identification of Individual Cancer-Specific Somatic Mutations for Neoantigen-Based Immunotherapy of Lung Cancer. J Thorac Oncol., 2015;11(3):324-333.
- Makise N, Morikawa T, Nakagawa T, Ichimura T, Kawai T, Matsushita H, Kakimi K, Kume H, Homma Y, Fukayama M. MAGE-A expression, immune microenvironment, and prognosis in upper urinary tract carcinoma. Hum Pathol., 2016; 50:62-9.
- Matsushita H, Hosoi A, Ueha S, Abe J, Fujieda N, Tomura M, Maekawa R, Matsushima K, Ohara O, Kakimi K. Cytotoxic T lymphocytes block tumor growth both by lytic activity and IFNγ-dependent cell-cycle arrest. Cancer Immunol Res., 2015;3(1):26-36.
- Futami J, Nonomura H, Kido M, Niidoi N, Fujieda N, Hosoi A, Fujita K, Mandai K, Atago Y, Kinoshita R, Honjo T, Matsushita H, Uenaka A, Nakayama E, Kakimi K. Sensitive Multiplexed Quantitative Analysis of Autoantibodies to Cancer Antigens with Chemically S-Cationized Full-Length and Water-Soluble Denatured Proteins. Bioconjug Chem., 2015; 26(10):2076-84.
- Miyai M, Eikawa S, Hosoi A, Iino T, Matsushita H, Isobe M, Uenaka A, Udono H, Nakajima J, Nakayama E, Kakimi K. Detection and Tracking of NY-ESO-1-Specific CD8+ T Cells by High-Throughput T Cell Receptor β (TCRB) Gene Rearrangements Sequencing in a Peptide-Vaccinated Patient. PLoS One, 2015;10(8):e0136086.
- Hirano K, Hosoi A, Matsushita H, Iino T, Ueha S, Matsushima K, Seto Y, Kakimi K. The nitric oxide radical scavenger carboxy-PTIO reduces the immunosuppressive activity of myeloid-derived suppressor cells and potentiates the antitumor activity of adoptive cytotoxic T lymphocyte immunotherapy. Oncoimmunology, 2015; 4(8).
- 2014年
- Futami J, Fujiyama H, Kinoshita R, Nonomura H, Honjo T, Tada H, Matsushita H, Abe Y, Kakimi K. Denatured Mammalian protein mixtures exhibit unusually high solubility in nucleic Acid-free pure water. PLoS One, 2014;9(11):e113295.
- Yamada D, Matsushita H, Azuma T, Nakagawa T, Nagata M, Yamada Y, Suzuki M, Fujimura T, Fukuhara H, Kume H, Homma Y, Kakimi K. Granulocyte macrophage colony-stimulating factor as a predictor of the response of metastatic renal cell carcinoma to tyrosine kinase inhibitor therapy. Mol Clin Oncol., 2014;2(6):1023-1027.
- Matsushita H, Enomoto H, Kume H, Nakagawa T, Fukuhara H, Suzuki M, Fujimura T, Homma Y and Kakimi K. A pilot study of autologous tumor lysate-loaded dendritic cell vaccination combined with sunitinib for metastatic renal cell carcinoma. Journal for Immunotherapy of Cancer, 2014; 2:30.
- Kawai T, Enomoto Y, Morikawa T, Matsushita H, Kume H, Fukayama M, Yamaguchi H, Kakimi K, Homma Y. High expression of heat shock protein 105 predicts a favorable prognosis for patients with urinary bladder cancer treated with radical cystectomy. Mol Clin Oncol., 2014; 2(1):38-42.
- Wada I, Matsushita H, Noji S, Mori K, Yamashita H, Nomura S, Shimizu N, Seto Y, Kakimi K. Intraperitoneal injection of in vitro expanded Vγ9Vδ2 T cells together with zoledronate for the treatment of malignant ascites due to gastric cancer. Cancer Med., 2014;3(2):362-75.
- Wada H, Isobe M, Kakimi K, Mizote Y, Eikawa S, Sato E, Takigawa N, Kiura K, Tsuji K, Iwatsuki K, Yamasaki M, Miyata H, Matsushita H, Udono H, Seto Y, Yamada K, Nishikawa H, Pan L, Venhaus R, Oka M, Doki Y, Nakayama E.Vaccination with NY-ESO-1 overlapping peptides mixed with Picibanil OK-432 and montanide ISA-51 in patients with cancers expressing the NY-ESO-1 antigen. J Immunother., 2014 ;37(2):84-92.
- Ichimura T, Morikawa T, Kawai T, Nakagawa T, Matsushita H, Kakimi K, Kume H, Ishikawa S, Homma Y, Fukayama M. Prognostic significance of CD204-positive macrophages in upper urinary tract cancer. Ann Surg Oncol., 2014;21(6):2105-12.
- Hosoi A, Matsushita H, Shimizu K, Fujii S, Ueha S, Abe J, Kurachi M, Maekawa R, Matsushima K, Kakimi K. Adoptive cytotoxic T lymphocyte therapy triggers a counter-regulatory immunosuppressive mechanism via recruitment of myeloid-derived suppressor cells. Int J Cancer, 2014;134(8):1810-22.
- 2013年
- Izumi T, Kondo M, Takahashi T, Fujieda N, Kondo A, Tamura N, Murakawa T, Nakajima J, Matsushita H, Kakimi K. Ex vivo characterization of γδ T-cell repertoire in patients after adoptive transfer of Vγ9Vδ2 T cells expressing the interleukin-2 receptor β-chain and the common γ-chain. Cytotherapy, 2013;15(4):481-91.
- Shimizu K, Mizuno T, Shinga J, Asakura M, Kakimi K, Ishii Y, Masuda K, Maeda T, Sugahara H, Sato Y, Matsushita H, Nishida K, Hanada K, Dorrie J, Schaft N, Bickham K, Koike H, Ando T, Nagai R, Fujii S. Vaccination with antigen-transfected, NKT cell ligand-loaded, human cells elicits robust in situ immune responses by dendritic cells. Cancer Res., 2013;73(1):62-73.
- 2012年
- Matsushita H, Vesely MD, Koboldt DC, Rickert CG, Uppaluri R, Magrini VJ, Arthur CD, White JM, Chen YS, Shea LK, Hundal J, Wendl MC, Demeter R, Wylie T, Allison JP, Smyth MJ, Old LJ, Mardis ER, Schreiber RD. Cancer exome analysis reveals a T-cell-dependent mechanism of cancer immunoediting. Nature, 2012; 482(7385): 400-4.
- Noji S, Hosoi A, Takeda K, Matsushita H, Morishita Y, Seto Y, Kakimi K. Targeting spatiotemporal expression of CD137 on tumor-infiltrating cytotoxic T lymphocytes as a novel strategy for agonistic antibody therapy. J Immunother., 2012;35(6):460-72.
- 2011年
- Kondo M, Izumi T, Fujieda N, Kondo A, Morishita T, Matsushita H, Kakimi K. Expansion of Human Peripheral Blood γδ T Cells using Zoledronate. J Vis Exp., 2011; (55) pii:3182.
- Diamond MS, Kinder M, Matsushita H, Mashayekhi M, Dunn GP, Archambault JM, Lee H, Arthur CD, White JM, Kalinke U, Murphy KM, Schreiber RD. Type I interferon is selectively required by dendritic cells for immune rejection of tumors. J Exp Med., 2011; 208(10):1989-2003.
- Sakamoto M, Nakajima J, Murakawa T, Fukami T, Yoshida Y, Murayama T, Takamoto S, Matsushita H, Kakimi K. Adoptive immunotherapy for advanced non-small cell lung cancer using zoledronate-expanded γδTcells: a phase I clinical study. J Immunother., 2011; 34(2):202-11.
- 2008年
- Hildner K, Edelson BT, Purtha WE, Diamond M, Matsushita H, Kohyama M, Calderon B, Schraml BU, Unanue ER, Diamond MS, Schreiber RD, Murphy TL, and Murphy KM. Batf3 deficiency reveals a critical role for CD8alpha+ dendritic cells in cytotoxic T cell immunity. Science, 2008; 322: 1097-1100.
- Ishida T, Obata Y, Ohara N, Matsushita H, Sato S, Uenaka A, Saika T, Miyamura T, Chayama K, Nakamura Y, Wada H, Yamashita T, Morishima T, Old LJ, Nakayama E .Identification of the HERV-K gag antigen in prostate cancer by SEREX using autologous patient serum and its immunogenicity. Cancer Immun., 2008; 8:15.
研究キーワード
がん免疫編集、ネオアンチゲン、ウイルス抗原、がん・精巣抗原、循環腫瘍細胞、がんワクチン、T細胞受容体高親和性化
大学院生募集
最新のシーケンサー技術を活用して、患者一人ひとりから、がん特異的ながん抗原を同定し、そのがん抗原に対するT細胞のがん排除機能を増強するがんワクチン療法の開発を目指しています。本研究を、がん治療経験が豊富な愛知県がんセンターのがん専門医と、コンピューターサイエンス及びがんの基礎研究をリードする研究者とともに共同で進めています。詳しくは愛知県がんセンターホームページ内の下記サイトへどうぞ:
https://www.pref.aichi.jp/cancer-center/ri/01bumon/08hatsugan_seigyo/index.html
私たちと一緒に、新しいがんの免疫療法の開発を粘り強く推進してくれる熱意のある大学院生を募集しています。