生物化学分子生物学(生化学第一)
概要
当研究室では、生命現象の根幹である遺伝情報の継承および発現制御機構の解明から、がんにおける治療標的同定と治療戦略開発に至るまで統合的な研究を行っています。こちらのページでは主要な研究テーマである
1. 難治性がんにおける治療標的の同定と治療戦略の開発
2. プロリン異性化がもたらす生命現象の理解
3. カルシウムシグナルの破綻がもたらす細胞増殖異常とがん
についてご紹介いたします。
研究プロジェクト
1. 難治性がんにおける治療標的の同定と治療戦略の開発
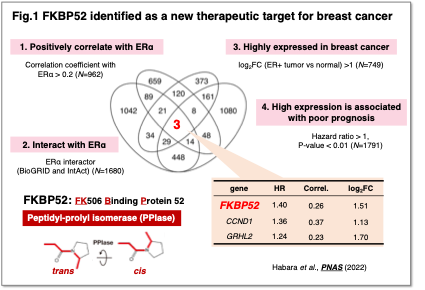
私たちは、がんの治療抵抗性や進行に関与する分子メカニズムを明らかにし、新たな治療標的の同定と治療法の開発を目指しています。その一例として、ERα陽性乳がんにおける治療標的因子の探索を行いました。乳がんは日本人女性で最も多い悪性腫瘍であり、特にERα(エストロゲン受容体α)陽性乳がんは全体の約70%を占めます。内分泌療法が奏効する一方で、治療抵抗性が課題となっています。そこで私たちは、ERαと機能的に関連し、予後とも相関する分子を解析し、FKBP52(FK506 Binding Protein 52)を同定しました (Fig.1)(Habara et al.,PNAS, 2022)。FKBP52の抑制によりERαの分解が促進され、がん細胞の増殖が抑制されること、さらに治療抵抗性乳がんにおいても有効であることを明らかにしました。
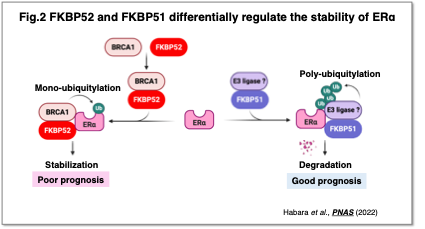
また、FKBP52はBRCA1を介してERαの安定化に関与する一方、FKBP52と相同性の高いFKBP51は逆にERαの分解を促進し、腫瘍抑制的に機能することも見出しました (Fig.2)。
このように、がん細胞の増殖や治療抵抗性に関わる因子を網羅的に解析し、治療標的の機能を分子レベルで明らかにすることで、がんの個別化医療や新規治療法の開発へとつなげることを目指しています。
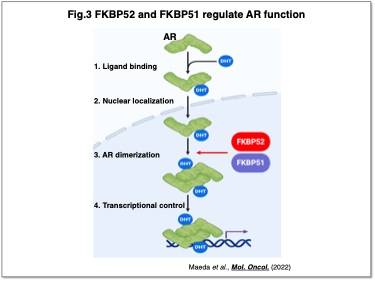
さらに、前立腺がんにおいても、アンドロゲン受容体(AR)とFKBPファミリーの関与を解明し、FKBP51およびFKBP52が(1)ARの活性化に重要な二量体形成、(2)ARの標的遺伝子発現に必要であることがわかりました(Fig.3)(Maeda et al., Mol. Oncol., 2021)。去勢抵抗性前立腺がん細胞に対してもこれらのFKBPの阻害が有効であることが示され、治療効果が期待されます。
現在は、さまざまながん種において治療抵抗性や悪性化に関わる分子機構の解明を進めており、得られた知見をもとに分子標的治療の開発へと展開しています。
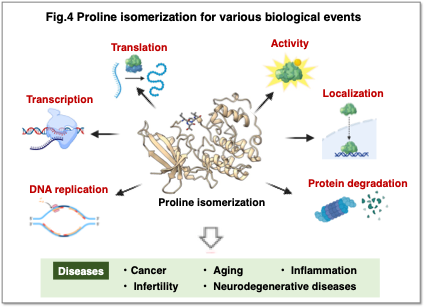
2. プロリン異性化がもたらす生命現象の理解
プロリン異性化酵素は複製、転写、翻訳、活性、局在、分解といった様々な生理機能に関与している可能性が示されています(Fig.4)。その異常はがん、老化、炎症、不妊、神経変性疾患などの病態と関連していることがこのように多数知られており、新たな研究が進みつつあります。しかしプロリンの異性化が、実際にどの程度立体構造に影響を与えるのか、どのような機序で生理機能に影響を与えるのかを示した研究は限られています。今までの生物学では、リン酸化、ユビキチン化などを中心としたタンパク質の化学修飾が注目され研究されてきましたが、それらの化学修飾に加えて、プロリン異性化による立体構造変化が複雑な生命現象を司っている可能性が考えられます。この点については、依然としてその生理的意義や分子メカニズムに不明な点が多く、プロリン異性化が担う構造制御および機能制御機構の全貌は十分に解明されていません。現在我々は、プロリン異性化がタンパク質の立体構造に与える影響およびそれに伴う生理機能の変化を、構造生物学的・細胞生物学的アプローチを用いて体系的に解析しています。本研究を通じて、プロリン異性化の生物学的意義を明らかにし、がんや神経変性疾患などの病態メカニズムの理解および新規治療標的の探索へと発展させることを目指しています。
3. カルシウムシグナルの破綻がもたらす細胞増殖異常とがん
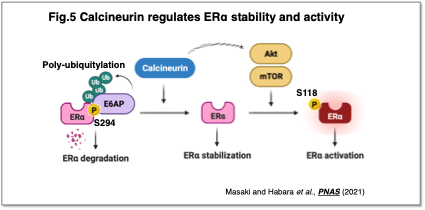
カルシウム依存性脱リン酸化酵素カルシニューリンは、免疫抑制剤FK506の標的として知られていますが、私たちはこの酵素が再発性乳がんにおける新たな制御因子であることを明らかにしました (Masaki and Habara et al., PNAS, 2021)(Fig.5)。カルシニューリンはエストロゲン受容体(ERα)の脱リン酸化を介してその分解を抑制し、さらにmTOR経路を通じて活性化を促進することで、ERαの機能を増強し、がん細胞の再発と予後不良に関与することが示されました。
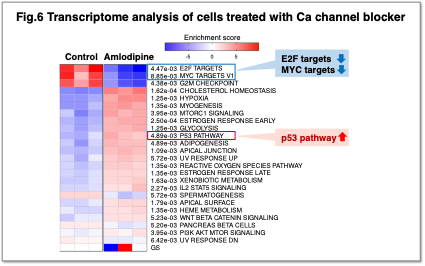
細胞内カルシウム(Ca²⁺)は、遺伝子発現、細胞周期、アポトーシスなどの多様な生命現象に関与する重要なセカンドメッセンジャーです。がん細胞ではCa²⁺恒常性の破綻が悪性化や転移に関わると考えられています。私たちはCa²⁺チャネル阻害剤Amlodipineを用いた遺伝子発現解析により、Ca²⁺濃度の低下が細胞周期を促進するc-MycやE2F標的遺伝子の発現を抑制し、p53標的遺伝子を活性化することを見出しました (Fig.6)。
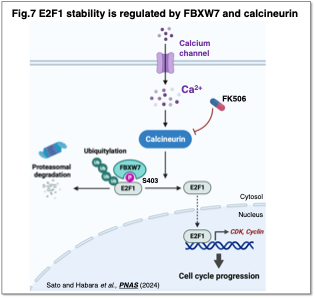
細胞内Ca²⁺濃度によるE2F1の制御については、ユビキチンリガーゼFBXW7がE2F1を分解する一方で、CalcineurinによるE2F1の脱リン酸化がこの結合を阻害し、E2F1の安定化を促進することを発見しました (Sato and Habara et al., PNAS, 2024) (Fig.7)。
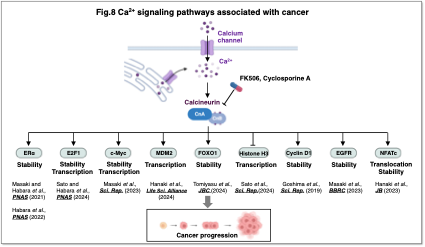
Calcineurinはc-Mycの安定化や、NFATcの核内移行を通じたMDM2転写の活性化にも関与することを明らかにしました (Masaki et al., Sci. Rep., 2023;Hanaki et al., Life Sci. Alliance, 2024)。このことは、カルシウムシグナルやカルシニューリンががんの治療標的になり得ることを示しています。
カルシウムシグナルの異常はがんの発生・進展と密接に関係しており、私たちはその分子基盤の解明を進めています。これまでに複数のカルシニューリン標的分子を同定しており (Fig.8)、現在カルシウムシグナルを標的とした新たながん治療法の確立を目指して研究を展開しています。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 島田 緑 | 教授 | 生物化学講座 分子生物学 |
| 坪田 庄真 | 助教 | 生物化学講座 分子生物学 |
| 榊原 正太郎 | 助教 | 生物化学講座 分子生物学 |
| 杉山 成明 | 助教 | 生物化学講座 分子生物学 |
研究実績
- 2025年
- Haba H, Tsubota S, Shimada M, Calcineurin in cancer signaling networks. Nagoya J Med Sci. 87, 182-195, 2025.
- 2024年
- Sato Y, Habara M, Hanaki S, Masaki T, Tomiyasu H, Miki Y, Sakurai M, Morimoto M, Kobayashi D, Miyamoto T, Shimada M*: Calcineurin-mediated dephosphorylation stabilizes E2F1 protein by suppressing binding of the FBXW7 ubiquitin ligase subunit. PNAS, 2024 Oct 8;121(41):e2414618121.
- Sato Y, Habara M, Hanaki S, Sharif J, Tomiyasu H, Miki Y, Shimada M*: Calcineurin/NFATc1 pathway represses cellular cytotoxicity by modulating histone H3 expression. Sci Rep., 14, 14732, 2024.
- Hanaki S, Habara M, Tomiyasu H, Sato Y, Miki Y, Masaki T, Shibutani S, Shimada M*: NFAT activation by FKBP52 promotes cancer cell proliferation by suppressing p53. Life Sci Alliance., 7, e202302426, 2024.
- Tomiyasu H, Habara M, Hanaki S, Sato Y, Miki Y, Shimada M*: FOXO1 promotes cancer cell growth through MDM2-mediated p53 degradation. J. Biol. Chem.,300, 107209, 2024.
- Hanaki S, Habara M, Sato Y, Tomiyasu H, Miki Y, Shibutani S, Shimada M*: Dephosphorylation of NFAT by Calcineurin inhibits. Skp2-mediated degradation. J Biochem., 175, 235-244, 2024.
- 2023年
- Masaki T, Habara M, Hanaki S, Sato Y, Tomiyasu H, Miki Y, Shimada M*: Calcineurin-mediated dephosphorylation enhances the stability and transactivation of c-Myc. Sci. Rep., 13, 13116, 2023.
- Masaki T, Habara M, Shibutani S, Hanaki S, Sato Y, Tomiyasu H, Shimada M*: Dephosphorylation of the EGFR protein by calcineurin at serine 1046/1047 enhances its stability. Biochem. Biophys. Res. Commun., 641, 84-92, 2023.
- Suzuki, Y., Kadomatsu, K., Sakamoto, K. Towards the in vivo identification of protein-protein interactions. J Biochem. mvad013 (2023).
- Jun Ouchida, Tomoya Ozaki, Naoki Segi, Yuji Suzuki, Shiro Imagama, Kenji Kadomatsu, Kazuma Sakamoto. Glypican-2 defines age-dependent axonal response to chondroitin sulfate. Exp Neurol. 2023 May 15.doi: 10.1016/j.expneurol.2023.114444.
- 2022年
- Habara M, Sato Y, Goshima T, Sakurai M, Imai H, Shimizu H, Katayama Y, Hanaki S, Masaki T, Morimoto M, Nishikawa S, Toyama T, Shimada M*: FKBP52 and FKBP51 Differentially Regulate the Stability of Estrogen Receptor in Breast Cancer. PNAS, 119, e2110256119, 2022.
- Segi, N., Ozaki, T., Suzuki, Y., Ouchida, J., Imagama, S, Kadomatsu, K., Sakamoto, K. Close association of polarization and LC3, a marker of autophagy, in axon determination in mouse hippocampal neurons. Exp Neurol. 114112 (2022). doi: 10.1016/j.expneurol.2022.114112. Online ahead of print.
- 2021年
- Masaki T, Habara M, Sato Y, Goshima T, Maeda K, Hanaki S, Shimada M*: Calcineurin regulates the stability and activity of estrogen receptor α. PNAS, 118, e2114258118, 2021.
- Maeda K, Habara M, Kawaguchi M, Matsumoto H, Hanaki S, Masaki T, Sato Y, Matsuyama H, Kunieda K, Nakagawa H, Shimada M*: FKBP51 and FKBP52 regulate androgen receptor dimerization and proliferation in prostate cancer cells. Mol Oncol., 16, 940-956, 2021. [Link]
- Hanaki S, Habara M, Masaki T, Maeda K, Sato Y, Nakanishi M, Shimada M*: PP1 regulatory subunit NIPP1 regulates transcription of E2F1 target genes following DNA damage. Cancer Sci., 112, 2739-2752, 2021.
- Machino M, Gong Y, Ozaki T, Suzuki Y, Watanabe E, Imagama S, Kadomatsu K, Sakamoto K. Dermatan sulfate is an activating ligand of anaplastic lymphoma kinase. J Biochem. 2021 Dec 28;170(5):631-637. doi: 10.1093/jb/mvab085. Online ahead of print. PMID: 34270745
- Gong Y, Abudureyimu S, Kadomatsu K, Sakamoto K. Identification of PTPRσ-interacting proteins by proximity-labelling assay. J Biochem. 2021 Mar 5;169(2):187-194. doi: 10.1093/jb/mvaa141.PMID: 33313879
- Ito S, Ozaki T, Morozumi M, Imagama S, Kadomatsu K, Sakamoto K. Enoxaparin promotes functional recovery after spinal cord injury by antagonizing PTPRσ. Exp. Neurol. 2021 Jun;340:113679. doi: 10.1016/j.expneurol.2021.113679. Epub 2021 Mar 1.
- Sakamoto K, Ozaki T, Suzuki Y, Kadomatsu K. Type IIa RPTPs and Glycans: Roles in Axon Regeneration and Synaptogenesis. Int J Mol Sci. 2021 May 24;22(11):5524. doi:10.3390/ijms22115524.PMID: 34073798
- Sakamoto K, Ozaki T, Kadomatsu K. Axonal Regeneration by Glycosaminoglycan. Front Cell Dev. Biol., 2021 Jun 16;9:702179. doi: 10.3389/fcell.2021.702179. eCollection 2021.
- Komata Y, Tsubota S, Sakamoto K, Ikematsu S, Kadomatsu K. Screening of novel Midkine binding protein by BioID2-based proximity labeling. Nagoya J Med
- 2020年
- Mikawa T, Shibata E, Shimada M, Ito K, Ito T, Kanda H, Takubo K, Lleonart ME, Inagaki N, Yokode M, Kondoh H*: Phosphoglycerate mutase cooperates with Chk1 kinase to regulate glycolysis. iScience, 23, 101306, 2020.
- Yamashita K, Kiyonari S, Tsubota S, Kishida S, Sakai R, Kadomatsu K. Thymidylate synthase inhibitor raltitrexed can induce high levels of DNA damage in MYCN-amplified neuroblastoma cells. Cancer Sci. 2020
- 2019年
- Nariai Y, Kamino H, Obayashi E, Kato H, Sakashita G, Sugiura T, Migita K, Koga T, Kawakami A, Sakamoto K, Kadomatsu K, Nakakido M, Tsumoto K, Urano T. Generation and characterization of antagonistic anti-human interleukin (IL)-18 monoclonal antibodies with high affinity: Two types of monoclonal antibodies against full-length IL-18 and the neoepitope of inflammatory caspase-cleaved active IL-18. Arch. Biochem. Biophys. 2019 Jan 4;663:71-82.
- Goshima T, Habara M, Maeda K, Hanaki S, Kato Y, Shimada M*: Calcineurin regulates cyclin D1 stability through dephosphorylation at T286. Sci. Rep., 9, 12779, 2019.
- Nishimura K, Johmura Y, Deguchi K, Jiang Z, Uchida KSK, Suzuki N, Shimada M, Chiba Y, Hirota T, Yoshimura SH, Kono K, Nakanishi M*: Cdk1-mediated DIAPH1 phosphorylation maintains metaphase cortical tension and inactivates the spindle assembly checkpoint at anaphase. Nat. Commun., 10, 981, 2019.
- Sakamoto K, Ozaki,T, Yen-Chun Ko, Cheng-Fang Tsai, Gong Y, Morozumi,M, Ishikawa, Y, Uchimura K, Nadanaka S, Kitagawa H, Medel Manuel L. Zulueta, Anandaraju Bandaru, Tamura J, Shang-Cheng Hung, Kadomatsu K. Glycan sulfation patterns define autophagy flux at axon tip via PTPRσ-cortactin axis. Nature Chemical Biology, 2019.
- 2018年
- Tsubota S, Kadomatsu K. Origin and initiation mechanisms of neuroblastoma. Cell Tissue Res, 2018; 372: 211-221.
- 2017年
- Iwata T, Uchino T, Koyama A, Johmura Y, Koyama J, Saito T, Ishiguro S, Arikawa T, Komatsu S, Miyachi M, Sano T, Nakanishi M, Shimada M*: The G2 checkpoint inhibitor CBP-93872 increases the sensitivity of colorectal and pancreatic cancer cells to chemotherapy. PLoS ONE, 12, e0178221, 2017
- Su Z, Kishida S, Tsubota S, Sakamoto K, Cao D, Kiyonari S, Ohira M, Kamijo T, Narita A, Xu Y, Takahashi Y, Kadomatsu K. Neurocan, an extracellular chondroitin sulfate proteoglycan, stimulates neuroblastoma cells to promote malignant phenotypes. Oncotarget, 2017; 8: 106296-106310.
- Tsubota S, Kadomatsu K. Origin and mechanism of neuroblastoma. Oncoscience, 2017; 4: 70-72.
- Tsubota S, Kishida S, Shimamura T, Ohira M, Yamashita S, Cao D, Kiyonari S, Ushijima T, Kadomatsu K. PRC2-Mediated Transcriptomic Alterations at the Embryonic Stage Govern Tumorigenesis and Clinical Outcome in MYCN-Driven Neuroblastoma. Cancer Res, 2017; 77: 5259-5271.
- Takemoto Y, Horiba M, Harada M, Sakamoto K, Takeshita K, Murohara T, Kadomatsu K, Kamiya K. Midkine Promotes Atherosclerotic Plaque Formation Through Its Pro-Inflammatory, Angiogenic and Anti-Apoptotic Functions in Apolipoprotein E-Knockout Mice. Circ J, 2017; 82: 19-27.
- Tsubota S, Kadomatsu K. Neuroblastoma stem cells and CFC1. Oncotarget, 2017; 8: 45032-45033.
- Sakamoto K, Kadomatsu K. Mechanisms of axon regeneration: The significance of proteoglycans. Biochim Biophys Acta, 2017; 1861: 2435-2441.
- Ohgomori T, Yamasaki R, Takeuchi H, Kadomatsu K, Kira JI, Jinno S. Differential involvement of vesicular and glial glutamate transporters around spinal alpha-motoneurons in the pathogenesis of SOD1(G93A) mouse model of amyotrophic lateral sclerosis. Neuroscience, 2017; 356: 114-124.
- Scilabra SD, Yamamoto K, Pigoni M, Sakamoto K, Muller SA, Papadopoulou A, Lichtenthaler SF, Troeberg L, Nagase H, Kadomatsu K. Dissecting the interaction between tissue inhibitor of metalloproteinases-3 (TIMP-3) and low density lipoprotein receptor-related protein-1 (LRP-1): Development of a \"TRAP\" to increase levels of TIMP-3 in the tissue. Matrix Biol, 2017; 59: 69-79.
- 2016年
- Shimada M*, Goshima T, Matsuo H, Johmura Y, Haruta M, Murata K, Tanaka H, Ikawa M, Nakanishi K, Nakanishi M*: Essential role of auto-activation circuitry on Aurora B-mediated H2AX-pS121 in mitosis. Nat. Commun., 7, 12059, 2016.
- Johmura Y, Yamashita E, Shimada M, Nakanishi K and Nakanishi M*: Defective DNA repair increases susceptibility to senescence through extension of Chk1-mediated G2 checkpoint activation. Sci. Rep., 6, 31194, 2016. Sharif J, Endo A. T, Nakayama M, Karimi M. M, Shimada M, Katsuyama K, Goyal P, Brind'Amour J, Sun M, Sun Z, Ishikura T, Mizutani-Koseki Y, Ohara O, Shinkai Y, Nakanishi M, Xie H, Lorincz C. M*, Koseki H*: Activation of endogenous retroviruses in Dnmt1–/– ESCs involves disruption of SETDB1-mediated repression by NP95 binding to hemimethylated DNA. Cell Stem Cell, 19, 81-94, 2016.
- Haruta M, Shimada M*, Nishiyama A, Johmura Y, Le Tallec B, Debatisse M, Nakanishi M*: Loss of maintenance DNA methylation results in abnormal DNA origin firing during DNA replication. Biochem. Biophys. Res. Commun., 469, 960-6, 2016.
- 2015年
- Murata K, Sato S, Haruta M, Goshima T, Chiba Y, Takahashi S, Sharif J, Koseki H, Nakanishi M, Shimada M*: Physical interaction between MPP8 and PRC1 complex and its implication for regulation of spermatogenesis. Biochem. Biophys. Res. Commun., 458, 470-5, 2015.
- 2014年
- 1Goshima T, 1Shimada M* (1Both authors contributed equally to this work), Sharif J, Matsuo H, Misaki T, Johmura Y, Murata K, Koseki H, Nakanishi M*: Mammal-specific H2A variant, H2ABbd, is involved in apoptotic induction via activation of NF-κB signaling pathway. J. Biol. Chem., 289, 11656-66, 2014
- Johmura Y, Shimada M, Misaki T, Naiki-Ito A, Miyoshi H, Motoyama N, Ohtani N, Hara E, Nakamura M, Morita A, Takahashi S, Nakanishi M*: Necessary and sufficient role for a mitosis skip in senescence induction. Mol. Cell, 55, 73-84, 2014Hirokawa T, Shiotani B, Shimada M, Murata K, Johmura Y, Haruta M, Tahara H, Takeyama H, Nakanishi M*: CBP-93872 inhibits NBS1-mediated ATR activation, abrogating maintenance of the DNA double strand break specific G2 checkpoint. Cancer Res., 74, 3880-9, 2014
- Cao D, Kishida S, Huang P, Mu P, Tsubota S, Mizuno M, Kadomatsu K. A new tumorsphere culture condition restores potentials of self-renewal and metastasis of primary neuroblastoma in a mouse neuroblastoma model. PLoS One, 2014; 9: e86813.
- Kadomatsu K, Sakamoto K. Sulfated glycans in network rewiring and plasticity after neuronal injuries. Neurosci Res, 2014; 78: 50-54.
- Hoshino H, Foyez T, Ohtake-Niimi S, Takeda-Uchimura Y, Michikawa M, Kadomatsu K, Uchimura K. KSGal6ST is essential for the 6-sulfation of galactose within keratan sulfate in early postnatal brain. J Histochem Cytochem, 2014; 62: 145-156.
- Kadomatsu K, Sakamoto K. Mechanisms of axon regeneration and its inhibition: roles of sulfated glycans. Arch Biochem Biophys, 2014; 558: 36-41.
- 2013年
- Nishigaki M, Kawada Y, Misaki T, Murata K, Goshima T, Hirokawa T, Yamada C, Shimada M*, Nakanishi M*: Mitotic phosphorylation of MPP8 by cyclin-dependent kinases regulates chromatin dissociation. Biochem. Biophys. Res. Commun., 432, 654-9, 2013.
- Matsui H, Ohgomori T, Natori T, Miyamoto K, Kusunoki S, Sakamoto K, Ishiguro N, Imagama S, Kadomatsu K. Keratan sulfate expression in microglia is diminished in the spinal cord in experimental autoimmune neuritis. Cell Death Dis, 2013; 4: e946.
- Hirano K, Ohgomori T, Kobayashi K, Tanaka F, Matsumoto T, Natori T, Matsuyama Y, Uchimura K, Sakamoto K, Takeuchi H, Hirakawa A, Suzumura A, Sobue G, Ishiguro N, Imagama S, Kadomatsu K. Ablation of keratan sulfate accelerates early phase pathogenesis of ALS. PLoS One, 2013; 8: e66969.
- Kadomatsu K, Kishida S, Tsubota S. The heparin-binding growth factor midkine: the biological activities and candidate receptors. J Biochem, 2013; 153: 511-521.
- Kobayashi K, Imagama S, Ohgomori T, Hirano K, Uchimura K, Sakamoto K, Hirakawa A, Takeuchi H, Suzumura A, Ishiguro N, Kadomatsu K. Minocycline selectively inhibits M1 polarization of microglia. Cell Death Dis, 2013; 4: e525.
- Kishida S, Mu P, Miyakawa S, Fujiwara M, Abe T, Sakamoto K, Onishi A, Nakamura Y, Kadomatsu K. Midkine promotes neuroblastoma through Notch2 signaling. Cancer Res, 2013; 73: 1318-1327.
- 2012年
- Sakamoto K, Kadomatsu K. Midkine in the pathology of cancer, neural disease, and inflammation. Pathol Int, 2012; 62: 445-455.
- Sakai K, Yamamoto A, Matsubara K, Nakamura S, Naruse M, Yamagata M, Sakamoto K, Tauchi R, Wakao N, Imagama S, Hibi H, Kadomatsu K, Ishiguro N, Ueda M. Human dental pulp-derived stem cells promote locomotor recovery after complete transection of the rat spinal cord by multiple neuro-regenerative mechanisms. J Clin Invest, 2012; 122: 80-90.
- 2011年
- Imagama S, Sakamoto K, Tauchi R, Shinjo R, Ohgomori T, Ito Z, Zhang H, Nishida Y, Asami N, Takeshita S, Sugiura N, Watanabe H, Yamashita T, Ishiguro N, Matsuyama Y, Kadomatsu K. Keratan sulfate restricts neural plasticity after spinal cord injury. J Neurosci, 2011; 31: 17091-17102.
- Kato N, Kosugi T, Sato W, Ishimoto T, Kojima H, Sato Y, Sakamoto K, Maruyama S, Yuzawa Y, Matsuo S, Kadomatsu K. Basigin/CD147 promotes renal fibrosis after unilateral ureteral obstruction. Am J Pathol, 2011; 178: 572-579.
- Sakamoto K, Bu G, Chen S, Takei Y, Hibi K, Kodera Y, McCormick LM, Nakao A, Noda M, Muramatsu T, Kadomatsu K. Premature ligand-receptor interaction during biosynthesis limits the production of growth factor midkine and its receptor LDL receptor-related protein 1. J Biol Chem, 2011; 286: 8405-8413.
- 2010年
- Niida H, Murata K, Shimada M, Ogawa K, Ohta K, Suzuki K, Fujigaki H, Khaw AK, Banerjee B, Hande MP, Miyamoto T, Miyoshi I, Shirai T, Motoyama N, Delhase M, Appella E, Nakanishi M*: Cooperative functions of Chk1 and Chk2 reduce tumour susceptibility in vivo. EMBO J., 29, 3558-70, 2010
- Niida H, Katsuno Y, Sengoku M, Shimada M, Yukawa M, Ikura M, Ikura T, Kohno K, Shima H, Suzuki H, Tashiro S, Nakanishi M*: Essential role of Tip60-dependent recruitment of ribonucleotide reductase at DNA damage sites in DNA repair during G1 phase. Genes Dev., 24, 333-8, 2010
- Ito Z, Sakamoto K, Imagama S, Matsuyama Y, Zhang H, Hirano K, Ando K, Yamashita T, Ishiguro N, Kadomatsu K. N-acetylglucosamine 6-O-sulfotransferase-1-deficient mice show better functional recovery after spinal cord injury. J Neurosci, 2010; 30: 5937-5947.
- Asano Y, Kishida S, Mu P, Sakamoto K, Murohara T, Kadomatsu K. DRR1 is expressed in the developing nervous system and downregulated during neuroblastoma carcinogenesis. Biochem Biophys Res Commun, 2010; 394: 829-835.
- 2009年
- Shimada M, Yamamoto A, Murakami-Tonami Y, Nakanishi M, Yoshida T, Aiba H, Murakami H*: Casein kinase II is required for the spindle assembly checkpoint by regulating Mad2p in fission yeast. Biochem. Biophys. Res. Commun., 388, 529-32, 2009.
- Zineldeen DH, Shimada M, Niida H, Katsuno Y and Nakanishi M*: Ptpcd-1 is a novel cell cycle related phosphatase that regulates centriole duplication and cytokinesis. Biochem. Biophys. Res. Commun., 380, 460-6, 2009.
- Katsuno Y, Suzuki A, Sugimura K, Okumura K, Zineldeen DH, Shimada M, Niida H, Mizuno T, Hanaoka F, Nakanishi M*: Cyclin A-Cdk1 regulates the origin firing program in mammalian cells. PNAS, 106, 3184-9, 2009.
- Kato N, Yuzawa Y, Kosugi T, Hobo A, Sato W, Miwa Y, Sakamoto K, Matsuo S, Kadomatsu K. The E-selectin ligand basigin/CD147 is responsible for neutrophil recruitment in renal ischemia/reperfusion. J Am Soc Nephrol, 2009; 20: 1565-1576.
- Yin J, Sakamoto K, Zhang H, Ito Z, Imagama S, Kishida S, Natori T, Sawada M, Matsuyama Y, Kadomatsu K. Transforming growth factor-beta1 upregulates keratan sulfate and chondroitin sulfate biosynthesis in microglias after brain injury. Brain Res, 2009; 1263: 10-22.
研究キーワード
がん、ゲノム安定性維持機構、細胞周期
大学院入学案内
当研究室では一緒に研究に取り組んでいただける博士課程の大学院生を随時募集しております。お気軽にご相談下さい。医学系大学出身かどうかは問いません。