機能形態学細胞生物学/超微形態学(解剖学第三)
研究室概要
私たちは,脳がどのように作られるか,研究しています.
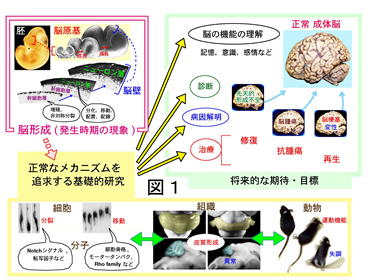
脳形成の原理の探求は,医学的な貢献を念頭に,世界規模で推進されています.それには,(1)脳の構築原理の熟知にもとづいて高次脳機能の理解を深める,(2)先天性疾患や脳腫瘍などの病因・病態を明らかにする,(3)再生医療的取り組みの基盤的知見を提供する,などの長期的な目的があります(図1).
基礎研究の積み重ねによって,過去に原因不明であった疾患の病因が明らかにされるなどの成果が重ねられつつあります.また,幹細胞を利用しての再生医療には「脳の組み立てを真似て損傷部位を治したい」という願いがあり,そのためには「脳の作られ方」をよく知る必要があります.
一方,脳形成に挑む研究は,生物学的な知を求める取り組みとしても重要な意味を持ちます.「細胞の集団によって組織という秩序構造が生成される原理」を,分子から個体までの多階層をつなぐ学際的なアプローチによって読み解こうとする取り組みにとって,脳の原基は,貴重な研究対象として意識できます.
このような学術的および社会的な意義を念頭に,当分野は,中枢神経系の発生のメカニズムに関する基礎的な研究を行なっています.
「脳づくり」には,大きく分けて2つの重大事があります.それは「細胞づくり」と「組み立て」です.
「細胞づくり」は,神経前駆細胞による分裂,娘細胞による多様な運命の選択などから成り立っており,巧妙な細胞内および細胞外の分子メカニズムによって制御されていると考えられていますが,まだまだ分からない事だらけです.
「組み立て」は,ニューロンの移動・層形成や回路形成からなる,「組織づくり」の過程です.この複雑かつ見事な発生ステップにも細胞内外のさまざまな分子機構が関与しています.
私たちは,これら2つのことがら・局面に対しての理解を深めるために,大脳,小脳,網膜などを対象とし,組織本来の構造をできるだけ保存したままで行なう細胞イメージング,単一細胞PCRにもとづく遺伝子発現プロファイリング,子宮内電気穿孔法などによるインビボ急性遺伝子操作実験などを駆使して,細胞たちのふるまいとその原理を明らかにしていこうと努力しています.
研究プロジェクト
1.脳原基を構成する細胞集団に対するシステム科学的研究(宮田グループ)
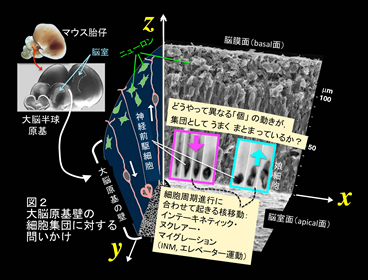
脳づくりの現場では,さまざまなタイプの細胞が,自身の三次元形態および周囲細胞との空間的関係性にもとづいてダイナミックに活躍します.個性の異なる細胞を次々につくり出し,それらを効率的に配置する作業が求められる脳原基の壁の中で,細胞は,たとえば,限られたスペースが過剰混雑に陥らないための集団としての動き(「たがいちがい」配置など)を見せます(図2).こうした細胞の「一挙手一投足」は,脳全体が正しく形成されるために不可欠であり,細胞内外のさまざまな要因(化学的・物理的)によって支えられていると予想されます.「細胞をよく見る」イメージング技術と「細胞に問いかける」いろいろな実験を組み合わせた研究を通じて,脳をつくりあげる細胞たちの「集団・群れとしての巧みさ」を明らかにします.
i) 神経前駆細胞動態の細胞生物学的研究(篠田,長坂,宮田)
神経前駆細胞は,脳原基の壁の内面(脳室面・apical面)と外面(脳膜面・basal面)を結ぶ細長い形をしており,それぞれ,細胞周期の進行に合わせて核・細胞体部分をapical-basal(AB)軸に沿って反復的に動かす(apical面で分裂,basal側でDNA合成:interkinetic nuclear migration [INM])(図2).そして組織としては「偽重層」という様態を呈する(Miyata et al. 2015: http://journal.frontiersin.org/article/10.3389/fncel.2014.00473/full).このプロジェクトは,神経前駆細胞が集団としてINMを効率的に行なうしくみについて,さまざまな細胞生物学的なアプローチで研究する.
ii) 神経前駆細胞に細長い形をもたらす原理(渡邊,宮田)
神経前駆細胞(神経上皮細胞,放射状グリア,apical progenitorなどとも呼ばれる)がAB軸に沿って細長い形をしている(Miyata et al. 2001: http://www.sciencedirect.com/science/article/pii/S0896627301004202)ということの意義については,前述のINMへの貢献,脳原基の壁全体の支柱としての役割などが知られているが,「細長さ」を築く・維持する・増すしくみは不明であるので,それを明らかにする.
iii) 神経前駆細胞の力学特性計測とシミュレーション(長坂,篠田,宮田)
神経前駆細胞の個別の,また集団としての力学的特性が脳原基の壁全体のありように対して,あるいはINM現象に対してどのような影響を与えるのか,実測,力学的試験,シミュレーションなど複合的なアプローチで研究し,細胞づくりの規模に応じて「細胞物流」が変わる可能性を,マウス・フェレット比較(Okamoto et al. 2014: http://www.sciencedirect.com/science/article/pii/S0168010214002296)など,種間差に注目して読み解く.
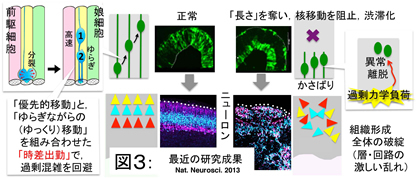
iv) 神経前駆細胞による力学要因に対する感知・反応のしくみ(川添,齋藤,宮田)
当研究室による先行研究で,神経前駆細胞が過剰な力学的負荷を感知し,それに反応してふるまうことが示された(図3,Okamoto et al., 2013: http://www.nature.com/neuro/journal/v16/n11/full/nn.3525.html).本プロジェクトは,この例も含めた機械的刺激に対して神経前駆細胞がどう「感知・反応」するかを探る.
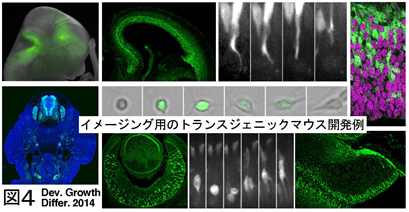
v) 神経前駆細胞の集団動態と運命決定(川上,宮田)
大脳皮質の発生過程において細胞の運命決定を制御する分子機構については,近年さまざまな進展があったものの,依然不明な点が多い.本プロジェクトは,外的因子の動態が誕生したての娘細胞の個性化にどう影響を与えるか,本研究室で作成したトランスジェニックマウスを用いたライブイメージング(図4,Kawaue et al. 2014: http://onlinelibrary.wiley.com/doi/10.1111/dgd.12131/abstract;jsessionid=8FEFD53CB40ED938E616C30E8939A82D.f02t03)や三次元的電子顕微鏡解析などを活用しつつ,集団の中での細胞間相互作用の意義を明らかにする.
vi) ニューロンの集団移動と組織力学(齋藤,宮田)
「細胞の集団による力学的な作用」が想定されるのは,上記のような神経前駆細胞だけではない.本プロジェクトは,「ニューロンの群れとしての移動」が脳原基の壁全体の成長,機能的な構築化にとってどのような意味を有するのか「組織力学」の観点で研究する.
vii) ミクログリアと神経前駆細胞・ニューロンとの関わり合い(服部,内藤,宮田)
発生中の大脳皮質原基において動くのは神経前駆細胞やニューロンだけではない.免疫系細胞の一種であるミクログリアも胎生期から神経系細胞と共存し,さまざまな動きを見せることが分かりつつある.しかし,胎生期ミクログリアの動的なふるまいのしくみ・意義は依然不明であるので,それを明らかにする.
viii) 脳発生の生体内・子宮内観察(服部,齋藤,宮田)
従来の哺乳類の脳発生研究では,胎仔から取り出した脳原基を薄切りしたうえで行なう「スライス培養法」が細胞のライブ観察のために大きく貢献してきた(Miyata et al. 2004: http://dev.biologists.org/content/131/13/3133.long).しかし,三次元培養といえども,本来の生体内の状況の完全な再現はできないため,細胞挙動の解析に限界がある.そこで,子宮内で育つマウス胎仔の脳原基に対しての「生体内ライブ観察」を自在に行なうことをめざす.
2.神経前駆細胞に個性を与えふるまいを制御する分子機構(川口グループ)
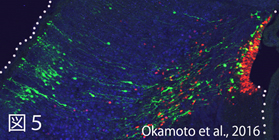
i)神経前駆細胞の時間特性(斎藤,川口)
神経前駆細胞は、発生の時刻が進んでいくにつれて自身の分裂モードや生じる娘細胞の性質を変化させる。このような神経前駆細胞の時間的特性は、前駆細胞の細胞周期の進行を止めても変化しつづける(Okamoto et al., 2016: http://www.nature.com/articles/ncomms11349)(図5)。前駆細胞の時間特性を調整する細胞外・細胞内の仕組みを明らかとしていく。
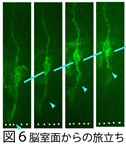
ii)脳室面からの細胞離脱制御 (川上,川口) ,
神経前駆細胞の分裂により生じた娘細胞の一部は、「壁の端につながった状態」を捨てて「旅立ち,奥へ進む」という動きを示す(図6)。この脳室面からの細胞離脱をきたすメカニズムを探る。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 宮田 卓樹 | 教授 | 細胞生物学 |
| 服部 祐季 | 准教授 | 細胞生物学 |
| 篠田 友靖 | 助教 | 細胞生物学 |
研究実績
- 2023年
- Hattori Y. The multifaceted roles of embryonic microglia in the developing brain. Front. Cell Neurosci., 17, 988952 (2023).
- Hattori Y, Kato D, Murayama F, Koike S, Asai H, Yamasaki A, Naito Y, Kawaguchi A, Konishi H, Prinz M, Masuda T, Wake H, Miyata T. CD206+ macrophages transventricularly infiltrate the early embryonic cerebral wall to differentiate into microglia. Cell Rep., 42(2) 112092 (2023).
- Hattori Y. The microglia-blood vessel interactions in the developing brain. Neurosci. Res., 187, 58–66 (2023).
- Oguma T, Takigawa-Imamura H, Shinoda T, Ogura S, Uemura A, Miyata T, Maini PK, and Miura T Analyzing the effect of cell rearrangement on Delta-Notch pattern formation Phys. Rev. E 107, 064404 – 14 June 2023.
- Katsuta H, Okuda S, Nagayama K, Machiyama H, Kidoaki S, Kato M, Sokabe M, Miyata T, Hirata H. Actin crosslinking by α-actinin averts viscous dissipation of myosin force transmission in stress fibers. iScience. 2023 Feb 1;26(3):106090.
- 2022年
- Tsujikawa K, Saito K, Nagasaka A, Miyata T. Developmentally interdependent stretcher-compressor relationship between the embryonic brain and the surrounding scalp in the preosteogenic head. Developmental Dynamics, 08 Jan 2022.
- Hattori Y. The multiple roles of pericytes in vascular formation and microglial functions in the brain. Life 12(11), 1835 (2022).
- Tsujikawa K, Hamanaka K, Riku Y, Hattori Y, Hara N, Iguchi Y, Ishigaki S, Hashizume A, Miyatake S, Mitsuhashi S, Miyazaki Y, Kataoka M, Jiayi L, Yasui K, Kuru S, Koike H, Kobayashi K, Sahara N, Ozaki N, Yoshida M, Kakita A, Saito Y, Iwasaki Y, Miyashita A, Iwatsubo T, Japanese Alzheimer’s disease Neuroimaging initiative, J-ANDI, Ikeuchi T, Japanese Longitudinal Biomarker Study in PSP and CBD (JALPAC) Consortium, Miyata T, Sobue G, Matsumoto N, Sahashi K, Katsuno M. Actin-binding protein filamin-A drives tau aggregation and contributes to progressive supranuclear palsy pathology. Sci. Adv., 8(21), eabm5029 (2022).
- Hattori Y, Itoh H, Tsugawa Y, Nishida Y, Kurata K, Uemura A, Miyata T. Embryonic pericytes promote microglial homeostasis and their effects on neural progenitors in the developing cerebral cortex. J. Neurosci., 42(3):362–376 (2022).
- Hattori Y. The behavior and functions of embryonic microglia. Anat. Sci. Int., 97, 1–14 (2022).
- Saito D, Tadokoro R, Nagasaka A, Yoshino D, Teramoto T, Mizumoto K, Funamoto K, Kidokoro H, Miyata T, Tamura K, Takahashi Y. Stiffness of primordial germ cells is required for their extravasation in avian embryos. iScience. 2022 Nov 18;25(12):105629.
- Wang S, Fu Y, Miyata T, Matsumoto S, Shinoda T, Itoh K, Harada A, Hirotsune S, Jin M. Functional cooperation of α-synuclein and tau is essential for proper corticogenesis. J Neurosci., 29 Jul 2022
- Ogura Y, Sahashi K, Hirunagi T, Iida M, Miyata T, Katsuno M. Mid1 is associated with androgen-dependent axonal vulnerability of motor neurons in spinal and bulbar muscular atrophy.
- 2021年
- Li Chenmin, Konishi H, Nishiwaki K, Sato K, Miyata T, Kiyama H. A mouse model of microglia-specific ablation in the embryonic central nervous system. Neuroscience Research (2021)
- Nagasaka A, Miyata T. Comparison of the Mechanical Properties Between the Convex and Concave Inner/Apical Surfaces of the Developing Cerebrum. Front. Cell Dev. Biol., 23 July 2021; 9.702068
- 2020年
- Hattori Y, Naito Y, Tsugawa Y, Nonaka S, Wake H, Nagasawa T, Kawaguchi A, Miyata T*. Transient microglial absence assists postmigratory neurons in proper differentiation. Nat. Commun., 11, 1631 (2020).
- Kawasoe R, Shinoda T, Hattori Y, Nakagawa M, Pham TQ, Tanaka Y, Sagou K, Saito K, Katsuki S, Kotani T, Sano A, Fujimori T, Miyata T. Two-photon microscopic observation of cell-production dynamics in the developing mammalian neocortex in utero. Two-photon microscopic observation of cell-production dynamics in the developing mammalian neocortex in utero. Dev. Growth. Differ., 62(2),118–128 (2020).
- 2019年
- Saito K, Okamoto M, Watanabe Y, Noguchi N, Nagasaka A, Nishina Y, Shinoda T, Sakakibara A, Miyata T. Dorsal-to-Ventral Cortical Expansion Is Physically Primed by Ventral Streaming of Early Embryonic Preplate Neurons. Cell Rep 2019 Nov 5; 29(6):1555-1567.
- Mizutani Y, Kobayashi H, Iida T, Asai N, Masamune A, Hara A, Esaki N, Ushida K, Mii S, Shiraki Y, Ando K, Weng L, Ishihara S, Ponik SM, Conklin MH, Haga H, Nagasaka A, Miyata T, Matsuyama M, Kobayashi T, Fujii T, Yamada S, Yamaguchi J, Wang T, Woods SL, Worthley D, Shimamura T, Fujishiro M, Hirooka Y, Takahashi M, and Enomoto A. Meflin-positive cancer-associated fibroblasts inhibit pancreatic carcinogenesis. Cancer Res 2019 Oct 15;79(20):5367-5381.
- Hara A, Kobayashi H, Asai N, Shigeyoshi S, Higuchi T, Kato K, Okumura T, Bando YK, Takefuji M, Mizutani Y, Miyai Y, Saito S, Maruyama S, Maeda K, Ouchi N, Nagasaka A, Miyata T, Mii S, Kioka N, Worthley DL, Murohara T, Takahashi M, Enomoto A. Roles of the Mesenchymal Stromal/Stem Cell Marker Meflin in Cardiac Tissue Repair and the Development of Diastolic Dysfunction. Circ Res. 2019 Aug 2;125(4):414-430.
- Kawaue T, Shitamukai A, Nagasaka A, Tsunekawa Y, Shinoda T, Saito K, Terada R, Bilgic M, Miyata T, Matsuzaki F & Kawaguchi A. Lzts1 controls both neuronal delamination and outer radial glial-like cell generation during mammalian cerebral development. Nat Commun 2019 Jun 25;10(1):2780.
- 2018年
- Hattori Y, Miyata T. Embryonic neocortical microglia express Toll-like receptor 9 and respond to plasmid DNA injected into the ventricle: technical considerations regarding microglial distribution in electroporated brain walls. eNeuro, 5(6) ENEURO.0312-18.2018 (2018).
- Hattori Y, Miyata T. Microglia extensively survey the developing cortex via the CXCL12/CXCR4 system to help neural progenitors to acquire differentiated properties. Genes Cells, 23(10), 915–922 (2018).
- Watanabe Y, Kawaue T, Miyata T. Differentiating cells mechanically limit progenitor cells’ interkinetic nuclear migration to secure apical cytogenesis. Development. June 26 2018, dev.162883.
- Kawaguchi A. Temporal patterning of neocortical progenitor cells: how do they know the right time? Neuroscience Research 2018 Sep 15; 138:3-11.
- Pham TQ, Kawaue T, Hoshi T, Tanaka Y, Miyata T, Sano A. Role of extrinsic mechanical force in the development of the RA-I tactile mechanoreceptor. Sci Rep. 2018 Jul 23;8(1):11085.
- Shinoda T, Nagasaka A, Inoue Y, Higuchi R, Minami Y, Kato K, Suzuki M, Kondo T, Kawaue T, Saito K, Ueno N, Fukazawa Y, Nagayama M, Miura T, Adachi T, Miyata T. Elasticity-based boosting of neuroepithelial nucleokinesis via indirect energy transfer from mother to daughter. PLOS Biol. April 20 2018, 16(4): e2004426.
- Ohtaka-Maruyama C, Okamoto M, Endo Kentaro, Oshima M, Kaneko N, Yura K, Okado H, Miyata T, Maeda N. Synaptic transmission from subplate neurons controls radial migration of neocortical neurons. Science. Apr 20 2018, 360(6386): 313-317.
- Jinnou H, Sawada M, Kawase K, Kaneko N, Herranz-Pérez V, Miyamoto T, Kawaue T, Miyata T, Tabata Y, Akaike T, García-Verdugo JM, Ajioka I, Saitoh S, Sawamoto K. Radial Glial Fibers Promote Neuronal Migration and Functional Recovery after Neonatal Brain Injury. Cell Stem Cell. Jan 04 2018, 22(1): 128-137.e9.
- Saito K, Kawasoe R, Sasaki H, Kawaguchi A, Miyata T. Neural Progenitor Cells Undergoing Yap/Tead-Mediated Enhanced Self-Renewal Form Heterotopias More Easily in the Diencephalon than in the Telencephalon. Neurochemical Research. Jan 2018, 43(1): 1-10.
- 2017年
- Ogura S, Kurata K, Hattori Y, Takase H, Ishiguro-Oonuma T, Hwang Y, Ahn S, Park I, Ikeda W, Kusuhara S, Fukushima Y, Nara H, Sakai H, Fujiwara T, Matsushita J, Ema M, Hirashima M, Minami T, Shibuya M, Takakura N, Kim P, Miyata T, Ogura Y, Uemura A. Sustained inflammation after pericyte depletion induces irreversible blood-retina barrier breakdown. JCI Insight, 2(3), e90905 (2017).
- Delaunay D, Kawaguchi A, Dehay C and Matsuzaki F. Division modes and physical asymmetry in cerebral cortex progenitors. Curr Opin Neurobiol. 2017, 42:75–83.
- Matsunaga Y, Noda M, Murakawa H, Hayashi K, Nagasaka A, Inoue S, Miyata T, Miura T, Kubo K, and Nakajima K. Reelin transiently promotes N-cadherin-dependent neuronal adhesion during mouse cortical development. Proc.Natl.Acad.Sci.U.S.A. 2017,114(8):2048-2053.
- Jin M, Pomp O, Shinoda T, Toba, Torisawa T, Furuta K, Oiwa K, Yasunaga T, Kitagawa D, Matsumura S, Miyata T, Tan TT, Reversade B and Hirotsune S. Katanin p80, NuMA and cytoplasmic dynein cooperate to control microtubule dynamics. Sci Rep. 2017, 7:39902,
- 2016年
- Pham TQ, Hoshi T, Tanaka Y, Sano A, Kawaue T, Miyata T. Two-Photon imaging of DiO-labelled Meissner corpuscle in living mouse's fingertip. IEEE Trans Haptics, 2016
- Itoh Y, Higuchi M, Oishi K, Kishi Y, Okazaki T, Sakai H, Miyata T, Nakajima K, Gotoh Y. PDK1–Akt pathway regulates radial neuronal migration and microtubules in the developing mouse neocortex. PNAS, 2016; 113: E2955-E2964.
- Okamoto M, Miyata T, Konno D, Ueda HR, Kasukawa T, Hashimoto M, Matsuzaki F, Kawaguchi A. Cell-cycle-independent transitions in temporal identity of mammalian neural progenitor cells. Nat Commun., 2016; 7:11349.
- Katsunuma S, Honda H, Shinoda T, Ishimoto Y, Miyata T. Kiyonari H, Abe T, Nibu K, Takai Y, Togashi H. Synergistic action of nectins and cadherins generates the mosaic cellular pattern of the olfactory epithelium. J. Cell. Biol., 2016; 212: 561-575.
- Kawaguchi A, Matsuzaki F. Cell cycle–arrested cells know the right time. Cell Cycle, 2016; 15(20): 2683-2684.
- Nagasaka A, Shinoda T, Kawaue T, Suzuki T, Nagayama K, Matsumoto T, Ueno N, Kawaguchi A and Miyata T. Differences in the mechanical properties of the developing cerebral cortical proliferative zone between mice and ferrets at both the tissue and single-cell levels. Front. Cell Dev. Biol. 2016, 4:139
- 2015年
- Leto K, Arancillo M, Becker EBE, Buffo A, Chiang C, Ding B, Dobyns WB, Dusart I, Haldipur P, Hatten ME, Hoshino M, Joyner AL, Kano M, Kilpatrick DL, Koibuchi N, Marion S, Martinez S, Millen K. J, Millner TO, Miyata T, Parmigiani E, Schilling K, Sekerkova G, Sillitoe R. V, Sotelo C, Uesaka N, Wefers A, Wingate RJT, Hawkes R. Consensus paper: Cerebellar development. Cerebellum, 2015 Oct 6.
- Miyata T, Okamoto M, Shinoda T, Kawaguchi A. Interkinetic nuclear migration generates and opposes ventricular-zone crowding: insights into tissue mechanics. Front Cell Neurosci, 2015; 8: 473
- 2014年
- Okamoto M, Shinoda T, Kawaue T, Nagasaka A, Miyata T. Ferret-mouse differences in interkinetic nuclear migration and cellular densification in the neocortical ventricular zone. Neurosci. Res, 2014; 83: 25-32
- Kawaue T, Sagou K, Kiyonari H, Ota K, Okamoto M, Shinoda T, Kawaguchi A, Miyata T. Neurogenin2-d4Venus and Gadd45g-d4Venus transgenic mice: Visualizing mitotic and migratory behaviors of cells committed to the neuronal lineage in the developing mammalian brain. Dev Growth Differ, 2014; 56: 293-304
- Hashimoto M, Hata A, Miyata T, Hirase H. Programmable wireless light-emitting diode stimulator for chronic stimulation of optogenetic molecules in freely moving mice. Neurophoton, 2014; 1(1), 011002
- Namba T, Kibe Y, Funahashi Y, Nakamuta S, Takano T, Ueno T, Shimada A, Kozawa S, Okamoto M, Shimoda Y, Oda K, Wada Y, Masuda T, Sakakibara A, Igarashi M, Miyata T, Faivre-Sarrailh C, Takeuchi K, Kaibuchi K. Pioneering axons regulate neuronal polarization in the devveloping cerebral cortex. Neuron, 2014; 81: 814-829
- Sakakibara A (corresponding author), Sato T, Ando R, Noguchi N, Masaoka M, Miyata T. Dynamics of centrosome translocation and microtubule organization in neocortical neurons during distinct modes of polarization. Cereb. Cortex, 2014; 24: 1301-1310
- 2013年
- Ageta-Ishihara N, Miyata T, Ohshima C, Watanabe M, Sato Y, Hamamura Y, Higashijima T, Mazitschek R, Bito H, Kinoshita M. Septins promote dendrite and axon development by negatively regulating microtubule stability via HDAC6-mediated deacetylation. Nat Commun, 2013; 4: 2532
- Okamoto M, Namba T, Shinoda T, Kondo T, Watanabe T, Inoue Y, Takeuchi K, Enomoto Y, Ota K, Oda K, Wada Y, Sagou K, Saito K, Sakakibara A, Kawaguchi A, Nakajima K, Adachi T, Fujimori T, Ueda M, Hayashi S, Kaibuchi K, Miyata T. TAG-1–assisted progenitor elongation streamlines nuclear migration to optimize subapical crowding. Nat. Neurosci, 2013; 6: 1556-1566
- Sakakibara A, Ando R, Sapir T, Tanaka T. Microtubule dynamics in neuronal morphogenesis. Open Biol, 2013; 3: 130061
- Sapir T, Levy T, Sakakibara A, Rabinkov A, Miyata T, Reiner O. Shootin1 acts in concert with KIF20B to promote polarization of migrating neurons. J. Neurosci, 2013; 33: 11932-11948
- Wu J, Liu L, Matsuda T, Zao Y, Rebane A, Drobizhev M, Chang Y F, Araki S, Arai Y, March K, Thomas HE, Sagou K, Miyata T, Nagai T, Li WH, Campbell R E. Improved orange and red Ca2+ indicators and photophysical considerations for optogenetic applications. ACS Chem Neurosci, 2013; 4(6): 963-972
- Xie MJ, Yagi H, Kuroda K, Wang CC, Komada M, Zhao H, Sakakibara A, Miyata T, Nagata K, Iguchi T, Sato M. WAVE2-Abi2 complex controls growth cone activity and regulates the multipolar-bipolar transition as well as the initiation of glia-guided migration. Cereb. Cortex, 2013; 23: 1410-1423
- 2012年
- Pérez-Martínez FJ, Luque-Río A, Sakakibara A, Hattori M, Miyata T, Luque JM. Reelin-dependent ApoER2 downregulation uncouples newborn neurons from progenitor cells. Biol. Open, 2012; 1: 1258-1263
- 2011年
- Nakamuta S, Funahashi Y, Namba T, Arimura N, Picciotto MR, Tokumitsu H, Soderling T R, Sakakibara A, Miyata T, Kamiguchi H, Kaibuchi K. Local application of neurotrophins specifies axons through inositol 1,4,5-trisphosphate, calcium, and ca2+/calmodulin-dependent protein kinases. Sci. Signal, 2011; 4(199): ra76
- Natsume S, Kato T, Kinjo S, Enomoto A, Toda H, Shimato S, Ohka F, Motomura K, Kondo Y, Miyata T, Takahashi M, Wakabayashi T. Girdin maintains the stemness of glioblastoma stem cells. Oncogene, 2011; 31: 2715-2724
- 2010年
- Miyata T, Ono Y, Okamoto M, Masaoka M, Sakakibara A, Kawaguchi A, Hashimoto M, Ogawa M. Migration, early axonogenesis, and Reelin-dependent layer-forming behavior of early/posterior-born Purkinje cells in the developing mouse lateral cerebellum. Neural Dev, 2010; 5: 23
- Miyata T, Kawaguchi D, Kawaguchi A, Gotoh Y. Mechanisms that regulate the number of neurons during mouse neocortical development. Curr. Opin. Neurobiol, 2010; 20: 22-28
- Kato TM, Kawaguchi A, Kosodo Y, Niwa H, Matsuzaki F. Lunatic fringe potentiates Notch signaling in the developing brain. Mol Cell Neurosci, 2010; 45: 12-25
- 2009年
- Uchida T, Baba A, Perez-Martinez FJ, Hibi T, Miyata T, Luque JM, Nakajima K, Hattori M. Downregulation of functional Reelin receptors in projection neurons implies that primary Reelin action occurs at early/premigratory stages. J Neurosci, 2009; 29: 10653-10662
- Saito K, Dubreuil V, Arai Y, Wilsch-Brauninger M, Schwudke D, Saher G, Miyata T, Breier G, Thiele C, Shevchenko A, Nave KA, Huttner WB. Ablation of cholesterol biosynthesis in neural stem cells increases their VEGF expression and angiogenesis but causes neuron apoptosis. Proc Natl Acad Sci USA, 2009; 106(20): 8350-8355
- Minobe S, Sakakibara A, Ohdachi T, Kanda R, Kimura M, Nakatani S, Tadokoro R, Ochiai W, Nishizawa Y, Mizoguchi A, Kawauchi T, Miyata T. Rac is involved in the interkinetic nuclear migration of cortical progenitor cells. Neurosci. Res, 2009; 63: 294-301
- Ochiai W, Nakatani S, Takahara T, Kainuma M, Masaoka M, Minobe S, Namihira M, Nakashima K, Sakakibara A, Ogawa M, Miyata T. Periventricular Notch activation and asymmetric Ngn2 and Tbr2 expression in pair-generated neocortical daughter cells. Mol. Cell. Neurosci, 2009; 40: 225-233
- 2008年
- Yoon KJ, Koo BK, Jeong HW, Ghim J, Kwon MC, Moon JS, Miyata T, Kong Y. Mind bomb 1-experssing intermediate progenitors generate Notch signaling to maintain radial glial cells. Neuron, 2008; 58: 519-531
- Sunabori T, Tokunaga A, Nagai T, Sawamoto K, Okabe M, Miyawaki A, Matsuzaki Y, Miyata T, Okano H. Cell-cycle-specific nestin expression coordinates with morphological changes in embryonic cortical neural progenitors. J Cell Sci, 2008; 121: 1204-1212
- Koyasu T, Kondo M, Miyata K, Ueno S, Miyata T, Nishizawa Y, Terasaki H. Photopic electroretinograms of mGluR6-deficient mice. Curr Eye Res, 2008; 33: 91-99
- Miyata T. Development of three-dimensional architecture of the neuroepithelium: Role of pseudostratification and cellular 'community. Dev. Growth Differ, 2008; 50: S105-S112
- Sakaue-Sawano A, Kurokawa H, Morimura T, Hanyu A, Hama H, Osawa H, Kashiwagi S, Fukami K, Miyata T, Miyoshi H, Imamura T, Ogawa M, Masai H, Miyawaki, A. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell, 2008; 132: 487-498
- Konno D, Shioi G, Shitamukai A, Mori A, Kiyonari H, Miyata T, Matsuzaki F. Neuroepithelial progenitors undergo LGN-dependent planar divisions to maintain self-renewability during mammalian neurogenesis. Nat. Cell Biol, 2008; 10: 93-101
- 2007年
- Nishizawa Y, Imafuku H, Saito K, Kanda R, Kimura M, Minobe S, Miyazaki F, Kawakatsu S, Masaoka M, Ogawa M, Miyata T. Survey of the morphogenetic dynamics of the ventricular surface of the developing mouse cortex. Dev. Dyn, 2007; 236: 3061-3070
- Tamai H, Shinohara H, Miyata T, Saito K, Nishizawa Y, Nomura T, Osumi N. Pax6 transcription factor regulates interkinetic nuclear movement in cortical progenitor cells via centrosomal stabilization. Genes Cells, 2007; 12: 983-996
- Miyata T. Morphology and mechanics of daughter cells \"delaminating\" from the ventricular zone of the developing neocortex. Cell Adh. Migr, 2007; 1: 99-101
- Miyata T, Ogawa M. Twisting of neocortical progenitor cells underlies a spring-like mechanism for daughter cell migration. Curr, Biol, 2007; 17: 146-151
- Ochiai W, Minobe S, Ogawa M, Miyata T. Transformation of pin-like ventricular zone cells into cortical neurons. Neurosci. Res, 2007; 57: 326-329
- Miyata T. Asymmetric cell division during brain morphogenesis. Prog. Mol. Subcell. Biol, 2007; 452: 121-142
- 2006年
- Hirai S, Cui DF, Miyata T, Ogawa M, Kiyonari H, Suda Y, Aizawa S, Banda Y, Ohno S. The c-Jun N-terminal kinase activator dual leucine zipper kinase regulates axon growth and neuronal migration in the developing cerebral cortex. J. Neurosci, 2006; 26: 11992-12002
- Imai F, Hirai S, Akimoto K, Koyama H, Miyata T, Ogawa M, Noguchi S, Sasaoka T, Noda T, Ohno S. Inactivation of aPKCλ results in the loss of adherens junctions in neuroepithelial cells without affecting neurogenesis in mouse neocortex. Development, 2006; 133: 1735-1744
- Mutoh T, Miyata T, Kashiwagi S, Miyawaki A, Ogawa M. Dynamic behavior of individual cells in developing organotypic brain slices revealed by the photoconvertable protein Kaede. Exp. Neurol, 2006; 200: 430-437
- Naruse M, Nakahira E, Miyata T, Hitoshi S, Ikenaka K, Bansai R. Induction of oligodendrocyte progenitors in dorsal forebrain by intraventricular microinjection of FGF-2. Dev. Biol, 2006; 60: 1084-1100
- Zou P, Muramatsu H, Miyata T, Muramatsu T. Midkine, a heparin-binding growth factor, is expressed in neural precursor cells and promotes their growth. J. Neurochem, 2006; 99: 1470-1479
- 2005年
- Miyata T, Saito K, Nishizawa Y, Murayama A, Masaoka M, and Ogawa M. Modern slice culture for direct observation of production and migration of brain neurons. Nagoya J. Med. Sci. 2005; 67: 65-70
- Ueno S, Kondo M, Miyata K, Hirai T, Miyata T, Usukura J, Nishizawa Y, Miyake Y. Physiological function of S-cone system is not enhanced in rd7 mice. Exp Eye Res, 2005; 81: 751-758
- Uematsu J, Nishizawa Y, Hirako Y, Kitamura K, Usukura J, Miyata T, Owaribe K. Both type-I hemidesmosomes and adherens-type junctions contribute to the cell-substratum adhesion system in myoepithelial cells. Eur J Cell Biol, 2005; 84: 407-415
- 2004年
- Kawaguchi A, Ogawa M, Saito K, Matsuzaki F, Okano H, Miyata T. Differential expression of Pax6 and Ngn2 between pair-generatged cortical neurons. J. Neurosci. Res, 2004; 78: 784-795
- Miyata T, Kawaguchi A, Saito K, Kawano M, Muto T, Ogawa M. Asymmetric production of surface-dividing and non-surface-dividing cortical progenitor cells. Development, 2004; 131: 3133-3145
研究キーワード
大脳皮質、小脳、網膜、発生、神経前駆細胞、ニューロン、ミクログリア、細胞形態、細胞分裂、細胞移動、非対称分裂、細胞運命決定、スライス培養、イメージング、力学、クラウドダイナミクス
日本語総説
- 宮田卓樹 神経幹細胞の集団的な核移動 脳神経系の再生医学 ―発生と再生の融合的新展開―(診断と治療社 再生医療シリーズ) pp.50-54 (2015.1月)
- 宮田卓樹,岡本麻友美 脳形成を下支えする神経前駆細胞の核移動 生体の科学 (特集「器官の発生と再生の基礎」) 65, 203-207 (2014)
- 宮田卓樹 Overview (特集「動く細胞・群れる細胞」) 細胞工学 33, 590-592 (2014)
- 岡本麻友美,篠田友靖,宮田卓樹 神経前駆細胞の空間的安寧を支えるヘテロ物流 細胞工学 33, 645-649 (2014)
- 宮田卓樹, 山本亘彦 教科書「脳の発生学」 化学同人 (2013)
- 宮田卓樹 神経系発生過程における細胞移動 「再生医療叢書:神経系」朝倉書店 (2013)
- 宮田卓樹 小脳皮質形成メカニズムの解明をめざして:プルキンエ細胞の移動と配置の過程に関する新知見 ブレインサイエンスレビュー 91-110 (2011)
- 宮田卓樹 大脳皮質における層形成 実験医学 25, 69-73 (2008)
- 宮田卓樹 大脳皮質原基におけるニューロンの誕生と旅立ち 実験医学 25, 333-337 (2007)
- 宮田卓樹 移動ニューロンの骨格と接着:神経上皮長屋の屋根裏部屋にて 蛋白質核酸酵素 51, 721-726 (2006)
- 宮田卓樹 「脳室下帯」における皮質ニューロン産生 脳 21 8, 23- (2005)
- 宮田卓樹 スライス培養により読み解く中枢神経系の組織形成機構 日本神経精神薬理学会誌 25, 175-181 (2005)
- 宮田卓樹 神経上皮における細胞周期、運命決定、組織形成運動のリンク 実験医学 23, 214-(2005)
- 橋本光広,宮田卓樹 小脳の縦縞状区画化と皮質形成:Purkinje細胞の誕生・移動・配置の分子機構 脳の科学 25, 543-549 (2003)
- 宮田卓樹,齋藤加奈子,川口綾乃,小川正晴 胎生期大脳組織の三次元培養:複雑さへの回帰 生体の科学 53, 243-249 (2002)
- 齋藤加奈子,川口綾乃,倉持浩,小川正晴,宮田卓樹 スライス培養による脳原基のタイムラプス断面視 「図・写真で観る発生・再生実験マニュアル」(安田國雄編) メディカルドゥ pp.82-91 (2002)
- 宮田卓樹 ニューロン移動・配置と脳の構築化 「みる見るわかる脳・神経科学入門講座」(渡辺雅彦編)下巻 羊土社 pp. 48-60 (2002)
- 宮田卓樹,小川正晴 大脳皮質形成という名の「機織り」?タテ糸とヨコ糸の謎 「脳・神経研究のフロンティア」(仲村春和/村上富士夫編)羊土社 pp.708-714 (2002)
- 宮田卓樹 DiI を用いた脳原基スライス培養:神経上皮ジャングル探検の愉しみー 細胞工学 20, 1410-1419 (2001)
- 宮田卓樹,川口綾乃,岡野栄之,小川正晴 発達脳における神経細胞の移動: 新しいニューロン移動法とその原理 生体の科学 52, 224-229 (2001)
- 宮田卓樹,小川正晴 大脳皮質におけるニューロンの産生と配置の機構 医学のあゆみ 医歯薬出版 199, 1000-1004 (2001)
- 宮田卓樹,小川正晴 小脳の発生に関する分子機構:プルキンエ細胞と顆粒神経細胞の大河ドラマ 神経研究の進歩 医学書院 44, 965-973 (2000)
- 宮田卓樹,仲嶋一範,御子柴克彦,小川正晴 大脳・小脳における層形成機構ー「皮質ニューロン号」の離着陸 実験医学 15,1600-1606 (1997)
- 宮田卓樹,小川正晴 初期胚からの神経組織培養 ニューロサイエンスラボマニュアル「神経細胞培養法」(畠中寛編)シュプリンガーフェアラーク東京 201-211 (1997)