不妊・生殖
疾患モデルを用いた多嚢胞性卵巣症候群 (PCOS) 研究
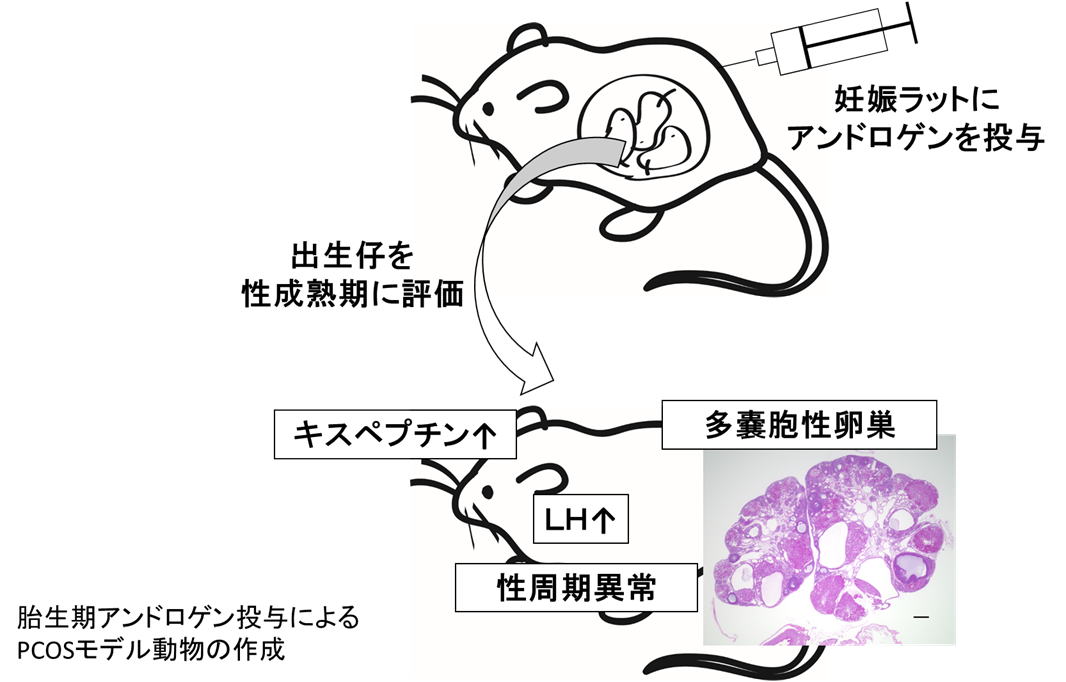
PCOS (polycystic ovary syndrome) は、排卵障害による不妊症に加え、周産期合併症の増加や肥満・糖尿病・高脂血症などの代謝異常も来し、女性の生殖および代謝機能に重大な影響を及ぼすため、女性の健康を生涯にわたって害する疾患です。性成熟期女性の5-10%程度に認められるありふれた疾患であるにもかかわらず、根本的な病因は不明であり、治療法は排卵障害に対する排卵誘剤など、対症療法のみになります。PCOS は前述のように、特徴的な病態を多臓器で示す全身性疾患であるため、病因は単一でないと考えられており、病態の解明には複数臓器での解析が必須になります。しかし、ヒトの複数臓器から検体を一度に採取することは困難であるため、PCOS の病態解明および根治的な治療法の開発には、適切な動物モデルの作製が極めて重要といえます。当グル―プでは、胎生期に経母体的にアンドロゲンを投与することで、ヒトPCOSに近い疾患モデルの作成に成功、さらに、高ゴナドトロピン (LH) 値の要因として、GnRH/ LH 分泌をさらに上位から制御することが近年明らかになってきた視床下部神経ペプチドであるキスペプチンの発現異常について報告しました。現在は、このモデルを用い、複数臓器における網羅的な発現解析や、エピジェネティック解析を行い、病態の解明と新規治療の開発に取り組んでいます。また、モデル動物の卵子を解析することで、次世代への影響についても検討を行っています。
ヒト顆粒膜細胞株を用いた卵胞発育制御機構の解明
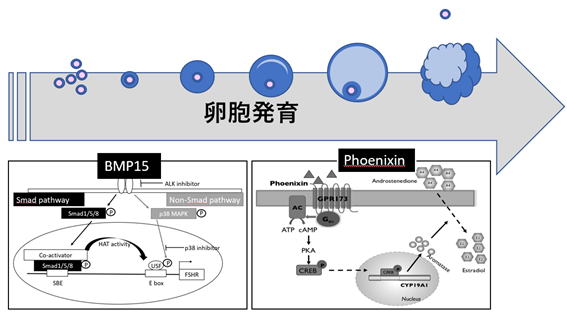
卵巣顆粒膜細胞の増殖や分化を制御する因子に着目し、ヒト卵巣における卵胞発育機構に関する研究を行っています。これまでに我々は、がん抑制遺伝子であるPTENが正常顆粒膜細胞の増殖・分化に深く関わっていることを報告しています(1)。また国立がんセンター研究所清野透博士との共同研究により、本研究に極めて有用なヒト不死化顆粒膜細胞株の樹立に成功しています(2)。最近では卵胞ひいては卵の成熟に不可欠であるFSHRの誘導機序を解明し(3)、新規神経ペプチドPhoenixinが卵胞発育を促進することを報告しています(4)。本研究で得られた知見をもとに、妊孕性の高い良質な卵を多く獲得するための卵巣刺激法の開発を目指しています。
卵巣組織培養法を用いた成熟卵子獲得への挑戦
近年、生殖年齢の女性患者において化学療法、放射線療法がもたらす妊孕性喪失が大きな問題と認識されています。妊孕性温存療法には、GnRH(Gonadotropin-releasing hormone)アゴニスト投与、卵子凍結、受精卵凍結、卵巣凍結があります。しかし、GnRHアゴニストによる卵巣保護効果は不確実であり、卵子凍結、受精卵凍結は、原疾患の治療開始までの時間に猶予が少なく、将来的に生児を得られるほど凍結卵子、受精卵をストックできない可能性があります。卵巣凍結は、思春期前の女児にも施行可能で、排卵誘発を必要としない上に、大量の卵胞を一度に保存可能であることが特徴で、最近実用化が進んでいる手法ですが、自家移植時に卵巣内の悪性腫瘍細胞の再移入リスクがあります。
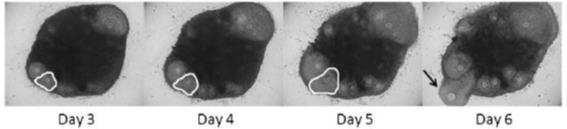
そこで、摘出卵巣から体外で成熟卵子を得ることができれば、卵巣組織の自家移植を行わなくても、卵子凍結、受精卵凍結、胚移植が可能で、がん細胞の再移入リスクもないと考えられます。本研究ではマウス卵巣から成熟卵子を得るべく、我々が確立した卵巣組織培養法で卵胞発育の経時的評価を行い、放出された卵母細胞の解析を行っています(5)。タイムラプス撮影では、卵胞形成、発育、卵母細胞放出、卵胞閉鎖の過程を初めて精細に可視化し、卵胞発育動態の把握に寄与したと考えられます。今後、妊孕性温存療法として、ヒト卵巣組織の体外培養への応用が期待されます。
臨床研究・不妊相談センター
不妊カウンセリングの観点から不妊症とストレスの関係についての臨床研究を行っています。また地域貢献を目的とし愛知県不妊専門相談センターを運営しています。
1. Insulin attenuates the insulin-like growth factor-I (IGF-I)-Akt pathway,
not IGF-I-extracellularly regulated kinase pathway, in luteinized granulosa
cells with an increase in PTEN. Iwase A., Goto M., Harata T., Takigawa
S., Nakahara T., Suzuki K., Manabe S., Kikkawa F. J Clin Endocrinol Metab
2009; 94: 2184-2191.
2. Establishment of a human nonluteinized granulosa cell line that transitions
from the gonadotropin-independent to the gonadotropin-dependent status.
Bayasula, Iwase A., Kiyono T., Takikawa S., Goto M., Nakamura T., Nagatomo
Y., Nakahara T., Kotani T., Kobayashi H., Kondo M., Manabe S., Kikkawa
F. Endocrinology 2012; 153: 2851-2860.
3. Molecular mechanism of FSHR expression induced by BMP15 in human granulosa
cells. Shimizu K, Nakamura T, Bayasula, Nakanishi N, Kasahara Y, Nagai
T, Murase T, Osuka S, Goto M, Iwase A, Kikkawa F. J Assist Reprod Genet
2019; doi: 1007/s10815-019-01469-y. Epub ahead of print
4. Effect of the Neuropeptide Phoenixin and Its Receptor GPR173 During
Folliculogenesis. Nguyen XP, Nakamura T, Osuka S, Bayasula B, Nakanishi
N, Kasahara Y, Muraoka A, Hayashi S, Nagai T, Murase T, Goto M, Iwase A,
Kikkawa F. Reproduction 2019; doi: 10.1530/REP-19-0025. Epub ahead of print
5. Follicle dynamics: visualization and analysis of follicle growth and
maturation using murine ovarian tissue culture. Murase T, Iwase A, Komatsu
K, Bayasula, Nakamura T, Osuka S, Takikawa S, Goto M, Kotani T, Kikkawa
F. J Assist Reprod Genet. 2018 Feb;35(2):339-343.
