- TOP
- >
- 研究内容
研究内容
当研究室では、生命現象の根幹である遺伝情報の継承および発現制御機構の解明から、がんにおける治療標的同定と治療戦略開発に至るまで統合的な研究を行っています。こちらのページでは主要な研究テーマである「がんの治療標的に関する研究」「発がんに寄与するゲノム安定性維持機構解明」「適切な細胞増殖に必要なチェックポイント機構の提唱と分子機構解明」についてご紹介いたします。(リファレンスをクリックすると元論文のページへ飛びます。)
がんの治療標的
に関する研究
難治性がんにおける治療標的の同定と治療戦略の開発
乳がんは日本人女性が罹患する悪性腫瘍の第1位であり、その罹患数ならびに死亡数は年々増加しています。女性ホルモンの一種であるエストロゲンと結合する受容体(ERα)が発現している乳がん(ERα陽性乳がん)は、乳がんの約70%を占めています。ERα陽性乳がんに対しては、ERαの働きを抑制する内分泌療法が奏効します。しかしながら、ERα陽性転移乳がん患者に内分泌療法を行った場合、治療当初には内分泌療法に効果を認めても、いずれ内分泌療法に対して耐性を示してしまいます。そのため、内分泌療法に対する耐性メカニズムの解明とその克服が大きな臨床的課題となっています。そこで、乳がんの新たな治療標的を同定するために、①ERαと相互作用する、②ERαと発現量が正の相関関係を示す、③乳がんで過剰発現する、④高発現は生存期間が短縮する、という4つの基準を満たす乳がんの予後不良因子として、FKBP52 (FK506 Binding Protein 52)を同定しました(図1) (Habara et al.,PNAS, 2022)。乳がん細胞株(MCF7)において、FKBP52の発現を抑制すると、ERαの分解が亢進するためERαの発現量が減少し、がん細胞の増殖を顕著に阻害しました。重要なことに、内分泌治療抵抗性となった乳がん細胞株(MFR: MCF7 derived fulvestrant resistance)に対しても、FKBP52を阻害することで、ERαの発現量およびがん細胞の増殖を抑制できる結果が得られました(図2)。さらにFKBP52はBRCA1とERαの結合を促進することで、ERαを安定化することを解明しました。FKBP52と相同性の高いFKBP51の機能を調べたところ、FKBP51は①乳がんで発現が減少する、②高発現は生存期間を延長する、③ERαの分解を促進するという、FKBP52とは逆の機能を有することが判明しました。
以上の結果から、FKBP52はERαを安定化することにより、ERαの機能を増強し、がん細胞の増殖を促進させることが分かりました。一方、FKBP51はFKBP52と競合してERαと結合し、ERαの分解を促進する機能を持つことが示唆されました(図3)。
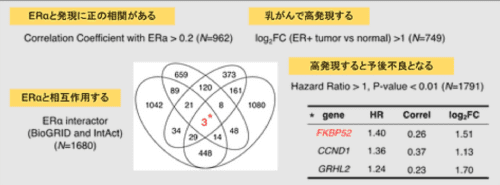
図1 同定した再発性乳がんの予後不良因子
ERαと相互作用する、ERαと発現が正の相関がある、乳がんで高発現する、高発現で生存期間が短縮する、の4つに含まれる因子を探索しました。その結果、再発性乳癌の予後不良因子として3因子を同定することができ、その中で、高発現が最も生存期間を短縮させるFKBP52に着目しました。
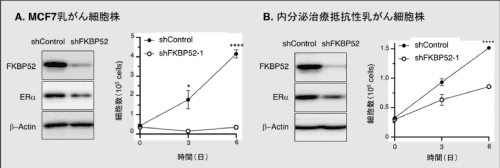
図2 FKBP52発現抑制細胞の表現型
MCF7乳がん細胞株(A)および内分泌治療抵抗性乳がん細胞株(B)において、FKBP52の発現を抑制すると、ERαの発現が減少し、がん細胞の増殖を阻害することができます。
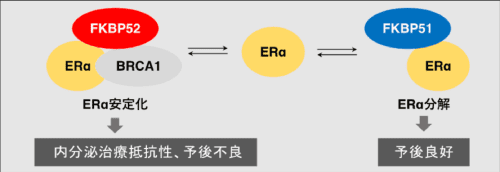
図3 FKBPによるERα制御
FKBP52はBRCA1とERαの結合を促進することでERαを安定化させる一方、FKBP51はFKBP52と競合的にERαに結合することでERαの分解を促進することが示唆されました。
カルシニューリン脱リン酸化酵素によるエストロゲン受容体の安定化・活性化機構
乳がんの再発に関わる新たな制御因子としてカルシニューリンを発見し、悪性腫瘍の再発に密接に関連するエストロゲン受容体の機能をカルシニューリンが増強するメカニズムを明らかにしました。カルシニューリンはカルシウムシグナルを仲介する重要な脱リン酸化酵素であり、免疫抑制剤FK506の標的分子として臨床的にも重要であることが知られています。カルシニューリンはがん細胞の増殖を促進させる機能を持つことが報告されていましたが、がん患者さんの予後との相関関係については未解明な状況にありました。本研究では、再発性乳がんに着目し、カルシニューリンが高発現していると内分泌治療後の乳がんの再発率が高くなり、予後不良となることを発見しました(図1)。カルシニューリンは、(1)エストロゲン受容体を脱リン酸化することで、エストロゲン受容体の分解を防ぐこと、(2)mTORキナーゼを介してエストロゲン受容体の活性を促進すること、の2つの作用により、エストロゲン受容体の機能を増強することが判明しました(図2, 3)。今回の研究成果は、エストロゲン受容体陽性乳がんの患者さんに対して抗エストロゲン療法を施した場合、再発するメカニズムに対して理解を深めることとなり、新たなバイオマーカー、効果的な治療法開発へと展開することが期待できます(Masaki and Habara et al.,PNAS, 2021)。
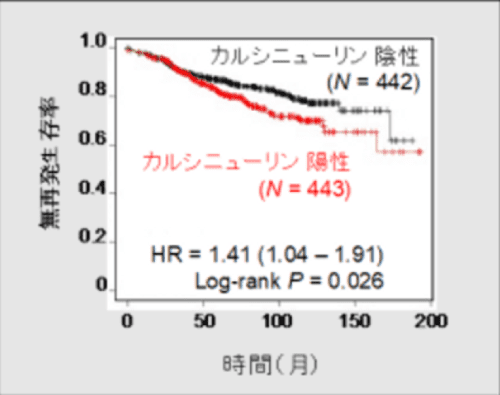
図1 カルシニューリンの発現量と予後の相関
エストロゲン陽性乳がんの患者さんに対して内分泌治療を行った場合、カルシニューリンが高発現していると、予後不良となります。
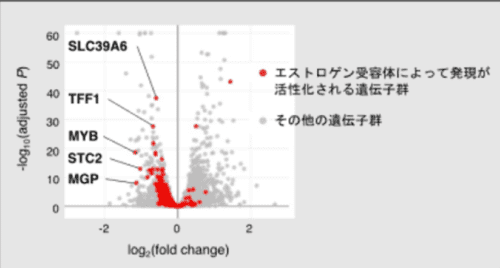
図2 カルシニューリンがエストロゲン応答遺伝子の発現に与える影響
カルシニューリンの新たな機能を明らかにするためにRNAシークエンシングを行い、カルシニューリンの発現抑制によって変動する遺伝子群を同定しました。その結果、カルシニューリン発現抑制細胞では、エストロゲン受容体によって発現が活性化される遺伝子群が減少していることが分かりました。
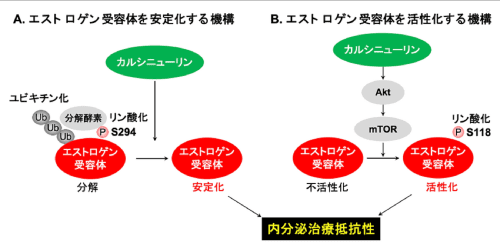
図3 カルシニューリンによるエストロゲン受容体の制御
(A) カルシニューリンによるエストロゲン受容体を安定化する機構:カルシニューリンはエストロゲン受容体の294番目のセリン(S294)を脱リン酸化することにより、分解酵素E6APとの結合およびユビキチン化による分解を阻害し、エストロゲン受容体を安定化します。(B) カルシニューリンによるエストロゲン受容体を活性化する機構:カルシニューリンはAkt, mTORの上流で機能し、エストロゲン受容体の活性化に重要です。
がんで高活性化しているサイクリンD1の発現調節機構
多くのがんでは、サイクリンD1が過剰発現しており、がんの悪性度・転移と相関することが報告されています。がんでサイクリンD1が過剰発現する主な原因は、サイクリンD1の分解異常です。難治性乳がんで高活性化しているカルシニューリンが、サイクリンD1のThr286を脱リン酸化することによってサイクリンD1の分解を抑制し、G1/S期の進行を促進していることを明らかとしました(Goshima et al., Sci. Rep., 2019)。
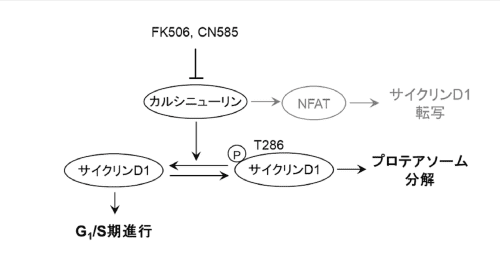
図 カルシニューリンによるサイクリンD1の制御
カルシニューリンがサイクリンD1のT286を脱リン酸化することで、サイクリンD1の分解を抑制し、G1/S期の進行を促進していることを明らかにしました。
DNA損傷チェックポイントを標的とした新たな治療法開発
DNA損傷チェックポイントを標的とするシード化合物CBP-93782がATR-Chk1経路の活性化を抑制し、G2/M期チェックポイントの維持を阻害することを発見しました(Hirokawa et al., Cancer Res., 2014)。さらに大腸癌および膵癌においてCBP-93782と化学療法を併用することで、顕著に細胞死を誘導できることを見出しました(Iwata et al., PLOS ONE, 2017)。
発がんに寄与する
ゲノム安定性維持機構解明
DNA損傷チェックポイントによる細胞増殖・発がん制御
分裂酵母を用いた解析によって、DNA複製因子がDNA損傷チェックポイントに必要であることを発見しました(Shimada et al., Mol. Biol. Cell, 1998)。さらに研究対象を哺乳類広げてDNA損傷応答のマスター因子Chk1/Chk2 (checkpoint kinase 1/2)二重変異マウスは、チェックポイントとアポトーシスの二つの経路が異常になることにより、発がんが増加することを示しました(Niida et al., EMBO J., 2010)。
エピジェネティック修飾による発がん制御
Chk1の変異は、ゲノム不安定化を引き起こして発がんを誘発します。一方でChk1は特定のがんでは高活性化しており、細胞増殖促進やがんの悪性度に寄与します。これまで不明であったChk1の細胞増殖を促進する機能として、ヒストンのリン酸化を介した増殖関連遺伝子の転写活性化を発見しました(Shimada et al., Cell, 2008, Shimada et al., Cell Cycle, 2008)。またPP1脱リン酸化酵素がDNA損傷後に活性化されることで、増殖関連遺伝子の転写を抑制することを見出しました(Shimada et al., EMBO Rep., 2010)。さらにPP1の活性調節に重要な制御因子としてNIPP1を同定し、その調節機構を明らかにしました(Hanaki et al., Cancer Sci., 2021)。
細胞分裂期における娘細胞への均等な染色体分配は、安定的な遺伝情報の維持に必須であり、AuroraBキナーゼが染色体分配の制御に中心的な役割を果たしています。新たなエピジェネティック修飾であるヒストンH2AXのSer121のリン酸化を発見し、このリン酸化がAurora Bの時空間的な活性化調節に重要であることを明らかにしました(Shimada et al., Nat. Commun., 2016)。
適切な細胞増殖に
必要なチェックポイント機構の
提唱と分子機構解明
減数分裂組換えチェックポイント機構
減数分裂の中で相同染色体の組換えは、遺伝的多様性を生み出すことおよび組換え過程で生じるキアズマ構造が正常な減数分裂期の染色体分配に必須です。細胞周期の監視機構であるチェックポイントは体細胞分裂では詳しく調べられていましたが、減数分裂ではほとんど分かっていませんでした。減数分裂組換え時に生じるDNA二本鎖切断の修復状態を監視する減数分裂組換えチェックポイント機構が存在することを提唱し、正常な配偶子形成に必要であることを示しました(Shimada et al., EMBO J., 2002)。
RNAの代謝異常を監視するチェックポイント機構
スプライシングの破綻によって蓄積した異常なRNAが、サイクリンB1の分解を阻害し分裂期の開始を抑制する、RNAの代謝異常を監視するチェックポイント機構を提唱しました(Shimada et al., J. Biol. Chem., 2005)。


