Research themes
- 薬物性副作用の動物モデルの作出と発症メカニズムの解明研究
- 薬物性肝障害を予測するin vitro試験系の開発研究
- アシルグルクロナイドの毒性についての研究
- Non-coding RNAが薬物動態・毒性発現に及ぼす影響の研究
- 薬の副作用バイオマーカーとしてのnon-coding RNAの研究
- 薬による重篤な皮膚障害を発症のメカニズムの解明研究
1【薬による副作用発現の背景】
医薬品の開発や安全な臨床使用を妨げる最大の課題は、予測が困難な毒性・副作用 の発現にあると言っても過言ではありません。薬を投与されたヒトの約10%に何らかの副作用が発現しているというFDAの統計もあります。さらに、薬の副 作用に起因する死亡が死因の4番目であるという米国の統計も出され、その社会的損失は膨大であり、薬の安全性を確保する研究の必要性が強く認識されていま す。創薬は定めた薬効標的に対する効果の評価により進められ、細胞系や実験動物を用いて研究されますが、薬の副作用や毒性は、薬理や薬効に関係なく発現す る場合が多く、薬物代謝動態に依存していることが知られています。しかし、様々な薬物動態関連因子には、大きな種差と個人差が存在し、これらに起因する毒 性・副作用発現により、優れた候補化合物であって臨床試験が中断される場合が少なくありません。これはヒトにおける毒性・副作用発現を予測するための適切 な試験系が確立していないために生じます。こうした問題を科学的に解決し、社会に資する研究の推進が期待されています。
2【薬の解毒と副作用発現反応】
ヒトは高い解毒能を有しており、薬は異物として速やかに解毒されます。一般に、投与された薬の約10%が薬効を発揮するために使われ、残りは速やかに解 毒排泄されます。肝臓は薬を解毒する主要な臓器であり、薬物代謝酵素、特にシトクロムP450が中心となって薬を解毒します。しかし、P450などの代謝 酵素は、解毒と同時に「代謝的活性化」と謂われる反応により、毒性代謝物(反応性中間体)に変換する反応も触媒する場合が少なくありません。その為に薬の 副作用や毒性は主に肝臓に発現しやすく、さらに、問題となる重篤な肝毒性発現は、その頻度が数千から1万例に1件と頻度が極めて低いために、市販後に初め て検出される場合が多く、患者保護と企業経営上の問題を大きくしています。P450による代謝的活性化反応によって生成された「反応性中間体」は、図1にありますように核酸や細胞構成蛋白質などに強く結合し、遺伝毒性、細胞機能障害、臓器障害、アレルギーなど極めて多様な毒性を発現します。
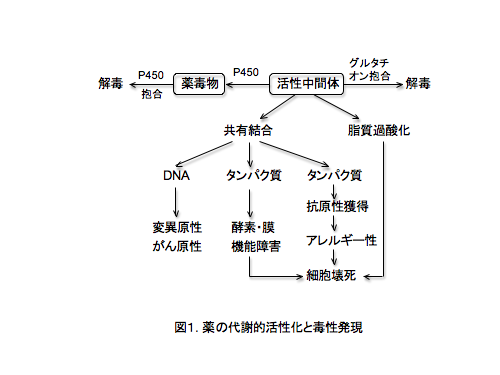
3【薬の副作用の軽減・回避・予測手法】
近年の薬物代謝動態分野の研究の顕著な発展に伴って、臨床試験での 開発中止が、薬物動態に起因するケースは、1991から2011年で、40%から1%へと激減しました。しかし、副作用・毒性発現に起因する開発中止ケー スは、継続的に約20%と高水準のままです。これには、薬の毒性発現には代謝動態関連因子が深く関わっており、その知識が活かされていないことが原因であ ると考えられます。そこで、私共の研究室では、実験動物とヒトとの「種差」と、ヒトの大きな「個人差」を科学し、克服する研究を目指しています。その為に は、実験動物のin vivoでの肝障害モデルを確立すること、実験動物由来細胞およびヒト由来細胞のin vitro試験系を構築してデータを蓄積し、さらに、毒性の新規発現機序について分子生物学的手法などを用いて検証し、最終的にはヒトin vivoを予測することを目指します。
代表的な研究手法としては、(1) 市販で入手可能であるヒト肝臓組織やヒトヘパトサイトおよび実験動物やそのヘパトサイトを駆使して、被験薬の代謝と毒性を検討します。(2) 代謝物を分析し、構造を明らかにし、さらに代謝酵素を明らかにします。(3) 代謝酵素のリコンビナント発現系を作成して、それらを用いて定量的に反応を検討し、種差と個人差を説明することが可能になります。しかしながら、このよう な手法によって毒性回避手段を提案できる場合は稀であり、極めて複雑な機構が関与している為に、依然として多くの薬において、様々な特異体質性 (idiosyncratic)と謂われる未解明の副作用事例が多く報告され続けています。
4【免疫炎症因子と薬物性肝障害】
私共は薬物性肝障害の発症予測のヒトへの予測性が悪い原因として、 免疫学的な因子の関与を明らかにしてきましたので紹介させて頂きます。ヒトにおける肝障害発症が知られている臨床使用薬について、野生型マウスへの薬の投 与法を工夫して、肝障害モデルを作製することにより研究を進め、ハロタンにはTh17細胞が関与することを明らかにしました。その後、ジクロキサシリン、 フルタミドやメチマゾールによる肝障害発症にはTh2細胞が主に関与していることを報告しました。さらに、α-ナフチルイソチオシアネート、ジクロフェナ クやフルクロキサシリンによる肝障害にはTh17細胞が関与することを明らかにしました。こうした検討結果は、いずれも単回経口投与による急性毒性モデル であり、臨床での一般的な連投による稀な肝障害の発症とは異なると考えられますが、発症機序の予測の研究手段を提供で、ヒトin vitroのスルリーニング系の構築に役立っています。
鎮痙薬であるカルバマゼピン (CBZ) は、稀に肝障害を惹起し、アレルギー症状が伴う臨床報告もあります。私共はCBZを野生型マウスに連続経口投与する方法を工夫して、重篤な肝障害発症モデ ルを確立しました。CBZと4種類の主たる代謝物のマウス血中濃度は、1.5-3時間で最大を示し、CYP阻害薬であるトロレアンドマイシンを併用投与す ると肝障害が増悪し、その時の血中濃度の測定から、3位水酸化CBZの関与が強く示唆されました。発症機構を解析した結果、RAGE (receptor for advanced glycation endproduct) や低分子カルシウム結合性蛋白質であるS100A8およびS100A9を介したTLR4 (toll-like receptor 4) の関与が考えられ、各種抗体を用いた肝障害マウスin vivoにおける中和反応は、肝障害を充分に抑制しました。さらに、炎症性サイトカインやケモカインの関与として、Th17細胞が肝障害の増悪に主たる役 割を担っていることを明らかにしました (図2)。このような肝障害モデルマウスの作製と発症機序解明は、臨床における特異体質性薬物性肝障害の回避に繋がる情報を提供できると考えられます。さらに、免疫炎症因子を考慮した、細胞スクリーニング系の立ち上げを行い、類似化合物への適用を提案することができました。
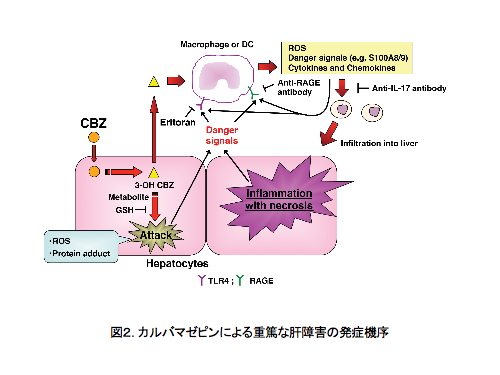
以 上、薬物性肝障害を中心に研究内容の一部を紹介しましたが、薬物性の腎臓や血液障害および重篤な皮膚障害などの研究にも取り組んでいます。さらに、Non-coding RNAに注目をして、薬物代謝酵素の機能との関わりのメカニズム解明の研究も行っています。今後、薬による副作用の基礎研究を発展させ、臨床に資する研究 成果を目指しています。
 名古屋大学大学院医学系研究科統合医薬学領域
名古屋大学大学院医学系研究科統合医薬学領域