腫瘍溶解性ウイルスは「抗がん剤」と成り得るか?
私たちは腫瘍溶解性ウイルスに関係した基礎実験と臨床試験を主な研究テーマとし、基礎的な研究データを元にそれを臨床試験に反映させる事 (translational research) を目的としています。従いまして診断学というよりは治療学というべき分野であると思います。腫瘍溶解性ウイルスとして臨床試験で使用しているのは西山教授(名古屋大学ウイルス学)の下で開発されたヘルペスウイルス/HF10ですが、基礎実験ではそれ以外にも各種のHSV系列のウイルスを使用しています。今後もこの新規の分野の研究を進め、その遺伝子変異に起因する腫瘍特異的な破壊性を利用して、新薬の開発に寄与したいと考えています。
これまでの研究
腫瘍溶解性ウイルスは、遺伝子治療が脚光を浴びた今から10年ほど前、遺伝子治療の亜系として着目されました。それまでのウイルスベクターが自己増殖能を持たず、「治療遺伝子を癌細胞に導入する事で癌の死滅を誘導する」物であったのに対し、腫瘍溶解性ウイルスは一部の遺伝子が変異し、癌細胞内での自己増殖能を維持して癌細胞の中でその数を増やし、「周囲の癌細胞に自己感染していく事で殺細胞効果を示す」という、それまでのウイルスベクターとは一線を画す物でした。名古屋大学消化器外科学では、1996年に粕谷 英樹が名古屋大学ウイルス学の西山教授のもとで腫瘍溶解性ウイルスの研究を始め、1999年に名古屋大学として初めて、癌に対する腫瘍溶解性ウイルスの論文が学術誌に掲載されました。その後消化器外科学の中でこの腫瘍溶解性ウイルスの研究は、木全 秀人、勅使河原 修、下山 理史、渡辺 出、野村 尚弘、鹿野 敏雄、城田 高、神崎 章之と引き継がれ、現在はトルコからの留学生、Dr. Tevfik T. Sahinが加わっています。以下にそれぞれの研究内容に関して述べますが、先にヘルペス腫瘍溶解性ウイルスについて、HF10の構造式とhrR3にGFPを入れたタイプの物を使用した腫瘍溶解の経時的変化をお示ししたいと思います。
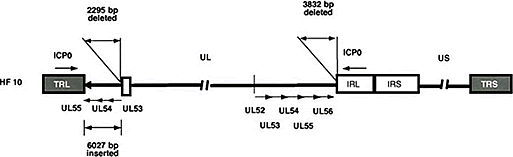
図1:構造図:HF10
図1について
構造学的には、UL56が欠損しUL53-56が反転した状態で左側のTRL近傍に再挿入されているattenuated virusです。ゲノムLong領域の両端に大きな欠損があって、変異の安定性が高く、アクセサリー遺伝子であるUL56、UL55、UL43、UL49.5、LATの発現が欠損していることが分かっています。
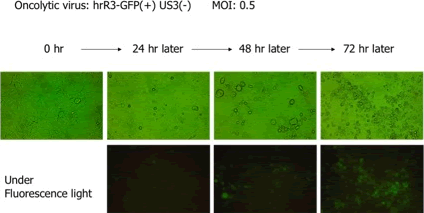
図2
図2について
上段はウイルスの感染が広がるに連れて細胞が破壊されていくのを示し、下段は同一の画像でGFPを発光しながらウイルスが増殖していくのを示しています。
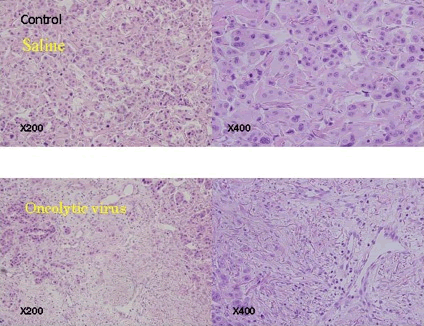
図3
図3について
臨床試験においてもウイルスによる変化がみてとれます。上段はコントロールとして生理食塩水を注射した物で、下段はウイルスを注射した再発結節です。癌細胞が溶けて癒合したような変化が見られます。対象は、皮膚または皮下への再発がみられた乳癌患者6例です。腫瘍径はいずれも1〜2cmでした。HF10は、1×10 (4) pfu/0.5ml, 1×10 (5) pfu/0.5ml, 5×10 (5) pfu/0.5mlのいずれかを1回又は3日間連続して転移巣に直接注入しました。投与2週間後に注入部位を切除し、病原学的効果を評価しました。尚、安全性を考慮し、予め血液中のヘルペス抗体価を測定し、抗体陽性例のみを本試験の対象としました。組織学的効果はgrade 1a(やや有効、軽度の効果)が1例、grade 1b(やや有効、中等度の効果)が2例、grade 2(かなり有効)が1例、grade 2〜3(かなり有効〜著抗)が1例でした。grade2〜3の症例の組織像では、癌細胞がほぼ100%破壊されており、蛍光抗体法で核内にウイルス抗原が局在している状況が観察されました。また、白血球数の変動、発熱などの全身症状や注射部位の発赤、痛みといった局在症状は全く認められませんでした。以上より、HF10は再発乳癌の転移巣に対して優れた癌細胞破壊効果を示し、かつ安全性も良好であることが示されました。(Pilot study of oncolytic viral therapy using mutant herpes simplex virus (HF10) against recurrent metastatic breast cancer. Kimata H, et al. Ann Surg Oncol. 2006 Aug;13(8):1078-84. Epub 2006 Jul 24)
上記の結果を踏まえて現在、非切除進行膵癌に対して腫瘍溶解性ウイルスHF10を使用した臨床試験を遂行中です。
臨床実験を行うにはその有効性や可能性に関して多くの基礎実験を試行していく必要があります。そうして積み上げられた基礎的なデータを元に新たな試みが模索されます。
研究内容
粕谷 英樹
hrR3というHSV変異株が、腫瘍特異的であり、マウスの中で膵癌細胞においてのみ増殖可能であった事を腹膜播種モデルにて示しました。特に卵巣細胞近傍の播種細胞でも生殖細胞内ではなく、癌腫のみでウイルスの増殖が確認された事を示しています。生存率の改善も示しています。(Kasuya H, Nishiyama Y, Nomoto S, Hosono J, Takeda S, Nakao A. Intraperitoneal delivery of hrR3 and ganciclovir prolongs survival in mice with disseminated pancreatic cancer. J Surg Oncol. 1999 Nov;72(3):136-41)。
粕谷 英樹
DF3プロモーターでDriveされるヘルペスウイルスの研究では、グリコプロテインMUC-1が豊富に産生される膵癌や乳癌などの環境でのみ増殖可能なウイルスを作成して、その腫瘍選択的な抗腫瘍効果を検討しました。(Kasuya H, Pawlik TM, Mullen JT, Donahue JM, Nakamura H, Chandrasekhar S, Kawasaki H, Choi E, Tanabe KK. Selectivity of an oncolytic herpes simplex virus for cells expressing the DF3/MUC1 antigen. Cancer Res. 2004 Apr 1;64(7):2561-7)
粕谷 英樹
L1BR1というウイルスを使用した実験では、このウイルスがアポトーシスに関係した遺伝子を不活化するため、抗癌剤の刺激で腫瘍のアポトーシス反応を増進させることを示しました。 (Kasuya H, Nishiyama Y, Nomoto S, Goshima F, Takeda S, Watanabe I, Nomura N, Shikano T, Fujii T, Kanazumi N, Nakao A. Suitability of a US3-inactivated HSV mutant (L1BR1) as oncolytic virus for pancreatic cancer therapy. Cancer Gene Ther 2007 Jun;14(6):533-42)
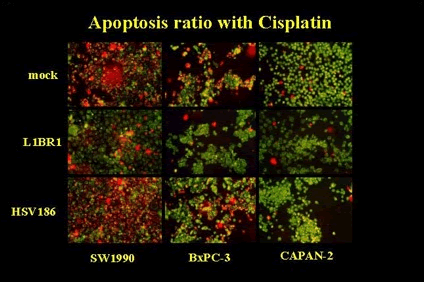
図4
木全 秀人
HF10を使用した基礎実験で、大腸癌の腹膜播種モデルの生存率の改善、抗腫瘍効果を示すとともに、初めて腫瘍溶解性ウイルスと宿主の抗腫瘍免疫の関係についての実験的記述を残しました。(Kimata H, Takakuwa H, Goshima F, Teshigahara O, Nakao A, Kurata T, Sata T, Nishiyama Y Effective treatment of disseminated peritoneal colon cancer with new replication-competent herpes simplex viruses. Hepatogastroenterology. 2003 Jul-Aug;50(52):961-6.)
勅使河原 修
人の乳癌細胞株2種類を使用して、その細胞におけるHF10の作用の違いについて検討しました。乳癌での臨床試験におけるback groundとなる多くのデータを残しました。(Teshigahara O, Goshima F, Takao K, Kohno S, Kimata H, Nakao A, Nishiyama Y. J Oncolytic viral therapy for breast cancer with herpes simplex virus type 1 mutant HF 10. Surg Oncol. 2004 Jan;85(1):42-7.)
下山 理史
大腸癌の腹膜播種モデルを作製してHF10とパクリタキセルとの併用療法について研究し、腫瘍溶解性ウイルスと既存の抗癌剤との併用が生存率の改善に有効であり、パクリタキセルがウイルスに対してどのような影響を与えるのかを示しました。(Shimoyama S, Goshima F, Teshigahara O, Kasuya H, Kodera Y, Nakao A, Nishiyama Y. Enhanced efficacy of herpes simplex virus mutant HF10 combined with paclitaxel in peritoneal cancer dissemination models. Hepatogastroenterology. 2007 Jun;54(76):1038-42.)
渡辺 出
腫瘍溶解性ウイルスであるhrR3とGEM (Gemcitabine)との併用療法について研究しました。hrR3はRR (Ribonucleotide reductase)欠損株であるため、RRと作用上で関連しているGEMとの併用療法には障害があることを示しました。(Watanabe I, Kasuya H, Nomura N, Kanazumi N,Takeda S, Nomoto S, Shikano T, Shirota T, Sugimoto H, Nakao A. Effects of tumor selective replication-competent herpes viruses in combination with gemcitabine on pancreatic cancer. Cancer Chemoth Pharm. Apr; 61(5):875-82, 2008. )
野村 尚弘
今まで腫瘍溶解性ウイルスの投与経路は腫瘍への直接投与もしくは腹膜播種に対する腹腔内投与でしたが、今後の発展を考えると、末梢血管からの全身投与による抗腫瘍効果の研究は不可欠な物でした。そこで、血中のウイルス抗体の攻撃による不活化も含めて幅広い研究を行いました。(Nomura N, Kasuya H, Watanabe I, Shikano T, Shirota T, Misawa M, Sugimoto H, Kanazumi N, Nomoto S, Takeda S, Nakao A. Considerations for intravascular administration of oncolytic herpes virus for the treatment of multiple liver metastases. Cancer Chemother Pharmacol. Jan; 63(2): 321-30, 2009.)
鹿野 敏雄
全身投与による可能性を探るための一つの方法として、ウイルスをリポフェクタアミンという油膜の中に包み込んで静注することを検討しました。油膜に包むことで抗体からの攻撃を避けることができ、腫瘍血管に集積してそこから腫瘍内に侵入することが確認されました。
城田 高
抗腫瘍免疫の励起という観点から、腫瘍溶解性ウイルスの投与による免疫細胞の動きについての研究を行い、CD4/CD8/マクロファージ/デンドリック細胞などの腫瘍組織内への侵入と生存率の関わりについて検討し、獲得免疫に関するブースト効果を示しました。
神崎 章之
全身投与に関する研究を行っています。より効果的な方法を求めて、旧来のリポフェクタミンでウイルスを埋包する代わりとなる、ウイルスの運搬方法について研究しています。
Tevfik T. Sahin
抗癌剤と腫瘍溶解性ウイルスとの併用療法による腫瘍増殖抑制効果をin vitroでimaging化にて示すこと、血管増殖抑制因子と腫瘍溶解性ウイルスの併用による腫瘍血管増殖抑制効果と抗腫瘍効果をin vivoにて検出することを研究しています。

