研究室紹介Laboratories
- Back
- Top > 研究室紹介 > がん分子病因・病態学(連携) > がん病態生理学(愛知県がんセンター)
がん分子病因・病態学(連携)がん病態生理学(愛知県がんセンター)
概要
がん病態生理学講座では、がんと宿主との相互作用に着目し、個体レベルでのがん研究を推進しています。がんは我々の体を構成する細胞(体細胞)に遺伝子の質的・量的な異常が積み重なって発生し、さらに進展(悪性化)していきます。私たちは、主に遺伝子改変によって作り出した、がんを自然発症するマウス(がんマウスモデル)を用いて、がんが進展して転移するに至る過程において、がん細胞と宿主細胞との間にどのような相互作用が働いているのか、そしてがんが宿主にどのような影響を及ぼすかについて研究を実施しています。大きな研究テーマは、(1)がん微小環境の役割の解明、(2)転移の分子メカニズムの解明と予防・治療標的の探索、(3)がん悪液質の病態生理解明と治療戦略の基盤構築という3つです。これらの研究成果を、がんの新しい予防・治療法の開発につなげることを目指しています。
研究プロジェクト
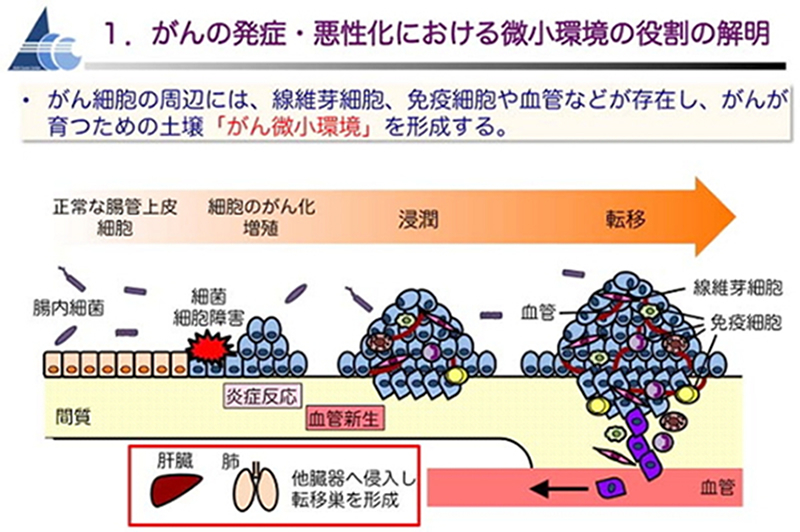
1. がん微小環境の役割の解明
がん細胞の周辺には、線維芽細胞、マクロファージ・リンパ球などの免疫細胞、血管細胞など様々な細胞が存在し、がんが育つための土壌「がん微小環境」を形成しています。がん細胞は、この微小環境を上手に利用して、腫瘍の成長や浸潤・転移の手助けをさせていると考えられています。
私たちは、腸管に良性の腺腫性ポリープを発症するマウスや、肝転移を生じる悪性の大腸がんを発症するマウスなど、遺伝子改変による固形がんのマウスモデルを用いて、がん微小環境の多彩な細胞やそれらに関連するシグナル伝達経路が、がんの悪性化進展や薬剤抵抗性獲得等に果たす役割について詳細に研究しています。 大腸がんについては、JNK/mTORC1経路・MEK/ERK経路・EGFR経路・Wnt経路・Hedgehog経路の役割、自然免疫系・腸内細菌・低酸素環境の役割、内分泌・代謝調節の役割等を解明すべく、研究を展開しています。
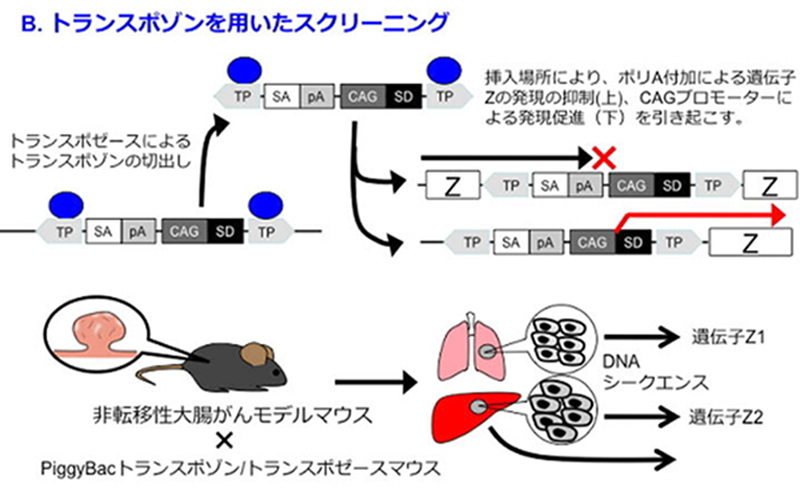
2. 転移の分子メカニズムの解明
大腸がんによる死因の約9割が転移によるものであるとされます。しかしながら、転移の分子メカニズムは十分に解明されておらず、治療標的となる分子の同定も遅れています。浸潤・転移は、生体内で(1)局所浸潤、(2)脈管侵入、(3)脈管内輸送、(4)管外遊出、(5)微小転移巣形成、(6)転移増殖の6つの連続した生物学的プロセスを経ますが、この浸潤・転移プロセスの進行は、転移促進因子と転移抑制因子が複雑に相互作用することにより制御されると考えられています。
私たちは、レンチウイルスshRNAライブラリーを用いたスクリーニング法(A)と、トランスポゾンを用いたスクリーニング法(B)を用いて、大腸がんの転移を制御する因子を、生体での機能に基づいて同定し、それらの治療標的としての妥当性を検証する研究を行っています。

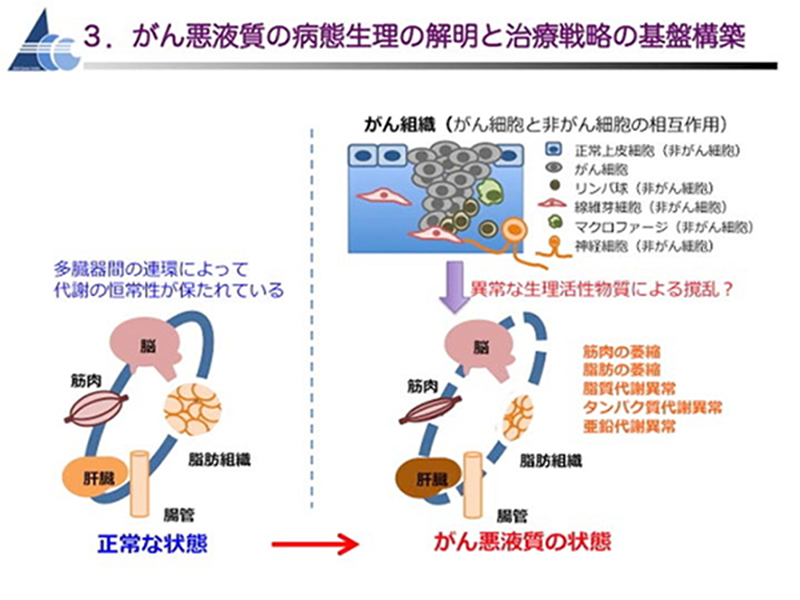
3. がん悪液質の病態生理の解明
悪液質は、骨格筋や脂肪組織の萎縮による進行性の体重減少を主徴とする症候群で、がん患者の90%に発症し、がん患者の約30%の直接死因と推定されています。しかしながら、悪液質の病態生理は未だに不明であり、有効な早期診断法や治療法も存在しません。私たちは、がん悪液質を、がんが原因となって肝臓・筋肉・脂肪組織などを含む多臓器間の連環が撹乱されて種々の代謝異常をきたした病態であるととらえ、ヒトの悪液質に非常によく似た病態を示す複数の悪液質マウスモデルを用いたマルチオミクス解析により、悪液質発症の原因をつきとめ、治療標的となる分子を同定する研究に取り組んでいます。
教員
| 構成員名 | 役職 | 所属 |
|---|---|---|
| 青木 正博 | がん病態生理学講座 連携教授 | 愛知県がんセンター研究所・がん病態生理学分野 |
研究実績
- 2019年
- Kojima Y, Kondo Y, Fujishita T, Mishiro-Sato E, Kajino-Sakamoto R, Taketo MM, Aoki M.: Stromal iodothyronine deiodinase 2 (DIO2) promotes the growth of intestinal tumors in ApcΔ716 mutant mice. Cancer Sci, 2019; 110: 2520-2528.
- Hijioka S, Sakuma K, Aoki M, Mizuno N, Kuwahara T, Okuno N, Hara K, Yatabe Y.: Clinical and in vitro studies of the correlation between MGMT and the effect of streptozocin in pancreatic NET. Cancer Chemother Pharmacol, 2019; 83: 43-52.
- Matsushita, A., Sato, T., Mukai, S., Fujishita, T., Mishiro, E, Aoki, M., Hasegawa, Y., Sekodo, Y.: TAZ activation by Hippo pathway dysregulation induces cytokine gene expression and promotes mesothelial cell transformation. Oncogene, 2019; 38: 1966-1978.
- Maeda A, Irie K, Ando H, Hasegawa A, Taniguchi H, Kadowaki S, Muro K, Tajika M, Aoki M, Inaguma K, Kajita M, Fujimura A, Fukushima S.: Associations among regorafenib concentrations, severe adverse reactions, and ABCG2 and OATP1B1 polymorphisms. Cancer Chemother Pharmacol, 2019; 83: 107-113.
- 2018年
- Sakuma K, Sasaki E, Kimura K, Komori K, Shimizu Y, Yatabe Y, Aoki M.: HNRNPLL, a newly identified colorectal cancer metastasis suppressor, modulates alternative splicing of CD44 during epithelial-mesenchymal transition. Gut, 2018; 67: 1103-1111.
- Sakuma K, Sasaki E, Kimura K, Komori K, Shimizu Y, Yatabe Y, Aoki M.: HNRNPLL stabilizes mRNAs for DNA replication proteins and promotes cell cycle progression in colorectal cancer cells.
- Cancer Sci, 2018; 109: 2458-2468.
- 2017年
- Fujishita T, Kojima Y, Kajino-Sakamoto R, Taketo MM, Aoki M. Tumor microenvironment confers mTOR inhibitor resistance in invasive intestinal adenocarcinoma. Oncogene, 2017; 36: 6480-6489.
- Satoh K, Yachida S, Sugimoto M, Oshima M, Nakagawa T, Akamoto S, Tabata S, Saitoh K, Kato K, Sato S, Igarashi K, Aizawa Y, Kajino-Sakamoto R, Kojima Y, Fujishita T, Enomoto A, Hirayama A, Ishikawa T, Taketo MM, Kushida Y, Haba R, Okano K, Tomita M, Suzuki Y, Fukuda S, Aoki M, Soga T.: Global metabolic reprogramming of colorectal cancer occurs at adenoma stage and is induced by MYC. PNAS, 2017; 114: 8289-8294.
- Maeda A, Ando H, Ura T, Komori A, Hasegawa A, Taniguchi H, Kadowaki S, Muro K, Tajika M, Kobara M, Matsuzaki M, Hashimoto N, Maeda M, Kojima Y, Aoki M, Kondo E, Mizutani A, Fujimura A. Association between and polymorphisms and adverse drug reactions to regorafenib: A preliminary study. Int J Clin Pharmacol Ther, 2017; 55: 409-415.
- Maeda A, Ando H, Ura T, Muro K, Aoki M, Saito K, Kondo E, Takahashi S, Ito Y, Mizuno Y, Fujimura A.: Differences in urinary renal failure biomarkers in cancer patients initially treated with cisplatin. Anticancer Res, 2017: 37: 5235-5339.
- Cao X, Kajino-Sakamoto R, Doss A, Aballay A.: Distinct Roles of Sensory Neurons in Mediating Pathogen Avoidance and Neuropeptide-Dependent Immune Regulation. Cell Rep, 2017; 21: 1442-1451.
- 2016年
- Hashimoto K, Simmons AN, Kajino-Sakamoto R, Tsuji Y, Ninomiya-Tsuji J. TAK1 regulates the Nrf2 antioxidant system through modulating p62/ SQSTM1. Antioxid Redox Signal, 2016; 25: 953-964.
- Hijiya N, Tsukamoto Y, Nakada C, Tung N, Kai T, Matsuura K, Shibata K, Inomata M, Uchida T, Tokunaga A, Amada K, Shirao K, Yamada Y, Mori H, Takeuchi I, Seto M, Aoki M, Takekawa M, Moriyama M. Genomic loss of DUSP4 contributes to the progression of intraepithelial neoplasm of pancreas to invasive carcinoma. Cancer Res, 2016; 76: 2612-2625.
- Simmons AN, Kajino-Sakamoto R, Ninomiya-Tsuji J.: TAK1 regulates Paneth cell integrity partly through blocking necroptosis. Cell Death Dis, 2016; 7:e2196.
- 2015年
- Fujishita T, Kajino-Sakamoto R, Kojima Y, Taketo MM, Aoki M. Antitumor activity of the MEK inhibitor trametinib on intestinal polyp formation in ApcΔ716 mice involves stromal COX-2. Cancer Sci, 2015; 106: 692-699.
- 2014年
- Hirai H, Fujishita T, Kurimoto K, Miyachi H, Kitano S, Inamoto S, Itatani Y, Saitou M, Maekawa T,Taketo MM. CCR1-mediated accumulation of myeloid cells in the liver microenvironment promoting mouse colon cancer metastasis. Clin Exp Metastasis, 2014; 31: 977-989.
- 2013年
- Patnode M, Yu S-Y, Cheng C-W, Ho M-Y, Tegesjo L, Sakuma K, Uchimura K, Khoo K-H, Kannagi R, Rosen S. KSGal6ST generates galactose-6-O-sulfate in high endothelial venules but does not contribute to L-selectin dependent lymphocyte homing. Glycobiology, 2013; 23: 381-394.
- Itatani Y, Kawada K, Fujishita T, Kakizaki F, Hirai H, Matsumoto T, Iwamoto M, Inamoto S, Hatano E, Hasegawa S, Maekawa T, Uemoto S, Sakai Y, Taketo MM. Loss of SMAD4 from colorectal cancer cells promotes CCL15 expression to recruit CCR1+ myeloid cells and facilitate liver metastasis. Gastroenterology, 2013; 145: 1064-1075.
- 2012年
- Sakuma K, Furuhashi T, Kondo S, Yabe U, Ohmori K, Ito H, Aoki M, Morita A, Kannagi R. Sialic acid cyclization of human Th homing receptor glycan associated with recurrent exacerbations of atopic dermatitis. J Dermatol Sci, 2012; 68: 187-193.
- Sakuma K, Aoki M, Kannagi R. Transcription factors c-MYC and CDX2 mediate E-selectin ligand expression in colon cancer cells undergoing EGF/bFGF-induced epithelial-mesenchymal transition. Proc Natl Acad Sci U S A, 2012, 109: 7776-7781.
- Miyazaki K, Sakuma K, Kawamura Y, Izawa M, Ohmori K, Mitsuki M, Yamaji T, Hashimoto Y, Suzuki A, Saito Y, Dohi T, Kannagi R.: Colonic epithelial cells express specific ligands for mucosal macrophage immunosuppressive receptors siglec-7 and -9. J Immunol, 2012; 188: 4690-700.
- Sakuma K, Chen GY, Aoki M, Kannagi R.: Induction of 6-sulfated glycans with cell adhesion activity via T-bet and GATA-3 in human helper T cells. Biochim Biophys Acta, 2012; 1820: 841-848.
- 2011年
- Fujishita T, Aoki M, Taketo MM.: JNK signaling promotes intestinal tumorigenesis through activation of mTOR complex 1 in ApcΔ716 mice. Gastroenterology, 2011; 140:1556-1563.
- Aoki K, Kakizaki F, Sakashita H, Manabe T, Aoki M, Taketo MM.: Suppression of colonic polyposis by homeoprotein CDX2 through its nontranscriptional function that stabilizes p27Kip1. Cancer Res, 2011; 71: 593-602.
- Sonoshita M, Aoki M, Fuwa H, Aoki K, Hosogi H, Sakai Y, Hashida H, Takabayashi A, Sasaki M, Robine S, Itoh K, Yoshioka K, Kakizaki F, Kitamura T, Oshima M, Taketo MM.: Suppression of colon cancer metastasis by Aes through inhibition of Notch signaling. Cancer Cell, 2011; 19: 125-137.
- Sun J, Singh V, Kajino-Sakamoto R, Aballay A. Neuronal GPCR controls innate immunity by regulating noncanonical unfolded protein response genes. Science, 2011; 332: 729-732.
- 2010年
- Kitamura T, Fujishita T, Loetscher P, Revesz L, Hashida H, Kizaka-Kndoh S, Aoki M, Taketo MM.: Inactivation of chemokine (C-C motif) receptor 1 (CCR1) suppresses colon cancer liver metastasis by blocking accumulation of immature myeloid cells in a mouse model. Proc Natl Acad Sci USA, 2010; 107: 13063-13068.
- Deguchi A, Miyoshi H, Kojima Y, Okawa K, Aoki M, Taketo MM.: LKB1 suppresses p21-activated kinase-1 (PAK1) by phosphorylation of Thr109 in the p21-binding domain. J Biol Chem, 2010; 285: 18282-18290.
- Kakizaki F, Aoki K, Miyoshi H, Carrasco N, Aoki M, Taketo MM.: CDX transcription factors positively regulate expression of Solute Carrier Family 5, Member 8 in the colonic epithelium. Gastroenterology, 2010;138: 627-635.
- Kajino-Sakamoto R, Omori E, Nighot PK, Blikslager AT, Matsumoto K, Ninomiya-Tsuji J. TGF-beta-activated kinase 1 signaling maintains intestinal integrity by preventing accumulation of reactive oxygen species in the intestinal epithelium. J Immunol, 2010; 185: 4729-4727.
- Kojima Y, Acar A, Eaton EN, Mellody KT, Scheel C, Ben-Porath I, Onder TT, Wang ZC, Richardson AL, Weinberg RA, Orimo A. Autocrine TGF-beta and stromal cell-derived factor-1 (SDF-1) signaling drives the evolution of tumor-promoting mammary stromal myofibroblasts. Proc Natl Acad Sci USA, 2010; 107: 20009-20014.
- 2009年
- Kitamura T, Biyajima K, Aoki M, Oshima M and Taketo MM. Matrix metalloproteinase 7 is required for tumor formation, but dispensable for invasion and fibrosis in SMAD4-deficient intestinal adenocarcinomas. Lab. Invest, 2009; 89: 98-105.
- Arimura S, Matsunaga A, Kitamura T, Aoki K, Aoki M, Taketo MM. Reduced level of Smoothened suppresses intestinal tumorigenesis by down-regulation of Wnt signaling. Gastroenterology, 2009; 137: 629-638.
- Miyoshi H, Deguchi A, Nakau M, Kojima Y, Mori A, Oshima M, Aoki M, Taketo MM. Hepatocellular carcinoma development induced by conditional beta-catenin activation in Lkb1 mice. Cancer Sci, 2009; 100: 2046-2053.
- Morioka S, Omori E, Kajino T, Kajino-Sakamoto R, Matsumoto K, Ninomiya-Tsuji J. TAK1 kinase determines TRAIL sensitivity by modulating reactive oxygen species and cIAP. Oncogene, 2009; 28: 2257-2265.
- Kim JY, Kajino-Sakamoto R, Omori E, Jobin C, Ninomiya-Tsuji J. Intestinal epithelial-derived TAK1 signaling is essential for cytoprotection against chemical-induced colitis. PLoS One, 2009; 4: e4561.
研究キーワード
がん、転移、微小環境、悪液質、マウスモデル
愛知県がんセンター研究所 がん病態生理学分野 独自ホームページ
大学院生募集
私たちと一緒に個体レベルでのがん研究に取り組みたいという熱意のある大学院生を募集しています!