はじめに
 研究活動の概要
研究活動の概要腫瘍生物学分野では、疾患発症に関わる遺伝子の制御異常のうち特にエピゲノム異常に焦点を絞り、その基礎研究を行うとともに、エピゲノム異常を標的とした診断・治療法の開発を目指し研究を行っています。例えばエピゲノム異常は細胞の分化・増殖の制御異常を介して発がんを誘導し、周囲環境に応じてがん細胞の性格を多彩に変化させ、悪性のがんとしての形質を獲得する過程に関与しています。エピゲノム異常の理解を深めることは有効ながん医療を生み出す手がかりとなり、エピゲノム異常の正常化もしくは制御をめざすことで新しい治療法を開発できると考えます。国内外の研究者と分野を超えて有機的な共同研究を行っており、その成果を臨床教室と共有してさらに練り上げることで実践的な応用を試みています。
 目指すもの
目指すもの私たちは、がんの基礎医学研究を実践することで、次世代のがん医療に貢献することを目指します。がん治療戦略を組み立てていく上で、分子生物学的な理解とその分子基盤に基づく診断・治療法の確立は、有効ながん医療の開発に欠かせません。
私たちの研究しているエピゲノム異常は、ほとんどすべてのがん細胞に存在するため、診断マーカーとしての有用性が高いと考えます。特にエピゲノムのうちDNAメチル化は安定した化学修飾であり、ヒト遺伝子の広範な領域でがん細胞に特異的な異常が検出されるため診断マーカーとして優れています。私たちはこの特性を活かしてがん診断マーカーの開発を行うとともに、微量に存在するDNAメチル化異常を高感度かつ簡便に解析できる新しい検出法の開発を行っています。一方、エピゲノム異常を標的とした治療薬は、これまでの分子標的薬と異なる作用機序をもった新しいクラスのがん治療薬として期待されています。実際に現在世界規模でエピゲノム治療薬の開発が加速度的に進んでいます。私たちの研究室でもがんエピゲノムを詳細に研究し、外部研究者との共同研究を通じて積極的に治療薬の開発を試みています。
がんに特異的なエピゲノム異常を“早期”に“確実”に捉えて診断に活用し、エピゲノム治療薬でがんの急所を抑える事ができれば、新たながん治療戦略を展開できると考えます。
研究内容の紹介
 がん細胞とエピジェネティクス
がん細胞とエピジェネティクス私たちの体を作っている細胞は、一つの受精卵が巧みに遺伝子(設計図)を使い(読み)分け、分裂を繰り返した後に、ある細胞は皮膚を作り、ある細胞は骨を作っていきます。このように遺伝子の使い方を決める仕組みを“エピジェネティクス”と言います。エピジェネティクスの概念は、ワトソン博士とクリック博士によるDNA二重らせんモデル(1953年)よりも早い1942年に、ワディントン博士によって、“causal mechanisms by which the genes of the genotype bring about phenotypic effects”として提唱されました。エピジェネティクスにはぴったりとした日本語訳がないため、片仮名表記されることがほとんどです。中国では「表現遺伝学」と表記されるようで、むしろこちらのほうがわかりやすいかもしれません。
クロマチン構造、ヒストン修飾、DNAメチル化、非翻訳RNA等エピジェネティクスを規定する因子はエピゲノムと呼ばれ、通常厳密に制御されています。しかし加齢や環境物質に曝露すると、その制御機構に化学的な傷がつきます(エピゲノム異常)。さらにエピゲノム異常が積み重なると、細胞ががん化すると考えられています。実際にがん細胞を調べてみると、ほとんどすべてのがん細胞からエピゲノム異常が検出され、がんの早期から進んだがんまでその個性に影響を与えています。
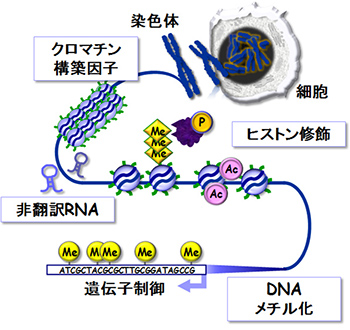 しかし、すべてのがん細胞からエピゲノム異常が検出されるということは、エピゲノム異常の検出は、がん早期診断への応用が期待できるということにもつながります。さらにエピゲノム異常は、「遺伝子変異」とは異なり、薬で元に戻る可能性が高いことがわかっているので、がん細胞でエピジェネティクスの正常化を目指せば、新しいがん治療につながります。
しかし、すべてのがん細胞からエピゲノム異常が検出されるということは、エピゲノム異常の検出は、がん早期診断への応用が期待できるということにもつながります。さらにエピゲノム異常は、「遺伝子変異」とは異なり、薬で元に戻る可能性が高いことがわかっているので、がん細胞でエピジェネティクスの正常化を目指せば、新しいがん治療につながります。
私たちはがん細胞のエピジェネティクス異常を、マイクロアレイや高速シークエンサーを用いて詳細に解析し、がんの診断に役立てる研究、さらに異常なエピジェネティクスを正常化させる新しいがん治療薬の開発に取り組んでいます。こうした取り組みから、発がんのメカニズムを解明することに加えて、実際のがん医療への応用を目指したがん研究を試みています。
平成23年度からは、文部科学省「次世代がん研究シーズ戦略的育成プログラム」に参画し、がんエピゲノムチームのチームリーダーとして革新的ながん医療の実現を目指し研究に取り組んでいます。(http://p-direct.mext.go.jp/program/group01/team04.html)
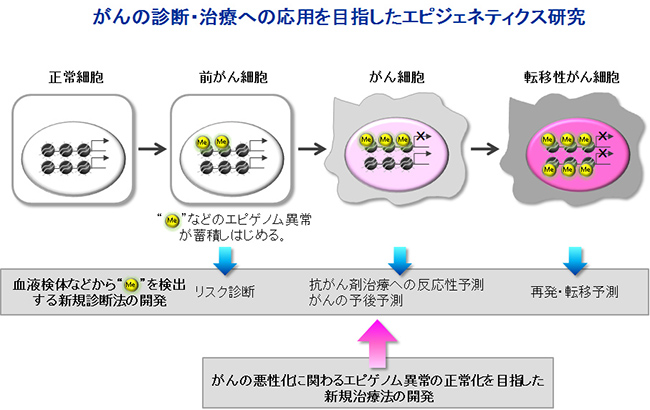
 がんの診断・治療への応用を目指したエピジェネティクス研究
がんの診断・治療への応用を目指したエピジェネティクス研究発がん物質や環境物質により、このDNAメチル化が異常におこることがあります。この場合は、がんを抑制するような遺伝子が異常なDNAメチル化によって正常の働きができなくなりがん化につながると考えられています。このDNAメチル化はがんの発生する段階から浸潤転移の段階に至るまでがんの性質に関わっています。そのため、異常なDNAメチル化を血液で発見することができれば、がんの診断が可能であると考えられます。欧米ではSeptin9という遺伝子が大腸がんの血液診断DNAメチル化マーカーとして認可され、実際に使用されています。
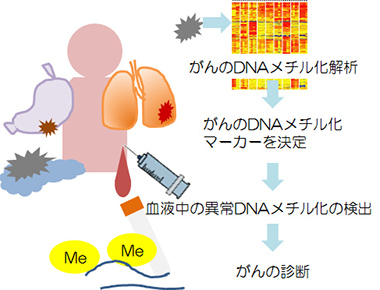 これまで私たちは大腸がん、肝臓がん、膵臓がん、肺がん、悪性胸膜中皮腫、などの様々な種類の悪性腫瘍においてDNAメチル化の網羅的解析を行い、それぞれの腫瘍で特徴的なDNAメチル化を示すことを見つけてきました。現在はこれらの結果から、血液でがんの早期診断が可能となるような、新しい血液診断法の確立を目指しています。血液中の微量なDNAメチル化を検出できるような革新的な検出法の開発も工学部と連携して行っています。
これまで私たちは大腸がん、肝臓がん、膵臓がん、肺がん、悪性胸膜中皮腫、などの様々な種類の悪性腫瘍においてDNAメチル化の網羅的解析を行い、それぞれの腫瘍で特徴的なDNAメチル化を示すことを見つけてきました。現在はこれらの結果から、血液でがんの早期診断が可能となるような、新しい血液診断法の確立を目指しています。血液中の微量なDNAメチル化を検出できるような革新的な検出法の開発も工学部と連携して行っています。
 慢性炎症によるDNAメチル化誘導機構の解明
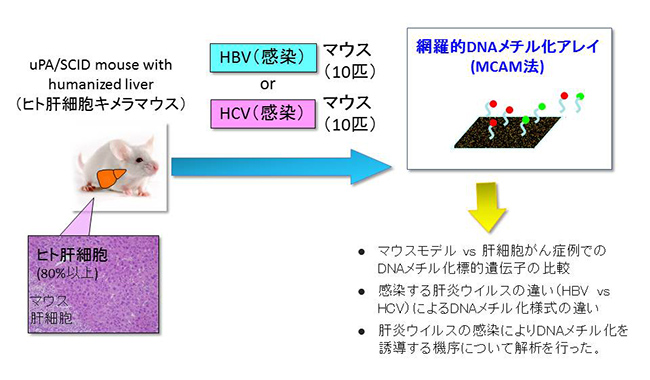
慢性炎症によるDNAメチル化誘導機構の解明発がんには環境要因による影響が深く関与していると考えられています。例えば遺伝毒性発がん物質は遺伝子(ゲノム)損傷を介した遺伝子変異を誘導します。興味深いことに、最近の大規模遺伝子解析から、がん細胞では、予測されたように増殖や生存に関わる遺伝子変異が存在していましたが、予想以上にエピゲノム制御遺伝子に変異が蓄積していることがわかってきました。これらの事実から、発がんにはゲノム異常によって誘導されるエピゲノム異常も重要であると考えられます。一方で環境要因のひとつとして、感染症による慢性炎症も発がんの原因となりえます。日本では多くの肝細胞がんは主にB型、C型肝炎ウイルス(HBV, HCV)による慢性肝炎を母地として発生することがわかっています。私たちを含めた国内外の研究室から慢性肝炎の状態でゲノムワイドにエピゲノム異常を蓄積しており、既に"前がん状態"を形成していることが報告されてきました。しかしHBVやHCVが感染後、どのような機序でエピゲノム異常を誘導するかについては、in vivo(生体内)では全く解析がなされていません。我々の研究室では、HBVおよび HCVが感染可能なヒト肝細胞キメラマウスを用いて解析を行いました。その結果、肝炎ウイルスの感染後、ナチュラルキラー細胞(NK細胞)を中心とした自然免疫系がIFNγの産生を介して、肝細胞にDNAメチル化異常を誘導することを見出しました。DNAメチル化異常は、感染日数の経過とともにより高度に蓄積し、とりわけ加齢関連DNAメチル化異常の亢進が顕著に認められました。不活化抗体を用いてNK細胞の機能抑制することでDNAメチル化異常の誘導は抑制されました。すなわちエピゲノム異常はゲノム異常のみならず種々の原因(本研究ではウイルス感染後の慢性炎症)で誘導されており、遺伝子の制御異常を介して発がんに関与している可能性が高いと考えます。今後、発がんに関わるエピジェネティクスの分子機構の解明から、その制御法の開発に向けた新たな可能性を探っていきたいと考えています。
 脳腫瘍幹細胞の分化制御に関わる非翻訳RNAに関する研究
脳腫瘍幹細胞の分化制御に関わる非翻訳RNAに関する研究一般に固形腫瘍は形質の異なる種々の細胞から構成され腫瘍内不均一性(組織多様性)を示します。がんの治療上、様々な性格を持った細胞集団から構成される組織多様性を示す腫瘍に対して、現在の治療法で根治に至ることが困難なことが多く依然として大きな問題となっています。私たちは組織多様性形成の機序について研究を行っています。
腫瘍内には、自己複製能を持つと同時に自己とは形質の異なる細胞へと分化する能力を併せ持った幹細胞様の性格を持つ細胞集団が存在します。このサブグループはがん幹細胞と呼ばれ、がん組織はがん幹細胞とそこから分化したがん細胞により構成されると提唱されています。私たちは組織多様性形成の背景に、がん幹細胞の存在とエピジェネティックな細胞調節機構が関与していると考え研究を行っています。
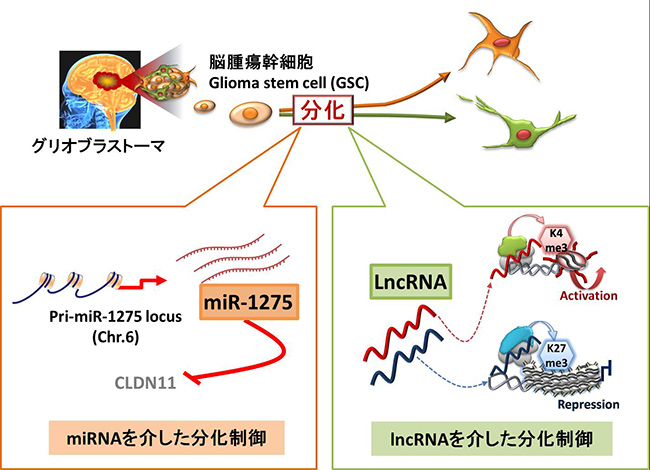
エピゲノムのうち非翻訳RNA(マイクロRNA, miRNA、 長鎖非翻訳RNA, long non-cording RNA, lncRNA)による遺伝子発現の制御は、細胞の分化や増殖などの様々な生命現象に深く関わっていることが明らかとなりました。我々はグリオブラストーマより樹立したがん幹細胞(Glioma stem-like cell, GSC)をモデルとし、GSC分化時における非翻訳RNA (miRNA, lncRNA)の発現変動に着目し、GSC分化制御に関わるエピゲノム制御機構を明らかにすることを目的とし研究を行っています。現在複数の非翻訳RNAがGSCの制御に関わっていることが分かってきました。
 神経膠腫の発生と進展に関わるエピジェネティクス異常の解析
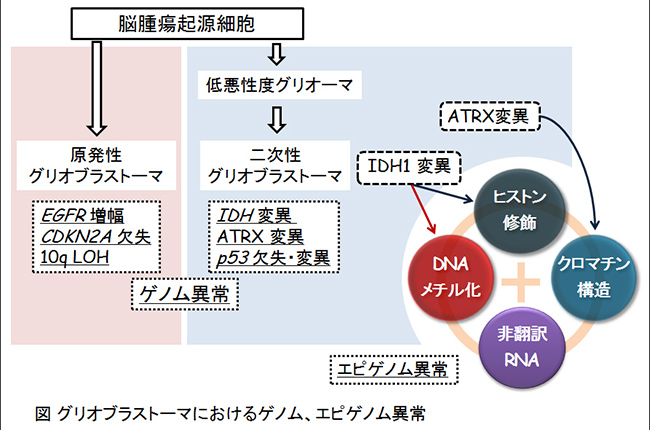
神経膠腫の発生と進展に関わるエピジェネティクス異常の解析神経膠腫(グリオーマ)のうち、膠芽腫 (グリオブラストーマ) は最も高頻度に見られる悪性の脳腫瘍で、いまだに根治に至ることが極めて困難な腫瘍のひとつです。手術後に化学療法や放射線治療が併用されますが、生存期間中央値は約15ヶ月間と短く、新規治療戦略の開発が期待されています。
最近の大規模な遺伝子解析から、グリオブラストーマは、①原発性グリオブラストーマと、②低悪性度グリオーマから多段階的に形成される二次性グリオブラストーマでは、それぞれ異なる遺伝子学的背景を持つことが明らかになってきました。すなわち、グリオブラストーマの中には、①②の発がんの分子機構が大きく異なる腫瘍群が混在していると考えられ、特に低悪性度グリオーマや二次性グリオブラストーマでは、エピゲノム関連遺伝子に変異が数多くみられることがわかっています。
がんはゲノム・エピゲノム異常を原因とする疾患で、脳腫瘍の発生にもエピジェネティクス異常の蓄積が発がんを誘導している可能性が高いと考えます。私たちは、脳腫瘍の発生と進展に関わるエピジェネティクス異常を同定することを目的として脳腫瘍自然発生マウスモデルを用いて解析を行い、さらに名古屋大学脳神経外科と共同してその分子機構を標的とした脳腫瘍の新規治療戦略の開発を目指しています。