EBVの腫瘍原性と宿主の生体応答/疾患発症メカニズムの解析
Epstein-Barr ウイルス (EBV) はほとんどの成人が感染しており、ときに慢性活動性EBV感染症、悪性リンパ腫や上咽頭がん・胃がんなどの腫瘍性疾患を引き起こします。EBVがもつ約80個の遺伝子は、感染細胞の増殖、タンパク質/DNAの産生や、免疫系からの回避、シグナル伝達や膜輸送系の制御など、自身の生存に重要な役割を担っていますが、その多くは分かっていません。本研究室では最先端の解析装置、実験手法を駆使し、EBVの増殖と宿主の生体応答/疾患の発症メカニズムを解析することで、EBV疾患の克服と共生への道を目指しています。私たちは本研究分野において世界をリードすると同時に、積極的に多業界とのコラボレーションで新しい可能性を展開します。
1.
身近なウイルスが「がん」を引き起こす仕組みの解明
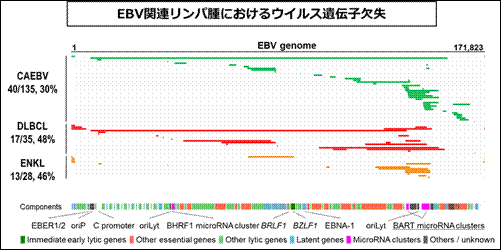
目的:ごく一部のヒトにおいて、EBVはがんやその他の難病を発症します。そのメカニズムを解明するために、患者の遺伝子とウイルスの遺伝子の両方を、次世代シーケンサーを用い網羅的遺伝子解析します。
内容:難治性のリンパ増殖性疾患である慢性活動性EBV感染症に関わるEBVは、いくつかの重要な遺伝子を欠失していることを見出しました。またこのような欠失EBVは他のEBV関連悪性リンパ腫でも見られること、欠失EBVはウイルス遺伝子発現を活性化させ、腫瘍化を促進していることを明らかにしました。(Okuno Y et al,. Nat Microbiol 2019)。
期待される成果:今回明らかになったウイルス発がんの仕組みに基づき、より良い治療法の開発が進むことが、今後期待されます。
2. 生命現象を利用し、細胞を乗っ取るEBVの生存を支えるタンパク質の研究
目的:EBVと宿主が互いに作り出すタンパク質同士のネットワークを明らかにし、ウイルスの生存に重要な「ハブタンパク質」を探索します。理論的計算科学分野における創発システム研究者と一体となり連携研究を行います。
内容:ヒト細胞内で起こるタンパク質間の相互作用を、次世代型発光テクノロジーを用いてリアルタイムかつ定量的に検出します。
期待される成果:感染細胞で起こるタンパク質間相互作用についての動的理解と、ネットワークの「ハブタンパク質」としての素性を解明し、分子標的薬のクリエイトを目指します。
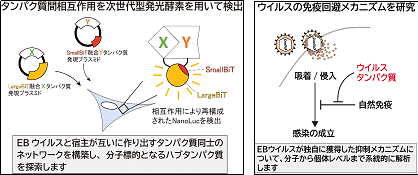
3. ウイルスはどうやって免疫反応から逃れている?
ウイルスの免疫回避メカニズムを研究
目的:ヒト細胞内では病原体の特異構造を認識し、免疫反応を誘導します。ヒトに病気を起こすウイルスの多くは、この免疫反応を抑制するシステムを進化的に獲得しています。感染から病気の発症の過程において、EBVが獲得したさまざまな免疫回避システムを実証します。
内容:免疫応答の誘導のきっかけを作るさまざまな核酸センサー分子、シグナル伝達との関係についてウイルス学、免疫学、薬理学などさまざまな分野の実験手法により推進します
(Watanabe T et al., J Virol 2015:
Watanabe T et al., Cancer Sci 2020) 。
期待される成果:ウイルス独自の強力な免疫抑制システムを分子レベルで理解することは、今後のワクチン開発に重要となるとともに、自己免疫疾患や新型コロナウイルス感染症によって引き起こされる過剰免疫反応を制御するための応用研究を創成します。
ウイルス感染に関わる宿主因子の包括的な探索
人類は常にウイルス感染に晒されています。病原性のないものから致死的なものまで様々なヒトに感染するウイルスが存在しますが、抗ウイルス薬が未だ存在しないウイルスがほとんどです。たとえ、抗ウイルス薬があったとしても、その大半はウイルス因子を標的としており、ウイルスの変異による薬剤耐性ウイルスが問題となります。ウイルスは自身単独では増殖出来ず、必ず宿主が必要になります。そのため、ウイルスが利用する宿主因子の同定およびその分子基盤の解明は、抗ウイルス薬の開発に非常重要な知見となります。
例えば、ヒト発癌ウイルスの一つであるEpstein-Barrウイルス(EBV)の遺伝子発現を制御する宿主因子の探索では、95種類のキナーゼ阻害剤小分子ライブラリーから複数のCyclin-dependent kinase (CDK) 阻害剤を同定しました。ウイルスタンパク質BDLF4は宿主CDK2によりリン酸化され、EBV遺伝子発現の時間的な制御をしていることを明らかにしました(Sato Y et al., J Virol
2019)。実際に、alsterpaullone 2-Cyanoethylおよびalsterpaulloneは、in vitroで抗EBV活性があるとされるガンシクロビル (ganciclovir; GCV) よりも低濃度でEBV感染性粒子産生を抑制しました(特願2017-250093・佐藤, 渡辺, 木村・抗ウイルス薬・名古屋大学・2017年12月26日)。
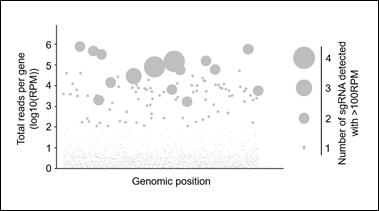
また、ヒト単純ヘルペスウイルスは2つの血清型(HSV-1とHSV-2)が存在し、ヒトに脳炎、口唇ヘルペス、性器ヘルペス、皮膚疾患、眼疾患など多彩な疾患を引き起こす臨床的に重要なウイルスです。HSV感染症にはアシクロビルなどの抗ヘルペスウイルス薬が存在するにもかかわらず、未だ臨床上の問題が多く存在するのはHSV感染の病態が十分に解明されていないことも原因の一つであり、これに迫るCRISPRスクリーニングを実施しています。HSV感染に抵抗性を示す細胞群を次世代シーケンサーで解析し、責任遺伝子を同定すると、いくつかの遺伝子が高度に濃縮されていることが明らかとなりました(図)。
私たちが構築している遺伝子欠損細胞ライブラリーは、CRISPR/Cas9システムを用いたもので、約19,000のヒト遺伝子をカバーしています。感染すると細胞死を引き起こすウイルスや、感染が成立すると蛍光タンパク質を発現する改変ウイルスなどを用いることで、ウイルス感染抵抗性を示す変異細胞を選択することができるため、様々なウイルス種に対して、感染に必要な宿主因子の同定が可能と考えています。
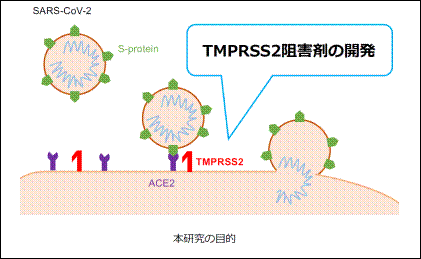
新型コロナウイルスの細胞内侵入に関わるTMPRSS2を阻害する分子の開発
2019年12月に中国
武漢市で患者が確認された新型コロナウイルス(SARS-CoV-2)による感染症
(COVID-19)は、短期間で世界中に拡散した。COVID-19は公衆衛生上の問題に留まらず、その影響は経済・文化など、私たちの生活様式を一変させるまでに至った。現時点(2020年12月)でも感染を制御できず、感染者は増加の一途を辿る。
SARS-CoV-2はエンベロープに存在するSpikeタンパク質(Sタンパク質)が、細胞膜に存在するACE2受容体に結合し、細胞内へ侵入し感染する。Sタンパク質はFurinと想定される宿主プロテアーゼによりS1とS2に切断される。S1は受容体であるACE2受容体に結合し、S2が細胞表面のセリンプロテアーゼTMPRSS2によって、さらに切断されることで、膜融合が進行する(Hoffman et al., Cell,
2020)。この膜融合は、急性膵炎治療薬であるセリンプロテアーゼ阻害剤のカモスタットやナファモスタットにより阻害されることが報告され(Hoffman et al., Cell,
2020; Yamamoto et al., Viruses,
2020)、臨床試験も始まっている。
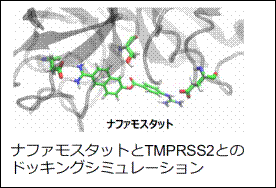
共同研究者の藤本和宏博士(名古屋大学 ITbM)がナファモスタットとTMPRSS2との結合をドッキングシミュレーションにより評価したところ、ナファモスタットはTMPRSS2の活性部位に強く結合することが予測された。さらに、ドッキングシミュレーションと共同研究者の佐藤綾人博士(名古屋大学 ITbM)による分子設計を繰り返すことで、ナファモスタットの官能基を適切に置換した誘導体がTMPRSS2に対してさらに強く結合することが予測された。計算結果をもとに、改良型ナファモスタットの合成に共同研究者の大松亨介博士(名古屋大学 ITbM)が成功し、その抗ウイルス効果を検討した(一部は、藤田医科大学 村田貴之教授との共同研究)。
改良型ナファモスタットは、新型コロナウイルス(SARS-CoV-2)および旧型コロナウイルス感染(HCoV-229EおよびHCoV-OC43)に伴う細胞変性効果をナファモスタットに比べて、より低濃度で抑制した(強い抗ウイルス効果を示した)。現在、本研究結果の論文を執筆中である。今後は改良型ナファモスタットがより強い抗ウイルス効果を示した分子メカニズムについて詳細に解析をし、更なる改良を試みる予定である。
新興・再興RNAウイルスの細胞内侵入メカニズムの分子機構解明
これまでにエンドサイトーシスによって細胞内に取り込まれたウイルスが、自身に含まれるユビキチン鎖を利用し、ストレス応答因子と考えられる宿主ヒストン脱アセチル化酵素ファミリーの一つであるHDAC6を呼び寄せ、ゲノムRNAをエンドソームから細胞質内に放出すること(脱殻)を明らかにしてきました
(Banerjee, Miyake et al., Science 2014)。さらに、この宿主因子であるHDAC6の酵素活性ドメインの分子構造を世界で初めて明らかにしました (Miyake
et al., Nat Chem Biol 2016)。最近、核輸送に関わる宿主因子のsiRNAによるスクリーニングから新たにトランスポーチン1(TNPO1)を同定し、TNPO1がインフルエンザウイルスの殻を構成しているM1タンパク質と相互作用することで、ウイルスゲノムRNAを細胞質内に分散させていることも明らかにしました
(Miyake et al., Nat Microbiol 2019)。これらの結果はウイルスが宿主タンパク質の機能を巧妙に利用することで細胞内へ侵入していること示しています。
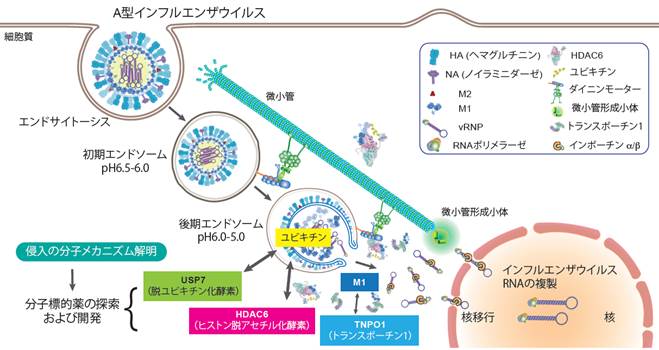 これまでの結果を踏まえ、現在、ウイルスのユビキチンシグナルがどのようにHDAC6を呼び寄せるのか、その詳細を分子生物学的に解析しています。インフルエンザウイルスの細胞内侵入における宿主因子の分子機能を明らかにすることで、宿主タンパク質を標的とした新規抗ウイルス薬の探索および開発を目指しています。
これまでの結果を踏まえ、現在、ウイルスのユビキチンシグナルがどのようにHDAC6を呼び寄せるのか、その詳細を分子生物学的に解析しています。インフルエンザウイルスの細胞内侵入における宿主因子の分子機能を明らかにすることで、宿主タンパク質を標的とした新規抗ウイルス薬の探索および開発を目指しています。
 本研究は、英国ブリストル大学の山内洋平博士
本研究は、英国ブリストル大学の山内洋平博士
(https://www.yamauchilab.com)
およびスイスFriedrich Miescher Institute for Biomedical
Research (FMI)のPatrick Matthias博士
(https://www.fmi.ch/research-groups/groupleader.html?group=21)
らと国際共同研究を展開しており、新興RNAウイルスである新型コロナウイルス(SARS-CoV-2) の細胞内侵入にも共通のメカニズムがあるのか、現在、検証しているところです。

